上調miRNA-335表達對肺癌細胞增殖、凋亡及對survivin表達的影響
高立偉,蘭守麗,閆江濤,左一凡,武素芳,張暉
平煤神馬醫療集團總醫院腫瘤二區(胸部腫瘤科),河南 平頂山 467000
肺癌是常見的呼吸系統惡性腫瘤,近年來,其發病率呈逐年上升的趨勢[1-2]。肺癌的發生及發展是一個多基因、多階段的過程,因此,研究肺癌的發病原因及發病機制具有重要的意義。微小核糖核酸(microRNA,miRNA)是在生物體內發現的由19~25個核苷酸組成的一類小分子RNA,近些年來在腫瘤中的作用已受到廣泛關注,已有多項研究顯示,miRNA與肺癌的發生發展、預后及診斷治療關系密切,如低表達的miRNA-21可以抑制肺癌細胞的增殖及分化,并促進細胞的凋亡[3-4];外周血中miRNA-143的含量可用于非小細胞肺癌的早期診斷及預后判斷[5]。miRNA-335定位于人染色體7q32.2,研究顯示,miRNA-335在乳腺癌、肺癌中呈現低表達,其高表達可降低腫瘤細胞的轉移及侵襲能力[6]。而miRNA-335在結腸癌中呈現高表達,可促進腫瘤細胞的轉移及侵襲,說明miRNA-335在不同腫瘤組織中發揮著不同的作用[7]。為了研究miRNA-335在肺癌中的作用,筆者利用miRNA-335的模擬物mimics轉染A549細胞,觀察細胞的增殖及凋亡情況,并進一步研究其作用機制,現報道如下。
1 材料與方法
1.1 材料
人肺癌A549細胞購自鄭州大學實驗室。胎牛血清、RPMI1640培養基均購自美國Gibco公司;二喹啉甲酸(bicinchoninic acid,BCA)試劑盒、細胞計數試劑盒-8(cell counting kit-8,CCK-8)、膜聯蛋白V-異硫氰酸熒光素(Annexin V-FITC)和碘化丙錠(PI)試劑盒均購自碧云天生物技術研究所;RNA提取試劑盒、LipofectamineTM2000試劑均購自美國Invitrogen公司;反轉錄試劑盒購自日本Takara公司;survivin、甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗體均購自美國Abcam公司;酶標儀、流式細胞儀均購自美國Bio-Rad公司;PCR擴增儀購自德國Eppendorf公司。
1.2 細胞培養及轉染
人肺癌A549細胞在37℃、5%CO2、95%飽和濕度的恒溫孵育箱中用含10%胎牛血清的RPMI1640細胞培養基傳代培養。每2~3天換液1次,細胞生長至80%融合時進行轉染。轉染分為3組,即對照組(不作任何處理)、空轉染組(轉染空載體)、過表達組(轉染miRNA-335 mimics)。轉染嚴格按照LipofectamineTM2000轉染說明進行操作。
1.3 RT-PCR檢測轉染效果
采用反轉錄PCR(reverse transcription PCR,RT-PCR)檢測轉染效果。取轉染48 h的上述3組細胞,采用Trizol法提取細胞中的總RNA,逆轉錄試劑盒反轉錄總RNA為cDNA。參照GenBank中的基因序列,利用Primer premier 6.0引物設計軟件設計目的基因miRNA-335及內參基因U6的RTPCR引物,以cDNA為模板,應用實時熒光定量PCR擴增儀進行擴增。所有引物均由上海生工生物工程有限公司合成。應用2-△△Ct法計算miRNA-335的mRNA相對表達量。
1.4 CCK-8檢測細胞增殖
人肺癌A549細胞以1×104/ml的濃度接種至96孔細胞培養板中,每孔加入100 μl,每孔設置3個復孔,培養箱中培養24 h后進行同步化處理,根據上述分組進行轉染,取轉染48 h的細胞,在每孔細胞中加入10 μl的CCK8溶液,培養箱內孵育2 h,利用全自動酶標儀檢測570 nm波長的吸光度(absorbance,A)。計算細胞存活率。細胞存活率=(轉染組細胞A值/對照組細胞A值)×100%。其中,每組實驗重復3次。
1.5 流式細胞儀檢測細胞凋亡
細胞分組同1.2,取轉染48 h的細胞,加入預冷的磷酸鹽緩沖溶液(PBS)洗滌細胞,胰蛋白酶消化細胞,調整細胞濃度為1×106/ml,根據細胞凋亡試劑盒的操作說明檢測各組細胞的凋亡情況。
1.6 蛋白質印跡法(Western blot)檢測survivin蛋白表達
收集轉染48 h的上述3組細胞,加入適量的細胞裂解液提取細胞中的蛋白,使用BCA試劑盒檢測提取蛋白的濃度,蛋白樣品與上樣緩沖液按照1∶5的比例充分混勻后置于100℃孵育器內煮沸變性10 min,每泳道30 μg蛋白樣品,10%的十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分離,半干法聚偏二氟乙烯(polyvinylidene fluoride,PVDF)轉染,5%的脫脂奶粉封閉,加入一抗(survivin抗體按照1∶500稀釋,GAPDH抗體按照1∶1000稀釋),4℃過夜,洗膜后加入1∶5000稀釋的HRP標記的羊抗鼠IgG,室溫孵育1 h,洗膜后增強化學發光法(enhanced chemiluminecence,ECL)顯色,X線片曝光,顯影,定影。
1.7 統計學方法
采用SPSS 21.0軟件對數據進行統計分析,計量資料以均數±標準差(±s)表示,各組間比較采用單因素方差分析,兩組間比較采用LSD-t檢驗,以P﹤0.05為差異有統計學意義。
2 結果
2.1 人肺癌A549細胞中miRNA-335的mRNA表達
對照組、空轉染組及過表達組miRNA-335的mRNA 相對表達量分別為(1.00±0.18)、(1.09±0.16)、(7.79±0.59),3組比較,差異有統計學意義(F=335.501,P﹤0.05)。其中,空轉染組與對照組miRNA-335的mRNA表達水平比較,差異無統計學意義(P﹥0.05);過表達組miRNA-335的mRNA表達水平高于對照組,差異有統計學意義(P﹤0.05)。(圖1)
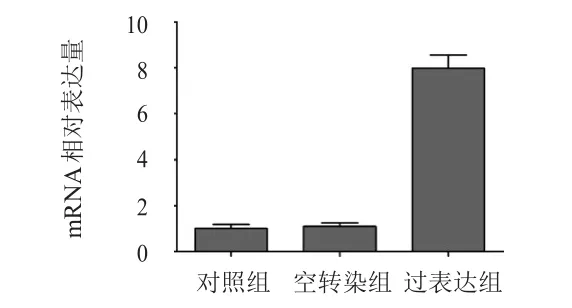
圖1 3組細胞中miRNA-335的mRNA相對表達量
2.2 過表達miRNA-335對A549細胞增殖的影響
對照組、空轉染組和過表達組的細胞存活率分別為(100.00±2.36)%、(96.56±3.46)%、(65.54±5.35)%,3組比較,差異有統計學意義(F=70.236,P﹤0.05)。其中,空轉染組與對照組的細胞存活率比較,差異無統計學意義(P﹥0.05),而過表達組的細胞存活率低于對照組,差異有統計學意義(P﹤0.05)。(圖2)
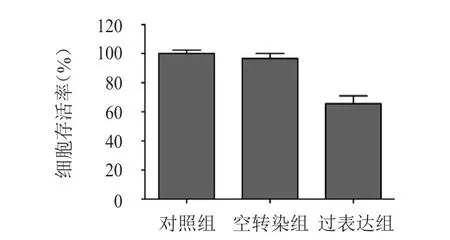
圖2 過表達miRNA-335對A549細胞增殖的影響
2.3 過表達miRNA-335對A549細胞凋亡的影響
對照組、空轉染組和過表達組的細胞凋亡率分別為(1.74±0.55)%、(1.78±0.58)%、(14.32±1.21)%,3組比較,差異有統計學意義(F=225.043,P﹤0.05)。其中,空轉染組與對照組的細胞凋亡率比較,差異無統計學意義(P﹥0.05),而過表達組的細胞凋亡率高于對照組,差異有統計學意義(P﹤0.05)。(圖3)
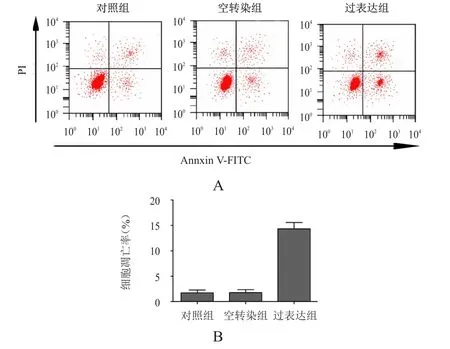
圖3 過表達miRNA-335對A549細胞凋亡的影響
2.4 miRNA-335過表達對survivin蛋白表達的影響
采用Western blot檢測凋亡相關蛋白survivin的表達水平,結果顯示,對照組、空轉染組和過表達組survivin的蛋白表達量分別為(0.554±0.047)、(0.566±0.046)、(0.102±0.016),3組比較,差異有統計學意義(F=137.441,P﹤0.05)。空轉染組與對照組的survivin蛋白表達水平比較,差異無統計學意義(P﹥0.05),而過表達組survivin的蛋白表達低于對照組,差異有統計學意義(P﹤0.05)。(圖4)
3 討論
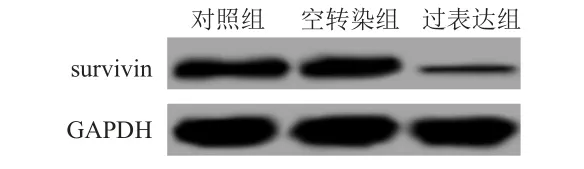
圖4 miRNA-335過表達對survivin蛋白表達水平的影響
目前,腫瘤的生物治療成為腫瘤治療的新思路,特別是利用基因治療腫瘤。近些年,miRNA作為重要的生物體基因調控分子,其與腫瘤的關系已成為生物領域研究的熱點。miRNA在結構及序列上進化保守,廣泛存在于生物體內,可在轉錄后對一個或多個基因的表達進行調控,參與細胞的增殖、凋亡、分化及個體的生長發育等生命過程[8]。在多種腫瘤中,miRNA發揮抑癌基因或癌基因的作用,與腫瘤的發生發展、轉移、復發等關系密切,如miRNA-378可參與非小細胞肺癌的腦轉移,促進細胞的侵襲、遷移,進而促進腫瘤血管的形成[9];miRNA-340在侵襲能力強的乳腺癌細胞中表達下調,誘導其表達可抑制腫瘤細胞的轉移及侵襲[10]。
miRNA-335作為miRNA家族中的一員,近些年的研究發現,在不同腫瘤中,miRNA-335發揮不同的作用。研究顯示,卵巢癌細胞中miRNA-335的表達水平降低或缺失,其表達與耐藥呈負相關[11];miRNA-335在胃癌細胞中可以通過靶向調控SP1的表達從而抑制腫瘤細胞的轉移及侵襲[12],而在星形膠質瘤細胞中miRNA-335呈高表達狀態,其表達可增強腫瘤細胞的增殖及侵襲能力[13]。因此,miRNA-335在肺癌中的作用尚需進一步的研究。
有研究顯示,miRNA-335在肺癌細胞中低表達[14],本研究結果顯示,過表達miRNA-335后,肺癌細胞的增殖受到抑制,凋亡數量增加。細胞凋亡在腫瘤的發生、發展過程中發揮著重要的調控作用,其過程受到抗凋亡基因和促凋亡基因的共同調控。survivin是凋亡蛋白抑制因子(inhibitor of apoptosis protein,IAP)家族中的一員,也是最強的凋亡抑制因子,可通過抑制含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase)的活性阻斷凋亡的發生,從而在腫瘤的發生、發展過程中發揮重要的作用[15]。研究顯示,survivin在肺癌、胃癌等多種腫瘤細胞中呈現高表達,在肺癌細胞中抑制其表達可誘導腫瘤細胞的凋亡[16-17]。本研究中,過表達miRNA-335后檢測肺癌細胞survivin的蛋白表達水平,結果顯示,survivin蛋白的表達水平降低,說明過表達miRNA-335可以通過下調survivin誘導肺癌細胞的凋亡。
綜上所述,上調肺癌細胞miRNA-335表達可以抑制腫瘤細胞的增殖,并通過下調survivin蛋白的表達誘導細胞凋亡。本研究從分子水平上為肺癌的發病原因尋找到了理想的標志物,也為肺癌的診斷與治療提供了線索。
參考文獻
[1]Markou A,Sourvinou I,Vorkas PA,et al.Clinical evaluation of microRNA expression profiling in non small cell lung cancer[J].Lung Cancer,2013,81(3):388-396.
[2]楊玲,王穎,張穎,等.肺癌患者血小板參數變化的分析[J].遼寧醫學雜志,2013,27(2):62-65.
[3]Kasinski AL,Kelnar K,Stahlhut C,et al.A combinatorial microRNA therapeutics approach to suppressing non-small cell lung cancer[J].Oncogene,2015,34(27):3547-3555.
[4]Xu LF,Wu ZP,Chen Y,et al.MicroRNA-21(miR-21)regulates cellular proliferation,invasion,migration,and apoptosis by targeting PTEN,RECK and Bcl-2 in lung squamous carcinoma,Gejiu City,China[J].PLoS One,2014,9(8):e103698.
[5]Zeng XL,Zhang SY,Zheng JF,et al.Altered miR-143 and miR-150 expressions in peripheral blood mononuclear cells for diagnosis of non-small cell lung cancer[J].Chin Med J(Engl),2013,126(23):4510-4516.
[6]Wang H,Li M,Zhang R,et al.Effect of miR-335 upregulation on the apoptosis and invasion of lung cancer cell A549 and H1299[J].Tumor Biol,2013,34(5):3101-3109.
[7]Lu Y,Yang H,Yuan L,et al.Overexpression of miR-335 confers cell proliferation and tumour growth to colorectal carcinoma cells[J].Mol Cell Biochem,2016,412(1-2):235-245.
[8]Zhao B,Han H,Chen J,et al.MicroRNA let-7c inhibits migration and invasion of human non-small cell lung cancer by targeting ITGB3 and MAP4K3[J].Cancer Lett,2014,342(1):43-51.
[9]Skrzypek K,Tertil M,Golda S,et al.Interplay between heme oxygenase-1 and mir-378 affects non-small cell lung carcinoma growth,vascularization,and metastasis[J].Antioxid Redox Signal,2013,19(7):644-660.
[10]Raychaudhuri M,Bronger H,Buchner T,et al.MicroRNAs miR-7 and miR-340 predict response to neoadjuvant chemotherapy in breast cancer[J].Breast Cancer Res Treat,2017,162(3):511-521.
[11]Cao J,Cai J,Huang D,et al.MiR-335 represents an invasion suppressor gene in ovarian cancer by targeting Bcl-w[J].Oncol Rep,2013,30(2):701-706.
[12]Yang B,Huang J,Liu H,et al.MiR-335 directly,while miR-34a indirectly modulate survivin expression and regulate growth,apoptosis,and invasion of gastric cancer cells[J].Tumor Biol,2016,37(2):1771-1779.
[13]Wang K,Chen X,Zhan Y,et al.miRNA-335 inhibits the proliferation and invasion of clear cell renal cell carcinoma cells through direct suppression of BCL-W[J].Tumor Biol,2015,36(9):6875-6882.
[14]Zu Y,Ban J,Xia Z,et al.Genetic variation in a miR-335 binding site in BIRC5 alters susceptibility to lung cancer in Chinese Han populations[J].Biochem Biophys Res Commun,2013,430(2):529-534.
[15]Ye Q,Cai W,Zheng Y,et al.ERK and AKT signaling cooperate to translationally regulate survivin expression for metastatic progression of colorectal cancer[J].Oncogene,2014,33(14):1828-1839.
[16]Zhang K,Li Y,Liu W,et al.Silencing survivin expression inhibits the tumor growth of non-small-cell lung cancer cells in vitro and in vivo[J].Mol Med Rep,2015,11(1):639-644.
[17]董倩,陳虎.順鉑聯合熱療對人胃癌耐藥細胞增殖及耐藥相關基因Survivin表達的影響[J].中國老年學,2013,33(13):3029-3031.

