31例原發性雙側乳腺癌患者的臨床特征分析
呂淑貞,李艷萍,呂大鵬,郭怡暉,趙霞
首都醫科大學附屬北京世紀壇醫院乳腺外科,北京 100038
乳腺癌是目前全世界女性最常見的惡性腫瘤之一,是女性第二常見的惡性腫瘤死亡原因,僅次于肺癌[1]。原發性雙側乳腺癌在乳腺癌中較為少見,占乳腺癌的2%~11%[2]。近年來,隨著中國乳腺癌發病率的不斷提高,雙側乳腺癌患者的數量也呈上升趨勢。因此,如何正確認識、合理診治雙側乳腺癌,對于提高雙側乳腺癌的治療效果及降低病死率具有重要意義。本研究對31例原發性雙側乳腺癌患者的病歷資料進行回顧性分析,旨在研究原發性雙側乳腺癌患者的臨床特征,以期進一步提高對原發性雙側乳腺癌的認識,從而為臨床診療提供更多依據。
1 資料與方法
1.1 一般資料
連續性收集2009年1月至2015年4月于北京世紀壇醫院乳腺中心接受治療的原發性雙側乳腺癌患者共31例,均為女性。
1.2 診斷標準
原發性雙側乳腺癌診斷標準可參照Chaudary等[3]的標準:①對側腫瘤內含原位癌成分;②兩側組織病理學不同;③第二側腫瘤細胞分化相對較好;④病變的第一側無腫瘤復發和轉移的證據;⑤如果雙側病理相同,應滿足第4條;⑥結合其他指標,如腫瘤位置(外上象限占多數)、腫瘤生長部位(乳腺組織內)、生長方式(浸潤性生長)及輔助診斷的影像學證據。原發性雙側乳腺癌根據第二原發癌發生的時間被分為同時性雙側乳腺癌和異時性雙側乳腺癌。同時性雙側乳腺癌是雙側乳腺癌發病的時間間隔≤12個月,異時性雙側乳腺癌被定義為雙側乳腺癌發病的時間間隔﹥12個月。
1.3 數據收集
采集患者的臨床特征,如年齡、腫瘤大小(T)、腋窩淋巴結轉移數目、TNM分期、激素受體狀態、第一原發癌與第二原發癌發病的時間間隔、化療及內分泌治療情況及腫瘤初診方式等。
1.4 統計學分析
采用SPSS 17.0軟件對數據進行處理。計數資料以率(%)表示,組間比較采用χ2檢驗。以P﹤0.05為差異有統計學意義。
2 結果
2009年1月至2015年4月于本院接受治療的原發性雙側乳腺癌患者共31例,占同期全部乳腺癌的3.1%(31/1004)。同時性和異時性:原發性雙側乳腺癌患者中,同時性雙側乳腺癌患者9例,占原發性雙側乳腺癌的29.0%(9/31),占同期全部乳腺癌的0.9%(9/1004);異時性雙側乳腺癌患者22例,占原發性雙側乳腺癌的71.0%(22/31),占同期全部乳腺癌的2.2%(22/1004)。年齡:原發性雙側乳腺癌患者的第一側中位發病年齡為49歲(28~76歲),第二側中位發病年齡為60歲(32~82歲);同時性雙側乳腺癌患者的第一側(同一時間診斷的雙側乳腺癌的“第一側”指腫塊較大的一側)[2]中位發病年齡為57歲(32~76歲);異時性雙側乳腺癌患者的第一側中位發病年齡為49歲(28~76歲)。發病間隔時間:原發性雙側乳腺癌患者第一原發癌與第二原發癌發生的中位時間間隔為8年(0~25年);異時性雙側乳腺癌患者第一原發癌與第二原發癌發生的中位間隔時間為11年(1~25年)。腫瘤大小:原發性雙側乳腺癌第二原發癌的初診腫瘤大小較第一原發癌偏小,差異有統計學意義(P﹤0.05)。TNM分期:原發性雙側乳腺癌第二原發癌初診時TNM分期較第一原發癌早,差異有統計學意義(P﹤0.05);第二原發癌的TNM分期以0期或Ⅰ期較為多見。腋窩淋巴結轉移情況:原發性雙側乳腺癌第一原發癌與第二原發癌的腋窩淋巴結轉移情況比較,差異無統計學意義(P﹥0.05)。激素受體及內分泌治療情況:原發性雙側乳腺癌第一原發癌與第二原發癌的激素受體狀態比較,差異無統計學意義(P﹥0.05);第一原發癌中20例患者接受了內分泌治療,第二原發癌中激素受體陽性的患者均接受了內分泌治療。手術治療情況:原發性雙側乳腺癌第一原發癌中有5例患者接受了保乳手術,第二原發癌中有6例患者接受了保乳手術,差異無統計學意義(P﹥0.05)。初診方式:原發性雙側乳腺癌第一原發癌與第二原發癌通過自檢發現的比例分別為64.5%、41.9%,由臨床醫師手診、超聲及鉬靶X線檢查發現的比例分別為35.5%、58.1%,其中有2例(6.5%)對側乳腺癌漏診,通過MRI檢查發現。(表1)
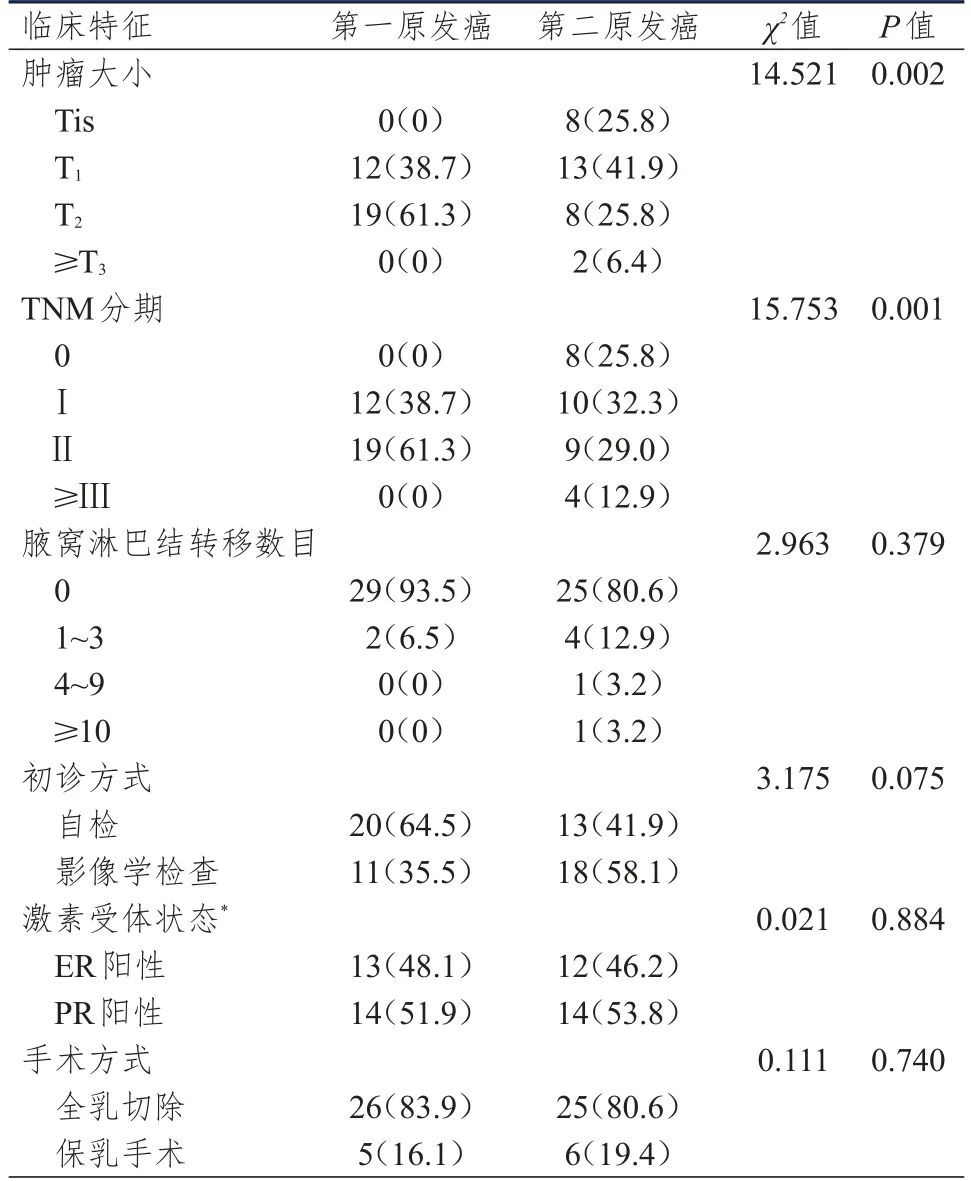
表1 原發性雙側乳腺癌患者的臨床特征[n(%)]
3 討論
據報道,在因乳腺癌行對側乳腺病理學活檢,及因臨床腫瘤陰性行乳房切除的患者中雙側乳腺癌的發生率可達20%[4],臨床上觀察到的雙側乳腺癌占同期全部乳腺癌的比例為2%~11%[2]。本研究中,原發性雙側乳腺癌占同期全部乳腺癌的比例為3.1%,其中同時性雙側乳腺癌的比例為0.9%,異時性雙側乳腺癌的比例為2.2%,與既往研究報道相似。
本研究中,原發性雙側乳腺癌第一原發癌的發病年齡為28~76歲,中位發病年齡為49歲。越來越多研究結果顯示,年齡可能是影響對側乳腺癌發生的重要因素[4-5]。第一原發癌的發病年齡越早,對側乳腺癌的發病風險越大[6],這可能與患者預期壽命的增加有關,當一側乳腺癌發病后對側發生乳腺癌的風險每年增加0.5%~1.0%[7]。另外,遺傳因素也可能是導致原發性雙側乳腺癌發生的重要因素。Narod等[6]對瑞典籍78 775例乳腺癌患者的分析結果顯示,在罹患乳腺癌的患者中,若母親罹患乳腺癌,其對側乳腺癌的發生風險較無乳腺癌家族史的患者明顯增高,且第一原發癌的發病年齡小于50歲的患者,其對側乳腺癌的發生風險明顯高于第一原發癌的發病年齡大于或等于50歲的患者。因此,當評估患者對側乳腺癌發病風險時,需考慮第一原發癌患者的發病年齡及乳腺癌家族史。
本研究結果顯示,第二原發癌與第一原發癌相比,腫瘤偏小、TNM分期更早,且有較高的原位癌比例(25.8%),該結果與其他研究結果相似[8],原因可能與乳腺癌患者發生第一原發癌后加強了對側乳腺的隨訪有關。按期及按規律復查有助于病灶的早期檢出。本研究中,第一原發癌經影像學檢查發現的比例為35.5%,而第二原發癌為58.1%。關于MRI在對側乳腺癌診斷中的價值存在爭議,Moore等[9]認為在高風險年青女性中使用乳房MRI篩查與乳腺X線攝影相比似乎并不符合成本效益,其在乳腺癌篩查方面的作用有待進一步探討。多個研究顯示MRI在診斷乳腺癌方面相比傳統方法有更高的敏感性,尤其是在可疑患者或已知患有腫瘤的患者中[10-12]。Debald等[13]對1102例原發性乳腺癌患者的分析結果顯示,MRI檢查發現了28例(2.5%)常規檢查未發現的對側乳腺癌患者,對于絕經前乳腺組織高度致密、小葉來源的乳腺癌患者似乎更能從MRI檢查中獲益。在本研究中,有2例(6.5%)患者超聲及鉬靶檢查均漏診,通過MRI掃描發現。乳房鉬靶及超聲檢查仍是對有第一原發癌的乳腺癌患者進行篩查的有效、方便的方法,提高對側腫瘤的檢出率,MRI因具有較高的敏感性,其使用在高風險患者中仍具有一定的臨床意義。
原發性雙側乳腺癌應視為兩個獨立的腫瘤,不同于轉移性乳腺癌,并不是腫瘤晚期,其治療與單側乳腺癌相似。在原發性雙側乳腺癌的臨床治療中應結合臨床分期,采取以手術為主的綜合治療,可行雙側乳腺癌根治術或改良根治術,有適應證時亦可考慮行保乳手術。根據淋巴結轉移及激素受體情況輔以適當的放療、化療或內分泌治療。雙側乳腺癌的預后主要取決于臨床分期及生物學特性,在經及時、適當治療后,雙側乳腺癌患者的預后與單側乳腺癌患者比較,差異無統計學意義(P﹥0.05)。O’Brien等[14]對雙側乳腺癌行保乳手術的患者進行了5年及10年的隨訪觀察,結果顯示:無論是同時性雙側乳腺癌患者還是異時性雙側乳腺癌患者,總生存情況均良好,只是同時性雙側乳腺癌患者較異時性雙側乳腺癌患者選擇保乳手術的比例偏低。
對側乳腺癌的預防隨著對疾病的認識日益完善。Angelos等[15]研究結果顯示,對于攜帶BRCA或其他基因突變、診斷時的年齡偏小、腫瘤組織學來源于小葉、有乳腺癌家族史及既往接受過胸壁照射的乳腺癌患者可考慮對側乳房預防性切除,該方式雖能降低對側乳腺癌的發病率,但對患者的無病生存及總生存情況的影響尚不明確。化療可降低對側乳腺癌的發生風險,但也有研究顯示,化療對于對側乳腺癌發病風險的降低僅體現在第一個5年內,在隨后的幾年中對側乳腺癌的發生風險并未明顯降低[16]。三苯氧胺及芳香化酶抑制劑在治療第一側原發癌的同時,對預防第二側原發癌的發生也有重要作用。在對側乳腺癌的預防方面,芳香化酶抑制劑比三苯氧胺更有優勢,相關研究表明,70%~80%的雌激素受體陽性乳腺癌可以通過這些藥物預防[17]。
綜上所述,對于已罹患乳腺癌的患者,應定期進行對側乳房體檢并結合鉬靶、超聲或MRI等影像學檢查,對可疑病灶應給予積極處理,從而提高對側乳腺癌的早期診斷率,進而提高雙側乳腺癌患者的治愈率及生存率。
參考文獻
[1]Siege RL,Miller KD,Jemal A.Cancer statistics,2015[J].CACancer J Clin,2015,65(1):5-29.
[2]余科達,狄根紅,吳炅,等.原發性雙側乳腺癌103例的臨床病理分析[J].中國癌癥雜志,2006,16(5):362-366.
[3]Chaudary MA,Millis RR,Hoskins EO,et al.Bilateral primary breast cancer:a prospective study of disease incidence[J].Br J Surg,1984,71(9):711-714.
[4]Carmichael AR,Bendall S,Lockerbie L,et al.The longterm outcome of synchronous bilateral breast cancer is worse than metachronous or unilateral tumours[J].Eur J Surg Oncol,2002,28(4):388-391.
[5]Brenner H,Engelsmann B,Stegmaier C,et al.Clinical epidemiology of bilateral breast cancer[J].Cancer,1993,72(12):3629-3635.
[6]Narod SA,Kharazmi E,Fallah M,et al.The risk of contralateral breast cancer in daughters of women with and without breast cancer[J].Clin Genet,2016,89(3):332-335.
[7]Chen Y,Thompson W,Semenciw R,et al.Epidemiology of Contralateral Breast Cancer[J].Cancer Epidemiol Biomarkers Prev,1999,8(10):855-861.
[8]Agelopoulos K,Tidow N.Molecular cytogenetic investigations of synchronous bilateral breast cancer[J].J Clin Pathol,2003,56(9):660
[9]Moore SG,Shenoy PJ,Fanucchi L,et al.Cost-effectiveness of MRI compared to mammography for breast cancer screening in a high risk population[J].BMC Health Serv Res,2009,9:9.
[10]Lee SG,Orel SG,Woo IJ,et al.MR imaging screening of the contralateral breast in patients with newly diagnosed breast cancer:preliminary results[J].Radiology,2003,226(3):773-778.
[11]Boetes C,Veltman J.Screening women at increased risk with MRI[J].Cancer Imaging,2005,5:S10-S15.
[12]Weinstock C,Campassi C,Goloubeva O,et al.Breast magnetic resonance imaging(MRI)surveillance in breast cancer survivors[J].Springerplus,2015,4:459.
[13]Debald M,Abramian A,Nemes L,et al.Who may benefit from preoperative breast MRI?A single-center analysis of 1102 consecutive patients with primary breast cancer[J].Breast Cancer Res Treat,2015,153(3):531-537.
[14]O’Brien JA,Ho A,Wright GP,et al.Breast-conserving surgery in bilateral breast cancer[J].Ann Surg Oncol,2015,22(10):3389-3396.
[15]Angelos P,Bedrosian I,Euhus DM,et al.Contralateral prophylactic mastectomy:challenging considerations for the surgeon[J].Ann Surg Oncol,2015,22(10):3208-3212.
[16]Hooning MJ,Aleman BM,Hauptmann M,et al.Roles of radiotherapy and chemotherapy in the development of contralateral breast cancer[J].J Clin Oncol,2008,26(34):5561-5568.
[17]Cuzick J.Aromatase Inhibitors for Breast Cancer Prevention[J].J Clin Oncol,2005,23(8):1636-1643.

