外源有機碳濃度對藻菌關系及氮磷去除的影響
秦攀偉,吳克明,劉俊琢,吳永紅
(1. 武漢科技大學資源與環境工程學院,湖北 武漢,430081; 2. 中國科學院南京土壤研究所土壤與農業可持續發展國家重點實驗室,江蘇 南京, 210008)
如何高效且環境友好地去除與回收水體中過量的氮、磷等營養物質從而凈化水質一直是全球資源環境研究者關注的焦點問題[1]。藻類通過吸收水體中氮、磷等營養物質進行光合作用,可以凈化水質并固定二氧化碳,減少溫室氣體的排放,該方法不僅經濟高效,而且符合生態規律。
長期以來,利用藻類去除氮、磷的研究主要集中于藻種的篩選及其去除效果的比較,經常忽略異養細菌在其中所起的作用[2]。藻類和細菌間存在著共生、競爭、拮抗等相互關系,但這種相互關系如何影響藻類對水體氮、磷的去除能力還需開展深入研究。此外,可溶性有機碳含量對藻、菌相互關系具有顯著影響,在藻菌體系中,雖然只有異養細菌的生長受可溶性有機碳的限制[3],但細菌的生長和代謝變化會使藻、菌相互關系發生變化,并改變水體中的pH和溶解氧等環境因子,進一步影響藻菌體系整體的生理和生態功能。本文以地衣芽孢桿菌和絲藻的復合體系為研究對象,重點研究了不同濃度有機碳條件下藻、菌關系及其氮、磷去除能力,探討如何通過調控外源碳濃度來提升藻菌體系富集營養物的能力,以期為優化利用藻菌體系凈化水質提供參考。
1 實驗材料和方法
1.1 實驗藻種與菌種
實驗藻種選用絲藻(Ulothrixsp.,中國科學院水生生物研究所淡水藻種庫,編號FACHB-494),純藻液使用滅菌處理后的WC培養基[4]在25 ℃光照恒溫培養箱中培養,光照度為4000 lux,光暗比為12 h∶12 h。實驗菌種選用地衣芽孢桿菌(Bacilluslicheniformis,中國普通微生物菌種保藏中心,編號CGMCC 1.807),經恢復培養后接種于LB培養基,放置在溫度為30 ℃、轉速為100 r/min的培養箱中培養24 h后備用。
1.2 人工模擬含氮、磷廢水制備
為避免諸多不確定因素對實驗結果的干擾,以不含氮、磷的WC培養基為基礎,加入(NH4)2SO4及KH2PO4(均為分析純)模擬含氮、磷廢水,水體中主要化學物質質量濃度指標:TN為15mg/L、TP為1.5mg/L、CaCl2·2H2O為 36.76 mg/L、MgSO4·7H2O為36.79 mg/L、NaHCO3為12.6mg/L、Na2SiO3·9H2O為28.42 mg/L、H3BO3為24 mg/L。將模擬廢水置于高溫滅菌鍋中121 ℃滅菌處理30 min,隨后冷卻至室溫,再用0.1 mol/L的鹽酸或氫氧化鈉將其pH值調至7。
1.3 實驗過程
1.3.1 有機碳的加入
將模擬廢水分為5組,其中4組分別添加適量葡萄糖(分析純)使水體中葡萄糖質量濃度ρ依次為20、50、100、150 mg/L。
1.3.2 接種處理
絲藻接種時取無菌培養的純種絲藻,將其經鑷子擠壓至無明顯水分析出后稱取0.1 g轉接至100 mL模擬廢水中;地衣芽孢桿菌接種時吸取菌液2 mL(大約106CFU/mL),以4000 r/min的速率離心處理10 min,去除上清液后,用無菌水洗滌2次,然后接種到100 mL模擬廢水中;藻菌組合接種處理時按上述步驟分別將絲藻及地衣芽孢桿菌接種至同一裝有100 ml模擬廢水的錐形瓶中。5組模擬廢水均按上述步驟分別進行絲藻、地衣芽胞桿菌以及藻菌組合的接種處理,每種處理重復3次。以上操作全部在無菌條件下進行,接種完成后錐形瓶覆以透氣無菌封口膜,置于25℃光照培養箱中培養,光暗比為12h∶12h。
1.3.3 指標測定
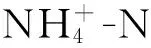
1.4 數據處理與統計分析
所得實驗數據借助SPSS 21.0統計軟件進行比較和分析。模擬水體中氮、磷的去除率計算公式為
(1)
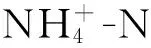
2 結果與討論
2.1 絲藻細胞葉綠素熒光值變化分析
水體中絲藻細胞的葉綠素熒光值測試結果如圖1所示。由如圖1(a)可以看出,在不含葡萄糖的模擬水體中,藻菌體系中絲藻細胞的葉綠素實時熒光值從實驗開始一直高于純絲藻體系相應值,并在實驗第5日達到最大值5123,比純絲藻體系相應值4537增加了12.9%,表明地衣芽孢桿菌促使絲藻的生物量顯著增加(p<0.05),這與Liang等[7]的研究結果一致。然而到了實驗第7日,藻菌體系中絲藻細胞的葉綠素實時熒光值明顯下降,而純藻體系中絲藻細胞的相應值持續增加最終超過前者。造成這種現象的原因可能是藻菌快速生長使培養基微環境發生變化,如有毒代謝物的產生、營養物不足或環境pH值的改變等,從而導致絲藻生長過程衰退[8];從圖1(b)可知,同樣的現象發生在葡萄糖質量濃度為20mg/L的水體環境中,藻菌體系的生物量從實驗開始至實驗第5日始終高于純絲藻體系相應值(p<0.05),但二者差距較未添加葡萄糖時有所減小。實驗第7日藻菌體系的生物量急劇下降,而純絲藻體系中絲藻細胞的葉綠素實時熒光值繼續上升達至最大值5108,這與藻菌體系在實驗第5日獲得的最大葉綠素熒光值5226無明顯差異(p>0.05),上述結果表明,地衣芽孢桿菌在外加有機碳濃度較低時促進了絲藻的生長,縮短了絲藻的生長周期;由圖 1(c)可見,當模擬水體中葡萄糖質量濃度為50 mg/L時,純絲藻和藻菌體系中絲藻細胞的葉綠素熒光值變化曲線基本重合,二者熒光強度無明顯差異;當葡萄糖質量濃度增加到100 mg/L(圖1(d))和150 mg/L(圖1(e))時,純絲藻和藻菌體系絲藻細胞的葉綠素熒光值又開始出現明顯差異(p<0.05),但與圖1(a)、1(b)測試結果不同的是,此時地衣芽孢桿菌明顯抑制了絲藻的生長,表明細菌和藻類的相互作用并非一成不變,而是隨著水體環境的變化而發生改變,這與Guo等[9]的研究結果一致,當培養條件從光合自養變為光合異養時,小球藻與假單胞菌的關系從共生轉變為競爭。地衣芽孢桿菌對絲藻生長的抑制作用可能是因藻菌對限制性營養物質競爭所造成[10],由于水體中葡萄糖濃度增加,細菌生長速度加快,它們的迅速增殖將消耗更多的營養物質,造成藻類生長所需的營養物質缺乏從而導致其生長受到限制,因此本文中高濃度葡萄糖添加條件下絲藻的葉綠素熒光值顯著低于無葡萄糖添加條件下的相應值(p<0.05)。
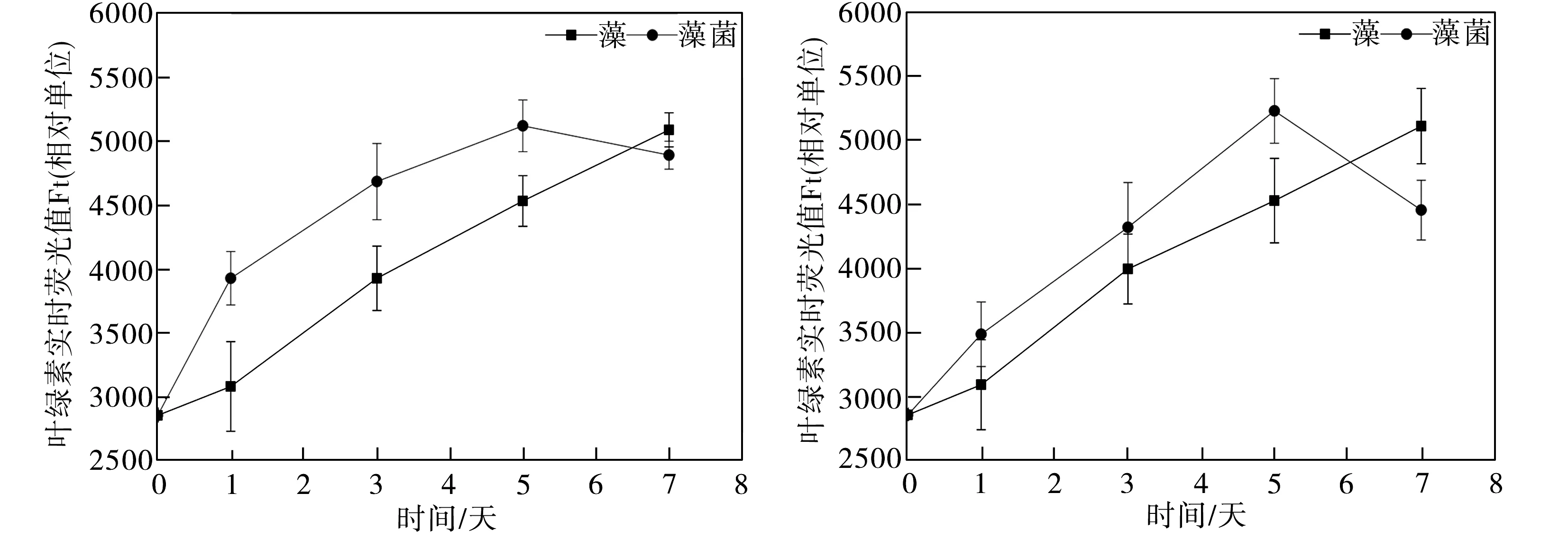
(a)未添加葡萄糖 (b)ρ=20 mg/L
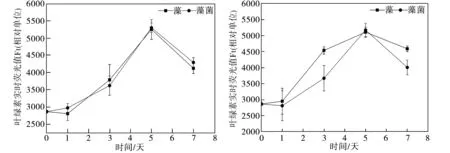
(c)ρ=50 mg/L (d)ρ=100 mg/L
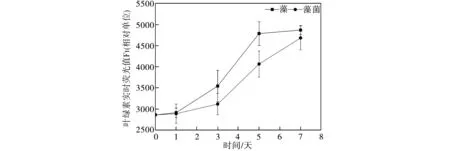
(e)ρ=150 mg/L
2.2 水體中氮濃度的變化分析
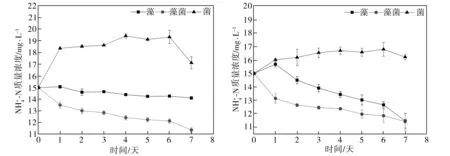
(a)未添加葡萄糖 (b)ρ=20 mg/L
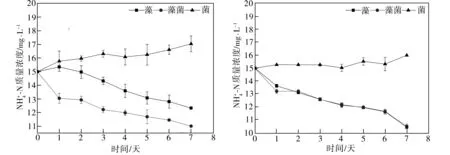
(c)ρ=50 mg/L (d)ρ=100 mg/L
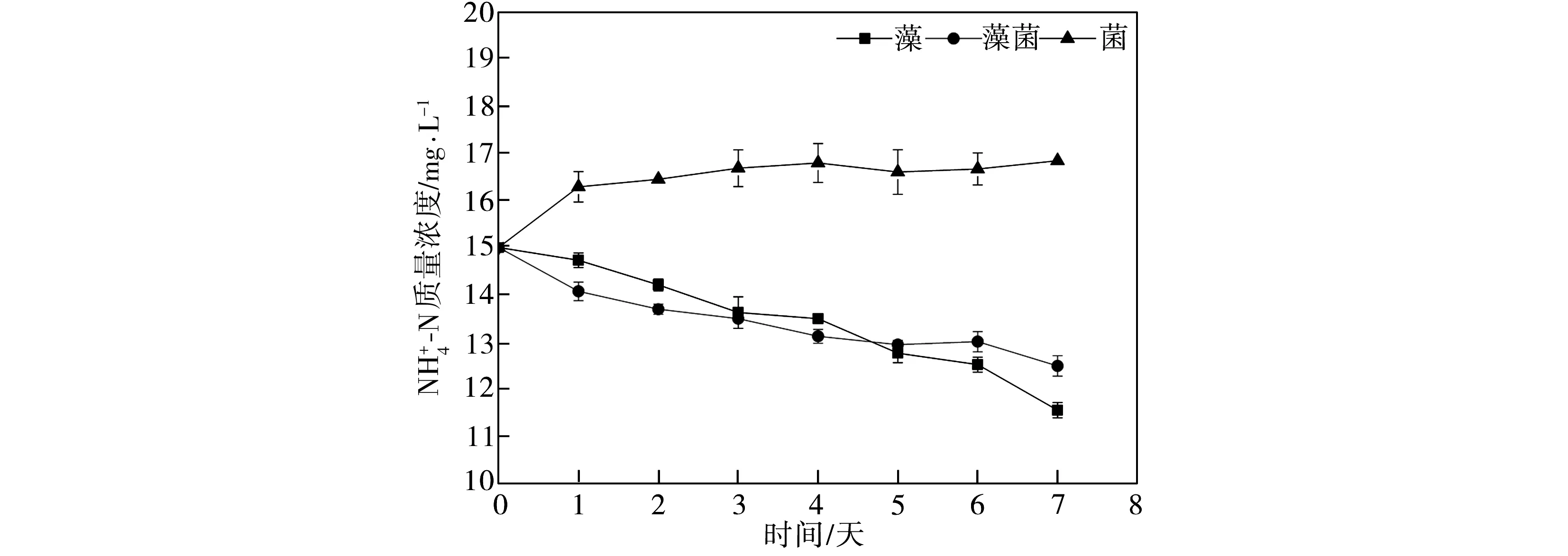
(e)ρ=150 mg/L
2.3 水體中磷濃度的變化分析
(a)未添加葡萄糖 (b)ρ=20 mg/L
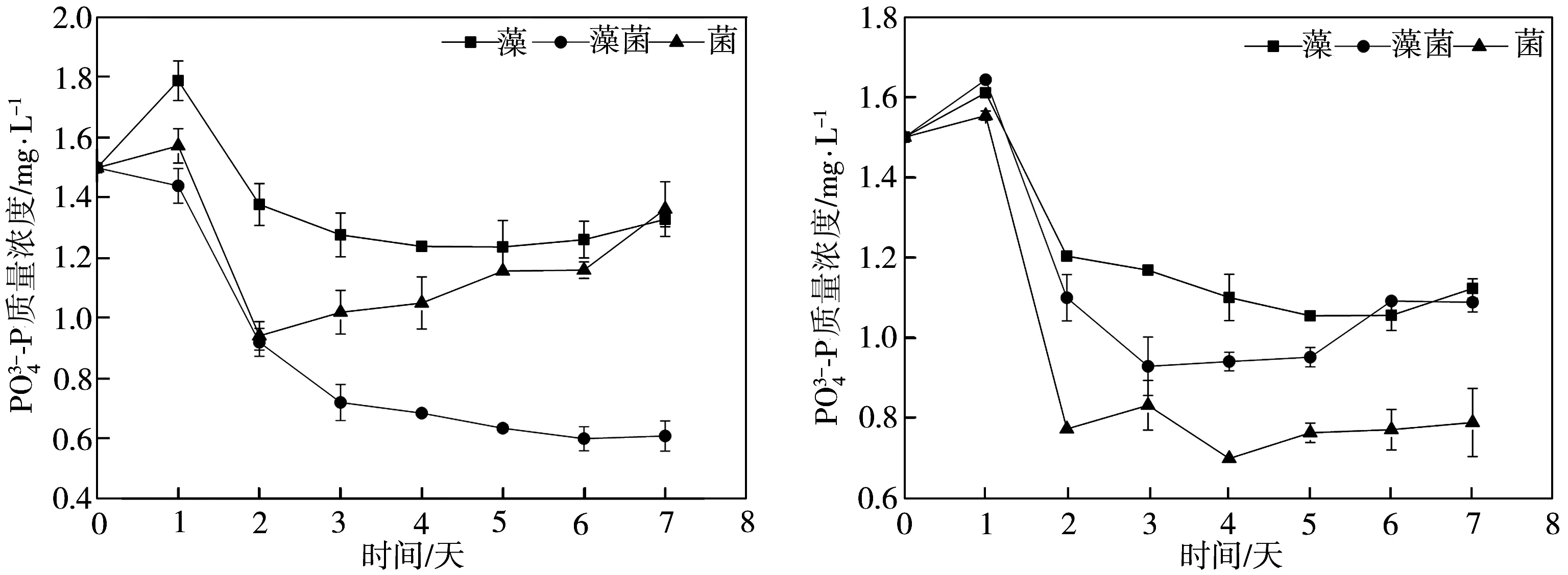
(c)ρ=50 mg/L (d)ρ=100 mg/L

(e)ρ=150 mg/L
3 結論
(1) 當水體中葡萄糖質量濃度不高于20 mg/L時,藻菌組合體系中地衣芽孢桿菌可以促進絲藻生長,并能顯著促進絲藻體系對水體中的氮、磷的去除;當水體中葡萄糖質量濃度高于50 mg/L時,地衣芽孢桿菌抑制絲藻生長,藻菌組合處理對水體中氮、磷的去除能力下降。
(2) 通過改變外源有機碳濃度可以調控藻、菌相互關系,從而使藻菌組合體系在實際應用中能最大限度地發揮其污水凈化能力。
參考文獻
[1] Liu J, Danneels B, Vanormelingen P,et al. Nutrient removal from horticultural wastewater by benthic filamentous algaeKlebsormidiumsp.,Stigeocloniumspp. and their communities: from laboratory flask to outdoor Algal Turf Scrubber (ATS) [J]. Water Research, 2016, 92:61-68.
[2] 章斐,陳秀榮,江子建,等. 不同氮磷濃度下2種無毒微藻的生長特性和脫氮除磷效能[J]. 環境工程學報,2015,9(2):559-566.
[3] 易齊濤. 海洋菌-藻關系及對營養鹽的吸收作用研究[D].青島:中國海洋大學,2006.
[4] Hametner C, Stocker-W?rg?tter E, Rindi F, et al. Phylogenetic position and morphology of lichenized Trentepohliales (Ulvophyceae, Chlorophyta) from selected species of Graphidaceae[J]. Phycological Research, 2014, 62(3):170-186.
[5] 梁瑜,王朝暉. 應用葉綠素熒光法測定微藻生物量的方法[J]. 生態科學,2009,28(5):420-423.
[6] 魯如坤. 土壤農業化學分析方法[M]. 北京:中國農業科技出版社,2000:129-130.
[7] Liang Z, Liu Y, Ge F, et al. Efficiency assessment and pH effect in removing nitrogen and phosphorus by algae-bacteria combined system ofChlorellavulgarisandBacilluslicheniformis[J]. Chemosphere, 2013, 92(10):1383-1389.
[8] 王高學,姚嘉赟,王綏標. 復合藻-菌系統水質凈化模型建立與凈化養殖水體水質的研究[J]. 西北農業學報,2006,15(2):22-27.
[9] Guo Z, Tong Y W. The interactions betweenChlorellavulgarisand algal symbiotic bacteria under photoautotrophic and photoheterotrophic conditions[J]. Journal of Applied Phycology, 2014, 26(3):1483-1492.
[10] Hyenstrand P, Burkert U, Pettersson A,et al. Competition between the green algaScenedesmusand the cyanobacteriumSynechococcusunder different modes of inorganic nitrogen supply[J]. Hydrobiologia, 2000, 435(1-3):91-98.
[11] Krul J M, Veeningen R. The synthesis of the dissimilatory nitrate reductase under aerobic conditions in a number of denitrifying bacteria, isolated from activated sludge and drinking water[J]. Water Research, 1977, 11(1):39-43.
[12] de-Bashan L E, Moreno M, Hernandez J P, et al. Removal of ammonium and phosphorus ions from synthetic wastewater by the microalgaeChlorellavulgariscoimmobilized in alginate beads with the microalgae growth-promoting bacteriumAzospirillumbrasilense[J]. Water Research, 2002, 36(12):2941-2948.
[13] 張艷敏,王江濤,譚麗菊. 海水中藻菌共培養體系對碳氮磷的吸收轉化[J]. 生態學報,2017,37(14):4843-4851.
[14] 王榮昌,程霞,曾旭. 污水處理中菌藻共生系統去除污染物機理及其應用進展[J]. 環境科學學報, 2018,38(1):13-22.
[15] Lu H, Feng Y, Wu Y,et al. Phototrophic periphyton techniques combine phosphorous removal and recovery for sustainable salt-soil zone[J]. Science of the Total Environment, 2016, 568:838-844.
[16] 連子如,王江濤. 不同濃度碳源下中肋骨條藻和海洋異養細菌對磷酸鹽的競爭吸收研究[J]. 中國海洋大學學報, 2009,39(S):237-241.

