鉬礦石的物相分析及其氧化率
劉翠華
(中國冶金地質總局第三地質中心實驗室, 山西 太原 030002)
自然界中已知的鉬礦物及含鉬礦物約有30種,其中分布最廣且具有現實工業價值的是輝鉬礦(MoS2)。其他較常見的含鉬礦物還有鐵鉬華Fe2(MoO4)3·8H2O、鉬華MoO3、鉬鈣礦CaMoO4、鉬鉛礦PbMoO4等屬于鉬的氧化礦物和鉬酸鹽礦物,較難選冶和利用。按鉬礦石氧化率的不同,即氧化鉬中的鉬含量與全鉬含量之比可劃分為:硫化礦石(氧化率小于10%)、氧化礦石(氧化率不小于10%)。對于氧化礦石中硫化鉬的回收利用,選礦工藝復雜,回收成本高,必須加強選冶試驗研究,提出有效回收利用的可能途徑。因此,實驗室必須給地質勘查人員和礦山開發提供準確的輝鉬礦和鉬的氧化礦物分析數據,便于鉬礦石選礦方法的選擇和判斷鉬礦的利用價值。
本文在前人鉬礦物相分析基礎上,根據礦區特點,建立了不含大量酸溶硫化物情況下,以鹽酸(1+3)分離、以電感耦合等離子體發射光譜法或硫氰酸鹽光度法測定鉬礦石中的硫化鉬和氧化物鉬的分析方法。并且試驗分析了礦石樣品中的全鐵和氧化亞鐵,將鐵的氧化情況與鉬的氧化情況做了對比。本文中全鉬量以QMo、氧化物鉬量以OMo、硫化鉬量以SMo表示。
1 實驗部分
1.1 儀器及工作參數
1.1.1 ICAP6300電感耦合等離子體原子發射光譜儀(見表 1)
1.1.2 721型分光光度計(上海第二分析儀器廠)
1.2 標準溶液和主要試劑
1)鉬標準溶液[ρ(Mo)=100 μg/mL]。0.1500 g三氧化鉬(99.99%,預先500℃灼燒過),置于100 mL燒杯中,加入氫氧化鈉溶液(200 g/L)5 mL溶解,再用硫酸(1+1)中和至微酸性,并過量 20 mL,移入1000 mL容量瓶中,用水稀釋到刻度,搖勻。
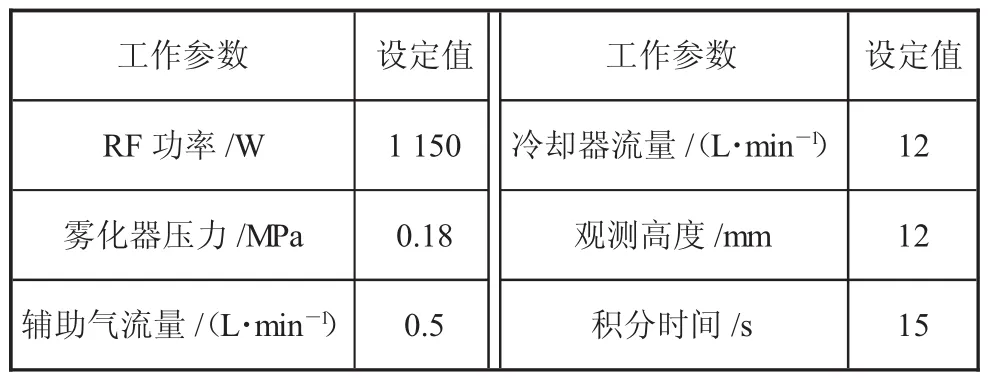
表1 ICAP6300等離子體發射光譜儀工作參數
2)過氧化鈉、氫氧化鈉、檸檬酸鈉、硫脲、硫氰酸鉀、硫酸銅等均為分析純試劑。
3)重鉻酸鉀標準溶液[c(1/6K2Cr2O7)=0.0300 mol/L]。稱取1.4709 g預先在150℃烘干1 h冷卻至室溫的重鉻酸鉀(基準試劑),溶于水,移至1000 mL容量瓶中,用水稀釋到刻度,混勻。
1.3 實驗方法
1.3.1 全鉬量測定
稱取試樣0.2 g(精確到0.0001 g)于剛玉坩堝中,加3 g過氧化鈉,用玻璃棒攪勻,上面覆蓋約0.5 g過氧化鈉,置于預先升溫至650~700℃的高溫爐中,熔融10 min,使坩堝內熔物呈透明流體時取出,冷卻。將坩堝置于250 mL燒杯中,蓋上表面皿,加入80~90℃熱水約50 mL,待坩堝內熔體全部脫落后,用適量水洗去表皿,洗出坩堝,蓋上表面皿(如溶液呈綠色,加入幾滴無水乙醇使錳的綠色褪去),加熱煮沸2~3 min,至無小氣泡時取下,冷卻[1]。用水洗去表面皿并將溶液移入100 mL容量瓶中,水稀釋至刻度,搖勻,放置澄清或干過濾。
1.3.1.1 硫氰酸鹽光度法
分取10 mL濾(清)液于50 mL容量瓶中,加1滴酚酞指示劑(10 g/L),硫酸(1+1)中和至溶液從無色經紅色變為無色,再加入9 mL硫酸(1+1),水到30 mL左右,加檸檬酸鈉1 g,搖動溶解,冷卻。加入1.5 mL硫酸銅溶液(20 g/L),搖勻,加入7 mL硫脲溶液(100 g/L),搖勻。放置5 min,加入5 mL硫氰酸鉀溶液(250 g/L),用水稀釋至刻度,搖勻,放置15 min后,460 nm處,1 cm或3 cm比色皿于分光光度計上測量吸光度。
標準系列:分取 0、0.25、0.50、0.75、1.00、1.50、2.00、2.50、3.00 mL鉬標準溶液,分別于一組50 mL容量瓶,9.5 mL硫酸(1+1),水稀釋到30 mL左右,以下操作同上。
1.3.1.2 ICP-AES法
分取10 mL濾(清)液于50 mL容量瓶中,加1滴酚酞指示劑,鹽酸(1+1)調至無色后過量5 mL,水稀釋到刻度,電感耦合等離子體發射光譜法測定,波長202.03 nm[2]。
1.3.2 氧化物鉬
準確稱取0.2~0.5 g試樣(視含量高低)(精確到0.0001 g),置入 250 mL 錐形瓶中,加入鹽酸(1+3)50 mL,塞上帶有玻璃管的橡皮塞,在沸水浴上加熱1 h,并經常攪拌[3]。用致密濾紙(必要時加紙漿)過濾于100 mL容量瓶中,以鹽酸微酸化的熱水洗錐形瓶3~4次,洗滌殘渣3~4次,冷卻后用水稀釋到刻度,搖勻,待測。濾渣供測硫化鉬使用。
1)ICP-AES法直接測定鉬的氧化物總量。
2)分光光度法測定。分取上述濾液20 mL于50 mL容量瓶中,1滴酚酞指示劑,以飽和氫氧化鉀溶液調制剛出現紅色,加入9.5 mL硫酸(1+1),水到30 mL左右,加檸檬酸鈉1 g,加1.5 mL硫酸銅溶液(20 g/L),搖勻,以下分析步驟按1.3.1.1進行。
1.3.3 硫化鉬(輝鉬礦)
1)直接由計算獲得[4]:SMo=QMo-OMo。但其不確定度來源于兩個分析量,帶來的誤差會大些,因此建議由分析測得硫化鉬(分光光度法測定)。
2)將分離氧化物鉬后的濾渣分析硫化鉬。將1.3.2的濾渣置于剛玉坩堝中,電爐上炭化后,于高溫爐400~500℃灼燒20 min,取出,加3 g氫氧化鈉,攪勻,覆蓋1g過氧化鈉,于預先升溫至650~700℃高溫爐中熔融10 min。取出坩堝置于250 mL燒杯中,蓋上表面皿,80~90℃熱水50 mL浸提取,以下分析步驟按1.3.1全鉬量的測定進行。
1.3.4 鉬礦中全鐵和亞鐵的測定
1)鉬礦中全鐵(TFe)的測定。稱取100 mg試樣于聚四氟乙烯燒杯中,加入適量鹽酸、硝酸、氫氟酸和高氯酸,電熱板上加熱溶解樣品。待冒高氯酸白煙至近干,王水提取,水定容50 mL,電感耦合等離子體發射光譜法測定鐵。
2)鉬礦中亞鐵的測定。準確稱取0.5 g試樣(精確到0.0001 g),置入250 mL錐形瓶中,加入2 g碳酸氫鈉,1 g氟化鈉,加2∶1鹽酸30 mL,迅速用帶有導管的橡皮塞蓋上瓶口,搖動試樣勿使粘結瓶底。電熱板上加熱至沸并保持微沸20~30 min,期間搖動2~3次,使試樣完全分解后取下,將導管的一端迅速插入飽和碳酸鈉溶液中,流水冷卻至室溫。打開塞子,用新煮沸并已冷卻的蒸餾水稀釋體積至150 mL,迅速加入硼酸溶液(50 g/L)10 mL(除去氟的干擾),硫—磷混酸(150mL濃硫酸緩慢倒入700mL水中,冷卻后加入150 mL磷酸)15 mL,二苯胺磺酸鈉(2 g/L)指示劑5滴,重鉻酸鉀標準溶液(1.2中3))滴定至呈穩定的紫色為終點。根據消耗的重鉻酸鉀標準液的體積計算亞鐵的含量。
2 實驗結果與討論
2.1 溶劑的選擇
由于鉬的氧化礦物溶于硝酸和鹽酸,鉬的硫化礦物能被硝酸和王水溶解,鉬的所有礦物均能被氫氧化鈉、過氧化鈉分解。因此選擇氫氧化鈉和過氧化鈉作溶劑溶解全鉬和硫化鉬,能徹底保證樣品溶解完全。
鉬礦物的分離根據鉬礦物成分的不同可選溶劑亦有所不同,有氫氧化銨[5]、碳酸鈉、鹽酸、酒石酸等。本文選擇鹽酸(1+3)作分離溶劑,是鑒于礦區樣品硫含量低(均值0.XX%),鉛鋅含量低(均值0.0XX%)為前提。方法操作簡單,分離后的濾液便于ICP-AES測定。
2.2 分析結果對照
分別選取了10種含量適中的鉬礦石進行實驗,實驗結果見以下各表。
2.2.1 全鉬分析的兩種方法結果比較(見下頁表2)
2.2.2 氧化物鉬分析的兩種方法結果對照(見下頁表3)
2.2.3 氧化鉬與硫化鉬量之和(OMo+SMo)與硫氰酸鹽光度法測全鉬量(QMo)比較(見下頁表4)
2.2.4 鉬的氧化率與鐵的氧化情況比較(見下頁表5)
2.3 討論
1)表2和表3結果表明,無論全鉬或氧化物鉬,其ICP—AES法測定結果與經典的硫氰酸鹽光度法結果非常接近,二者實際相對偏差均在允許限范圍之內。而硫化鉬的測試,除前處理灰化和灼燒外,后續步驟基本與全鉬分析相同。因此,確定該礦區鉬的分析完全可以采用ICP—AES法,快速而高效。
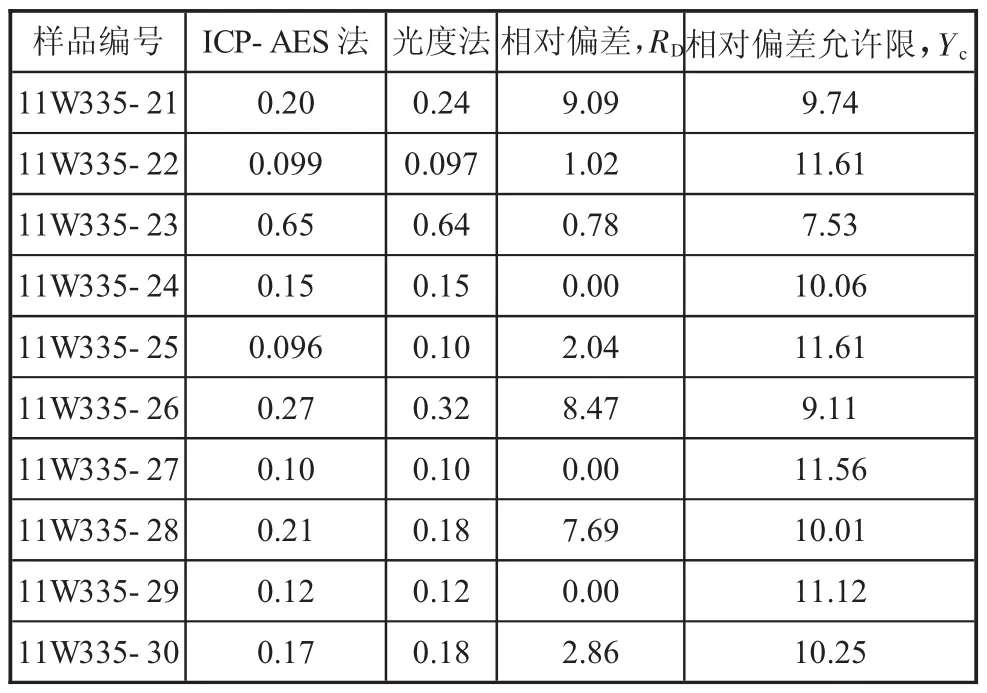
表2 全鉬的ICP—AES法與硫氰酸鹽光度法結果比較 %
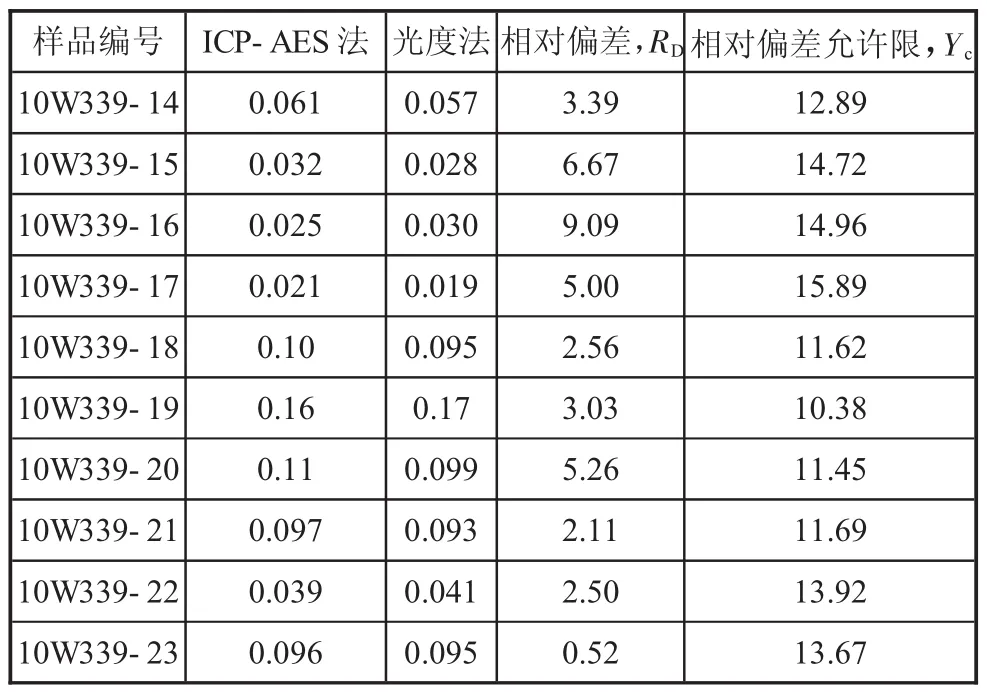
表3 氧化物鉬的ICP—AES法與硫氰酸鹽光度法結果對照 %
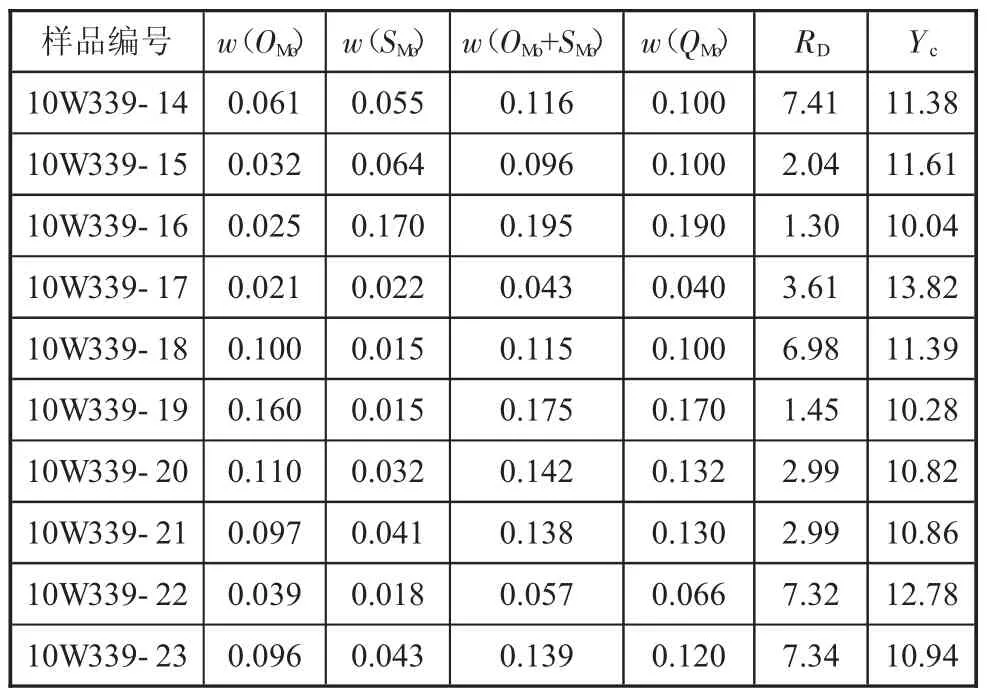
表4 氧化物鉬與硫化鉬之和與硫氰酸鹽光度法分析的全鉬量比較 %
2)表4的比較結果顯示,氧化物鉬和硫化鉬分析結果之和(m(OMo)+m(SMo))與經典硫氰酸鹽光度法測得的全鉬m(QMo)結果十分吻合,可以相互印證。
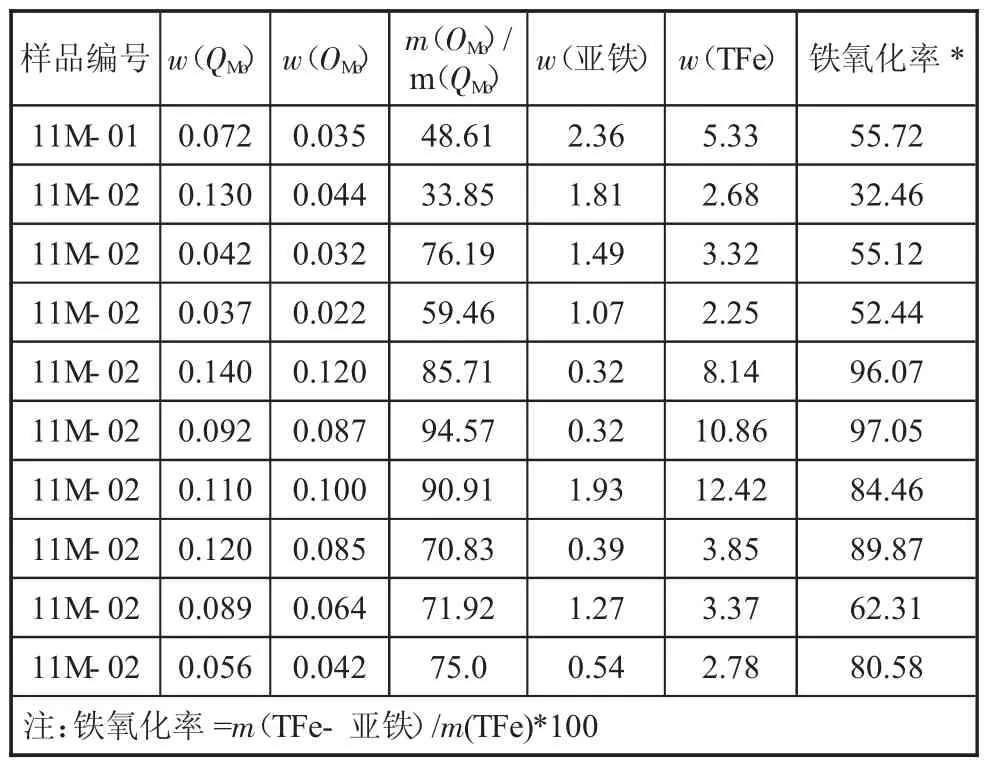
表5 鉬的氧化率(OMo/QMo)與鐵的氧化率比較 %
3)表5的數據中鉬的氧化率值(m(OMo)/m(QMo))與鐵的氧化率值雖然不是非常接近,但二者反映出的氧化狀況基本是一致的。按鉬礦石氧化率不小于10%,分析樣品所屬區間鉬礦石屬于氧化礦石。也就是說,可以通過分析樣品中鐵的氧化情況,從側面左證鉬礦石氧化率的正確性。
3 結語
將實驗方法應用于生產實際中,分析所得結果,與該礦區以往資料以及現場實際地質成礦情況相符。
1)對于不含大量硫化物的鉬礦石的物相分析,可以采用鹽酸(1+3)分離鉬的氧化物和硫化鉬,然后以電感耦合等離子體發射光譜法測定,快速、準確又穩定。
2)實驗室在無鉬礦石物相分析標準樣品驗證方法和沒有條件做回收率實驗的情況下,通過鐵的氧化情況可以從側面驗證鉬礦石的氧化率,同時驗證物相分析結果,不失為一條解決問題的方法。
參考資料
[1]中華人民共和國國家標準.GB/T14352.2—2010鎢礦石、鉬礦石化學分析方法第2部分:鉬量測定[S].北京:中國標準出版社,2010.
[2]施小英.電感耦合等離子體發射光譜法應用于鉬礦石物相分析[J].理化檢驗 - 化學分冊,2010,46(1):79-80;83.
[3]巖石礦物分析編寫組.巖石礦物分析(第三分冊):第4版[M].北京:地質出版社,2011:338-359.
[4]鄭民奇,于淑霞,程秀花.鉬礦石物相的快速分析[J].巖礦測試,2011,30(1):40-42.
[5]趙德平,吳繼華,阮鴻興.鉬礦石中鉬的化學物相分析[J].云南冶金,2000(5):48-50.

