苯乳酸微生物代謝研究進展
孫大慶 ,李 芬 ,李洪飛
(1.黑龍江八一農墾大學牡丹江食品與生物技術創新研究院,黑龍江牡丹江 157000;2.黑龍江八一農墾大學國家雜糧工程技術研究中心,黑龍江大慶 163319)
苯乳酸是近年發現的一種天然生物防腐劑,抑菌譜寬、溶解性高、穩定性強、安全無毒,在食品工業中具有良好的應用前景。隨著生活水平的提高,人們對健康問題日益關注。雖然化學防腐劑可以顯著延長食品的保質期,但目前使用的多種化學防腐劑對人類健康具有一定的風險,因此天然、安全、高效的食品防腐劑的開發和應用研究越來越受到人們關注。
1 苯乳酸結構和來源
苯乳酸化學名2-羥基-3-苯基丙酸,又稱β-苯乳酸或3-苯基乳酸,是一種天然的小分子有機酸,它的第2個碳原子為手性碳原子,因此存在2種對映異構體(圖1)。Dieuleveux V S等人[1]研究表明D-苯乳酸抑菌效果稍優于L-苯乳酸,因此苯乳酸2種異構體的抑菌效果存在一定的差異。
苯乳酸異構體的結構式見圖1。
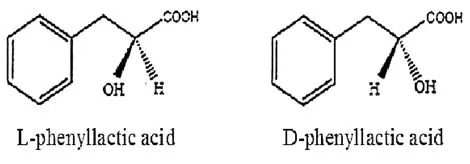
圖1 苯乳酸異構體的結構式
目前已有研究證實,苯乳酸存在于多種蜂蜜、干酪和發酵蔬菜等食品中,對這些食品的防腐和保鮮具有十分重要的作用,如苯乳酸已成為薊花蜂蜜品質的標志性檢測物。
2 苯乳酸抑菌活性和機制
以往研究表明,苯乳酸是一種廣譜抑菌化合物,它對革蘭氏陽性細菌、革蘭氏陰性細菌和真菌均有抑菌作用(表1)。這與細菌素Nisin不同,大部分細菌素只對近緣微生物產生抑菌作用,雖然Nisin可以抑制多種革蘭氏陽性細菌,但對大多數革蘭氏陰性細菌和真菌沒有抑菌作用。苯乳酸抑菌譜見表1。

表1 苯乳酸抑菌譜
近年來,通過觀察苯乳酸作用前后微生物細胞的結構變化,發現微生物的細胞膜沒有顯著變化,而細胞壁有明顯破損現象[1]。這表明,苯乳酸抑菌機制的作用靶點很可能在細胞壁上,這與多數細菌素破壞細胞膜機制不同,而與溶菌酶的抑菌機理相似,但至今苯乳酸更詳細的抑菌機制仍不清楚,需要更多、更深入的研究。
3 苯乳酸微生物合成和分解代謝
3.1 苯乳酸合成途徑
目前苯乳酸微生物合成研究中利用的底物有2種,苯丙氨酸和苯丙酮酸。
苯乳酸微生物合成途徑見圖2。
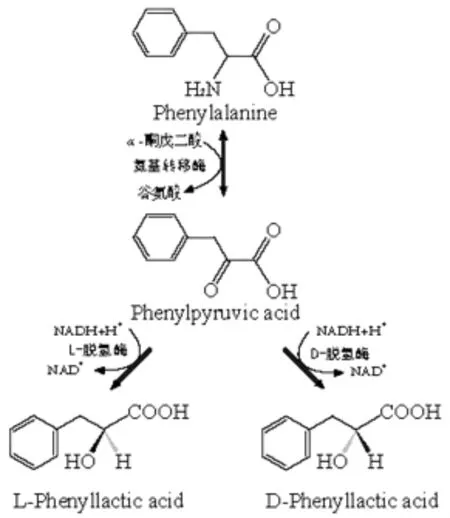
圖2 苯乳酸微生物合成途徑
由圖2可知,苯丙酮酸是苯乳酸的最直接前體,而苯丙氨酸主要被氨基轉移酶轉化為苯丙酮酸后,再被氧化還原酶(主要是乳酸脫氫酶) 還原為D-苯乳酸或L-苯乳酸。
氨基轉移酶是苯乳酸合成的重要限速酶,它廣泛存在于動物、植物和微生物細胞中,催化轉氨反應,參與氨基酸的合成與分解。其主要催化氨基酸中氨基轉移到氨基接受體上,微生物代謝中的氨基接受體主要是α-酮戊二酸,而α-酮戊二酸是三羧酸循環中的重要物質之一,因此多個研究推測α-酮戊二酸、三羧酸循環途徑對苯丙氨酸的轉化、苯乳酸的合成具有很重要的作用[2]。Dallagnol A M C C等人[3]和Vermeulen G M等人[4]均報道,在植物乳桿菌發酵過程中添加α-酮戊二酸可使苯乳酸的產量增加5%~30%。
乳酸脫氫酶是苯乳酸合成最后一個反應的催化酶,它同樣廣泛分布于動物、植物和微生物細胞中,但其性質存在較大差異,在生物體內的氧化產能、解毒等生理活動中起重要作用。乳酸脫氫酶又稱為NAD+氧化酶,是糖酵解最后一步反應的催化酶,即能逆催化氧化乳酸生成丙酮酸[5]。Meistei A等人[6]首次研究證明,牛瘤胃中微生物在代謝過程中,乳酸脫氫酶在NADH作用下,可將苯丙酮酸脫氫后轉化為苯乳酸。
3.2 苯乳酸分解途徑
苯乳酸產量不僅與合成途徑密切相關,同時與苯乳酸分解代謝途徑也是息息相關。然而,目前關于苯乳酸分解代謝途徑的研究比較匱乏,只有個別報道對苯乳酸分解代謝終產物進行了初步研究。
李遠頌[7]研究發現,苯乳酸不僅可以代謝為非蛋白氨基酸,也還可以直接轉化為1-溴-2,3苯甲烷,再轉化為2-苯基雙氫苯并吡喃,最后轉化為四氫噻唑二酮衍生物。除此之外,Wegst W等人[8]利用物理化學和色譜分析方法,在添加苯丙氨酸的無機鹽培養基中分離并鑒定了一種新的代謝產物-二氫化二醇。這一結果表明,乳酸菌可以將苯乳酸轉化為二氫化二醇。2009年,Zhang Z Y等人[9]利用KEGG數據庫分析發現,苯乳酸可以先轉化為苯乳酸輔酶A,而苯乳酸輔酶A還可以進一步降解為苯基甘氨酸和苯基谷氨酸。
4 展望
近年來,抑菌化合物已經成為微生物研究領域的一個熱點,目前微生物產生的抑菌化合物主要有有機酸、細菌素、環二肽等,通過綜合比較這些抑菌化合物的優缺點,人們普遍認為苯乳酸是一種非常具有開發前景的新型天然防腐劑。近年研究表明,眾多微生物可以合成苯乳酸,但苯乳酸產量存在菌株特異性,因此深入了解苯乳酸結構和抑菌功能,深入細致地解釋微生物苯乳酸合成與分解代謝途徑,將為今后苯乳酸微生物合成和工業化應用提供十分重要的理論基礎和依據。
參考文獻:
[1]Dieuleveux V S,Lemarinier M.Gueguen.Antimicrobial spectrum and target site of D-3-phenyllactic acid[J].International Journal of Food Microbiology,1998,40 (3):177-183.
[2]Rijnen L C P, Gripon J C, Yvon M.Expression of a heterologous glutamate dehydrogenase gene in Lactococcus lactis highly improves the conversion of amino acids to aroma compounds[J].Applied Environment Microbiology,2000,66(4):1 354-1 359.
[3]Dallagnol A M C C,Mercado M I,de Valdez G F,et al.Effectofbiosynthetic intermediatesandcitrate on the phenyllactic and hydroxyphenyllactic acids production by Lactobacillus plantarum CRL 778[J].Journal of Applied Microbiology,2011(6):1 447-1 455.
[4]Vermeulen N G M,Vogel RF.Influence of peptide supply and cosubstrates on phenylalanine metabolism of Lactobacillus sanfranciscensis DSM20451 (T) and Lactobacillus plantarum TMW1.468[J].Journal of Agriculture Food Chemistry,2006,54 (11):3 832-3 839.
[5]Ai-Jassabi S.Purification and kinetic properties of skeletal muscle lactate dehydrogenase from the Lizard agam-stellio stellio[J].Biochemistry (Moscow), 2002, 67 (7):786-789.
[6]Meister A.Reduction of α, γ -Dike to anda-keto acids catalyzed by muscle preparation and by crystalline lactic dehydrogenase[J].Journal of Biological Chemistry,1990(3):117-129.
[7]李遠頌.生物合成R-3苯基乳酸的研究 [D].儋州:華南熱帶農業大學,2006.
[8]Wegst W,Tittmann U,Eberspacher J,et al.Bacterial conversion of phenylalanine and aromatic carboxylic acids into dihydrodiols[J].Biochem J,1981 (3):679-684.
[9]Zhang Z Y,Liu C,Zhu Y Z,et al.Complete genome sequence of Lactobacillus plautarum JDM1[J].Journal of Bacteriology,2009 (15):5 020-5 021.◇

