載EWVDV多模態納米粒的相變及體外血栓靶向性研究*
周 君,徐 杰,張 瑜,劉 佳,郭大靜(重慶醫科大學附屬第二醫院放射科,重慶400010)
動脈血栓嚴重威脅人類健康,可引起心肌梗死、缺血性腦卒中、肺栓塞等嚴重疾病,在世界范圍內其發病率和病死率居高不下[1]。因此,早期準確診斷、及時治療能挽救缺血壞死組織,減少并發癥,降低病死率。近年來,分子影像學的發展促進了動脈血栓的早期診斷及個體化治療。國內外已有大量靶向診斷血栓的分子探針[2-5],在此基礎上,本研究旨在利用聚乳酸/羥基乙酸(PLGA)為載體,制備載血栓親和性肽谷氨酸-色氨酸-纈氨酸-天冬氨酸-纈氨酸(EWVDV)的超聲及磁共振相變型多模態分子探針,以期借助多模態分子影像技術從分子及細胞水平實現對血栓的早期精準診斷,為血栓性疾病的治療及預后判斷提供基礎依據。
1 材料與方法
1.1 材料
1.1.1 儀器 光學顯微鏡(日本Olympus公司);激光粒徑儀(Zeta SIZER 3000HS,英國Malvern公司);流式細胞儀(FSCS-Vantate SE,美國BD公司);紅外儀(美國Fluke公司);超聲儀(意大利Esaote公司);光聲成像系統(Vevo Laser,加拿大 VisualSonics公司);3.0T磁共振掃描儀(荷蘭Philips公司)。
1.1.2 試劑 羧基PLGA(配比75∶25,相對分子質量為8 000,濟南岱罡生物材料有限公司);有機物可溶性Fe3O4納米粒子(油酸表面修飾,美國Ocean NanoTech公司);全氟己烷(PFH,美國Elf Atochem公司);印度墨水(美國Amresco公司);GA修飾的EWVDV肽(上海吉爾生化有限公司);1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽(EDC)、N-羥基琥珀酰亞胺(NHS)、2-(N-嗎啡啉)乙磺酸(MES)、聚乙烯醇(PVA)及 DiI染色劑均購于美國Sigma公司;其他試劑均為國產分析純。
1.2 多模態納米粒的制備及表征
1.2.1 非靶向多模態納米粒的制備 采用三步乳化法,首先取200 μL 10%印度墨水加入200 μL PFH,聲振70 s(功率100 W)形成黑色乳液;將100 mg PLGA加入3 mL二氯甲烷,待其完全溶解后加入80 μL經油酸修飾的Fe3O4,振搖20 min,使其充分混合;然后倒入上述黑色乳液,聲振70 s形成深灰色初乳;最后加入10 mL 4%PVA溶液,聲振70 s,形成淺灰色乳液;加入20 mL 2%異丙醇,將上述溶液置于通風櫥攪拌2 h,使有機溶劑充分揮發,全程冰浴。再經雙蒸水洗滌、離心3次,得非靶向納米粒(PFH-Ink-Fe)。制備PFH-Fe及PFH-Ink納米粒時分別省去印度墨水及Fe3O4的投入,其他步驟同上;將制備的納米粒置于4℃冰箱內儲存備用。DiI染色非靶向納米粒制備在溶解PLGA時加入少量DiI。
1.2.2 靶向血栓多模態納米粒制備 采用碳二亞胺法[6],取少量PFH-Ink-Fe納米粒分散在10 mL MES緩沖液(0.1 mol/L,pH=5.0)中,加入過量的偶聯活化劑EDC/NHS(質量比2∶1)于4℃孵育2 h,用雙蒸水離心、洗滌去除未反應的EDC/NHS,將活化后的PFH-Ink-Fe納米粒分散于10 mL MES緩沖液(0.1 mol/L,pH=8.0)中,加入適量GA修飾及羅丹明標記的EWVDV肽置于搖床上孵育1 h,用雙蒸水離心、洗滌去除未反應的EWVDV肽,即得靶向血栓多模態分子探針(EWVDVPFH-Ink-Fe),EWVDV-PFH-Fe、EWVDV-PFH-Ink 納米
粒的制備方法同上;將制備好的納米粒置于4℃冰箱內儲存備用。
1.2.3 靶向血栓多模態納米粒理化性質表征 (1)觀察納米粒形態、大小及分散性。(2)檢測納米粒的粒徑及粒徑分布。(3)檢測羅丹明標記的EWVDV的連接率。
1.3 熱致相變 取50 μL 10 mg/mL EWVDV-PFH-Ink-Fe納米粒滴在載玻片上,用加熱板分別加熱到50、55、60、65、70、75、80 ℃,于每組溫度下加熱 2、3、4、5、6、7 min時各采1次圖。觀察相變微泡大小。
1.4 光致相變及超聲成像
1.4.1 激光輻照時間與納米粒溫度關系 將200 μL 10mg/mLEWVDV-PFH-Ink-Fe納米粒加入孔徑為0.5cm2的瓊脂糖凝膠孔洞模型內,采用808 nm激光儀,將激光探頭固定于模型正上方4 cm處,分別用輻照強度A=0.444 W/cm2、B=0.930 W/cm2、C=1.294 W/cm2、D=1.730 W/cm2對EWVDV-PFH-Ink-Fe納米粒進行激光輻照,同時用紅外儀記錄溫度變化,每隔10 s采圖1次,共30次,組合為激光輻照時間與納米粒熱致相變光鏡圖。
1.4.2 激光輻照后納米粒溫度與超聲成像研究 將200 μL 10 mg/mL EWVDV-PFH-Ink-Fe納米粒加入孔徑為0.5 cm2的瓊脂糖凝膠孔洞模型內,將激光探頭固定于模型正上方4 cm處對樣品進行激光輻照,同時用紅外儀記錄實時溫度,當樣品溫度達到 50、55、60、65、70、75、80℃時,用超聲儀分別在B模式和造影模式下采集超聲聲像圖,采用DFY超聲圖像定量分析軟件測量圖像聲強度。
1.5 納米粒光聲成像及磁共振成像研究
1.5.1 納米粒光聲成像 將200μL10mg/mL的EWVDVPFH-Ink-Fe納米粒加入孔徑為0.5 cm2的瓊脂糖凝膠孔洞模型內,激光輻照60 s,激發波長706 nm,用光聲成像系統采集圖像。
1.5.2 納米粒磁共振成像 分別將3 mL雙蒸水及3 mL質量濃度分別為 0.4、0.8、1.2、1.6、2.0 mg/mL 的 EWVDVPFH-Ink-Fe納米粒加入Eppendorf管中,每管均用8%明膠溶液定容至4 mL,充分混勻,避免納米粒發生沉降,以雙蒸水為背景,置于3.0T磁共振掃描儀上行T2WI掃描,采用頭顱專用單通道正交線圈,FFE序列。掃描參數:TR=87 ms,TE=9 ms,翻轉角度(FP)45°,體素0.6 mm×0.6 mm×3.0 mm,矩陣 147×147,激勵次數 4次。
1.6 納米粒對體外血栓靶向性 取新西蘭大白兔耳緣靜脈血10 mL,加至20 mL燒杯中,37℃孵育5 h至血栓形成。將血栓切成10 mm×10 mm大小,分別加入5 mL 10 mg/mL均經 DiI染色的PFH-Ink-Fe納米粒和EWVDV-PFH-Ink-Fe納米粒中孵育30 min,37℃水浴。
取出血栓,用磷酸鹽緩沖溶液(PBS)反復沖洗,去除游離納米粒。將血栓做冰凍切片,在普通光鏡和熒光顯微鏡下觀察。為防止切片變干,部分切片上滴加少量雙蒸水。
2 結 果
2.1 納米粒的理化特性 EWVDV-PFH-Ink-Fe納米粒在光鏡下顯示其粒徑較均一,表面光滑,呈球形,分散性好,激光粒徑儀測得微球的平均粒徑為370.7 nm,PDI=0.172。流式細胞儀測得羅丹明標記的EWVDV的連接率為62.5%。
2.2 熱致相變 光鏡下見EWVDV-PFH-Ink-Fe納米粒在各個溫度組下不同加熱時間點均變成微泡,相變納米粒的數量由少變多,體積從小到大,并向中心聚集,部分體積較大的微泡破裂產生射流現象,沖擊周圍的微泡。在相同溫度下,加熱時間越長,相變納米粒的數目越多,直徑越大;在相同的加熱時間下,隨著溫度升高,相變納米粒數目越多,直徑越大,見圖1。納米粒相變后直徑從數十微米到數百微米不等,較大的微泡可達210 μm左右。

圖1 EWVDV-PFH-Ink-Fe納米粒熱致相變光鏡圖
2.3 光致相變及超聲成像
2.3.1 激光輻照時間與納米粒溫度關系 在A=0.444 W/cm2、B=0.930 W/cm2、C=1.294 W/cm2、D=1.730 W/cm2等4組不同輻照強度下,EWVDV-PFH-Ink-Fe納米粒溫度在實驗時間內均逐漸升高,且輻照功率越高溫度升高幅度越大,速度越快。在輻照強度為1.730 W/cm2時,納米粒于280 s達到最高溫度91.7℃,見圖2。

圖2 激光輻照時間與EWVDV-PFH-Ink-Fe納米粒溫度關系
2.3.2 激光輻照后納米粒溫度與超聲成像研究 當激光輻照后EWVDV-PFH-Ink-Fe納米粒溫度為50、55℃時,肉眼未見明顯相變微泡,超聲儀未探測到明顯回聲信號;當納米粒溫度達到60~80℃時,在凝膠模型上方可見白色、大小均勻相變微泡,B模式及造影模式下均探及微泡產生的強回聲;超過60℃后B模式下回聲強度明顯升高,并保持在相對穩定狀態,而造影模式下回聲強度隨溫度的增高而逐漸升高,見圖3。

圖3 激光輻照EWVDV-PFH-Ink-Fe納米粒達到不同溫度時B模式及對比模式下聲像圖
2.4 納米粒光聲成像及磁共振成像
2.4.1 納米粒光聲成像 光聲成像系統可檢測到EWVDV-PFH-Ink-Fe納米粒的紅色光聲信號,證實了Fe3O4和印度墨水的光聲成像能力。見圖4。
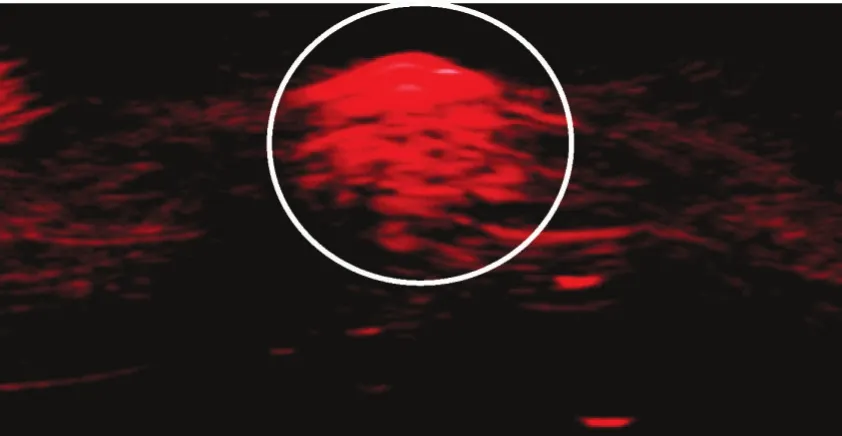
圖4 EWVDV-PFH-Ink-Fe納米粒光聲成像圖
2.4.2 納米粒磁共振成像 磁共振掃描示各組不同水平EWVDV-PFH-Ink-Fe納米粒信號與雙蒸水信號比較均有不同程度降低,且隨樣品中納米粒水平的增加,T2信號的降低越發明顯,證實該納米粒可有效降低T2信號。見圖5。
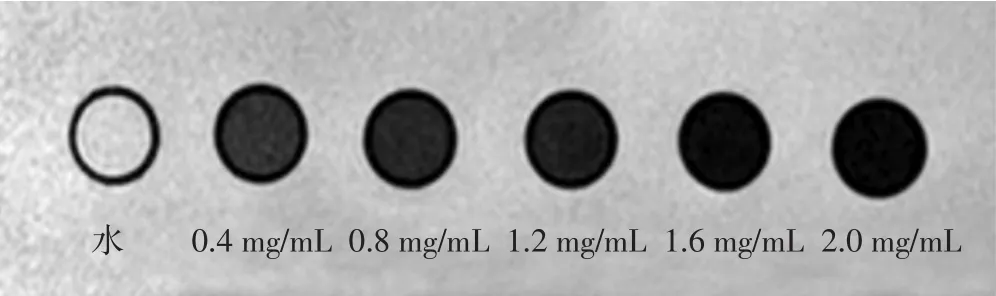
圖5 EWVDV-PFH-Ink-Fe納米粒磁共振掃描圖
2.5 納米粒對體外血栓靶向性 經過熒光顯微鏡綠光激發后,PFH-Ink-Fe組因為物理吸附作用,于血栓表面可見少量黃色熒光,EWVDV-PFH-Ink-Fe組可見大量熒光納米粒連接于血栓表面,明顯多于PFH-Ink-Fe組,表明多功能納米粒對血栓有良好靶向性。為防止血栓切片變干,作者在部分切片上滴了少量雙蒸水后,發現切片上的探針發生了相變,且進入血栓內部,見圖6。

圖6 靶向組納米粒(EWVDV-PFH-Ink-Fe)及非靶向納米粒(PFH-Ink-Fe)對體外血栓靶向性
3 討 論
核磁共振成像分子影像學具有較高的組織分辨率、多參數、多方位成像等優點,可同時獲得解剖及生理信息,本課題組前期通過磁共振分子成像技術實現了對血栓的靶向診斷及治療研究[6-8],但磁共振掃描耗時較長,敏感度較低。超聲分子影像作為分子影像學的一個重要分支,在近幾年得以興起和快速發展,但目前使用的超聲微泡造影劑存在粒徑大、穩定性差等不足;而單純光聲成像存在穿透力較弱等劣勢。單一影像學成像模式已不能滿足臨床多樣化和個體化需求,多種成像模式聯合應用能夠互補不足,更全面地提供血栓的病理生理學信息[9-12]。目前國內鮮有血栓多模態分子探針的報道。本研究聯合超聲、光聲及磁共振成像技術,期望從分子水平上實現對血栓更全面的影像學表征。
在本研究納米粒的超聲成像研究中,經激光輻照后納米粒的溫度達到或高于60℃時,在B模式和對比模式下可獲得令人滿意的回聲信號,而在60℃以下則未探測到明顯的強回聲,有學者認為激光輻照致相變的原理是納米粒中的吸光物質吸收光的能量轉化為熱能,使納米粒中的氟碳物質溫度升高,發生相變[13]。本研究結果顯示,激光輻照強度為0.930、1.294、1.730 W/cm2時,分子探針分別在120、70、40 s時達到60℃,而當激光輻照強度為0.444 W/cm2時,分子探針在實驗時間內不能達到60℃。由此可以看出,為了獲得令人滿意的超聲圖像,激光照射強度和時間需要滿足相應的要求,激光輻照時間越長,輻射強度越大,納米粒溫度越高,而回聲信號越明顯。激光輻照后納米粒溫度的明顯升高也說明了納米粒對激光能量有良好的吸收能力,這種優異的光吸收特性不僅有利于超聲成像,還在光熱療領域具有很大的潛力。
Fe3O4和印度墨水均可用于光聲成像[14-15],EWVDVPFH-Ink-Fe納米粒在光聲成像儀中可觀測到紅色光聲信號,同時,Fe3O4也可用作磁共振對比劑,在納米粒磁共振成像中,不同水平EWVDV-PFH-Ink-Fe納米粒信號與雙蒸水背景信號比較均有不同程度的降低,且隨樣品水平的增加,T2信號的降低越發明顯,證實該納米粒可有效降低T2信號,該結果與大量國內外研究一致[16-18],證實了納米粒中的Fe應用于磁共振成像中具有優良的有效性及穩定性,這也歸因于經油酸修飾的Fe3O4鑲嵌于PLGA殼中,不會發生明顯的突釋現象。
在熱致相變研究中,由于樣品加熱到設定溫度需要一定時間,所以1 min圖像的研究意義不大;而加熱后期樣品會被加熱板烤干,相變納米粒不穩定,所以選擇條件穩定的時間(2~7 min)作為研究時間段。隨著加熱時間延長及加熱溫度的上升,發生相變的納米粒數目越多且直徑越大,這一規律有助于指導納米粒在體內的應用,當納米粒應用于體內時,需發生相變才能實現超聲顯像。但納米粒相變后的粒徑需控制在一定范圍內,避免粒徑過大引起血管阻塞,而這一結果為納米粒的相變可控性提供了重要依據。然而體內環境復雜,納米粒在體內的相變及超聲成像待后期工作進一步探索。
文獻研究顯示,活化血小板表面同時高表達GPⅡb/Ⅲa受體和P-選擇素[19]。前期研究利用RGDS/cRGD肽成功構建靶向血栓中激活血小板GPⅡb/Ⅲa受體的納米粒,體內外實驗顯示其靶向性能良好[6-8],但是動脈中血液流速高,需要更強的靶向力以抵抗動脈血液的高剪切力,P-選擇素是黏附分子選擇素家族的重要成員,其主要表達在活化的血小板/內皮細胞表面,通過介導細胞初始黏附啟動參與了包括白細胞的黏附遷移級聯過程,選擇素及其配體的靶向作用可以介導細胞滾動[20-21]。EWVDV肽對P-選擇素有高度的親和力,而不會靶向L-選擇素和E-選擇素,且比其他肽段、糖類物質及內源性配體二硫鍵連接的唾液黏蛋白二聚體-1(PSGL-1)的靶向性更強[22]。N 端修飾 GA 或羧酸(CA)的EWVDV對P-選擇素的靶向能力最強,其靶向性可提高800多倍[22]。本研究體外靶向血栓實驗證實,EWVDV-PFH-Ink-Fe納米粒的靶向性能明顯高于PFHFe,作者推測這正是由于EWVDV與P-選擇素的靶向結合作用介導了納米粒在血栓表面的黏附、滾動,使得納米粒穩定地結合于血栓表面。在體外靶向血栓實驗中,為了防止血栓切片變干,作者在部分切片上滴了少量雙蒸水后,意外發現切片上的探針發生了相變,且進入血栓內部,作者認為這歸因于印度墨水及Fe3O4吸收綠光能量后發生了光致相變作用,同樣證明了探針具有優良的光吸收能力,且通過這種相變作用可以促使納米粒向血栓內部滲透。目前多數血栓分子探針對血栓的靶向均富集于血栓表面[23-26],CHUNG等[24]的研究證實,其制備的探針可以向血栓內部滲透達300 μm。本研究中,借助相變作用,納米粒可大量向血栓深部滲透,這為靶向溶栓效率的大幅提高奠定了基礎。然而,這種相變介導的納米粒向血栓深部滲透的機制還需要進一步研究。EWVDV-PFH-Ink-Fe納米粒在體內的靶向及顯影性能、代謝分布及安全性會在下一步進行詳細驗證。
[1]WENDELBOE AM,RASKOB GE.Global burden of thrombosis:epidemiologic aspects[J].Circ Res,2016,118(9):1340-1347.
[2]AY I,BLASI F,RIETZ TA,et al.In vivo molecular imaging of thrombosis and thrombolysis using a fibrin-binding positron emission tomographic probe[J].Circ Cardiovasc Imag,2014,7(4):697-705.
[3]REZAEIANPOUR S,BOZORGI AH,MOGHIMI A,et al.Synthesis and biological evaluation of cyclic[Tc-99m]-HYNIC-CGPRPPC as a Fibrin-Binding peptide for molecular imaging of thrombosis and its comparison with[Tc-99m]-HYNIC-GPRPP[J].Mol Imaging Biol,2017,19(2):256-264.
[4]TANG RB,CHAI WM,YAN FH,et al.Molecular evaluation of thrombosis using X-ray phase contrast imaging with microbubbles targeted to P-selectin in mice[J].Eur Radiol,2016,26(9):3253-3261.
[5]趙元平,胡廣全,滕中華,等.環RGD多肽靶向微泡用于動脈血栓成像[J].中國醫學影像技術,2013,29(6):857-861.
[6]ZHOU J,GUO DJ,ZHANG Y,et al.Construction and evaluation of Fe3O4-based PLGA nanoparticles carrying rtPA used in the detection of thrombosis and in targeted thrombolysis[J].ACS Appl Mater Interfaces,2014,6(8):5566-5576.
[7]LIU J,XU J,ZHOU J,et al.Fe3O4-based PLGA nanoparticles as Mr contrast agents for the detection of thrombosis[J].Int J Nanomedicine,2017,12(1):1113-1126.
[8]ZHANG Y,ZHOU J,GUO DJ,et al.Preparation and characterization of gadolinium-loaded PLGA particles surface modified with RGDS for the detection of thrombus[J].Int J Nanomedicine,2013,8(1):3745-3756.
[9]SONG YN,HUANG ZY,XU JF,et al.Multimodal SPION-CREKA peptide based agents for molecular imaging of microthrombus in a rat myocardial ischemia-reperfusion model[J].Biomaterials,2014,35(9):2961-2970.
[10]YOO SP,PINEDA F,BARRETT JC,et al.Gadolinium-functionalized peptide amphiphile micelles for multimodal imaging of atherosclerotic lesions[J].ACS omega,2016,1(5):996-1003.
[11]OLIVEIRA BL,BLASI F,RIETZ TA,et al.Multimodal molecular imaging reveals high target uptake and specificity of 111In-and 68Ga-Labeled Fibrin-Binding probes for thrombus detection in rats[J].J Nucl Med,2015,56(10):1587-1592.
[12]MCCARTHY JR,PATEL P,BOTNARU I,et al.Multimodal nanoagents for the detection of intravascular thrombi[J].Bioconjug Chem,2009,20(6):1251-1255.
[13]NIU C,WANG L,WANG Z,et al.Laser irradiated fluorescent perfluorocarbon microparticles in 2-D and 3-D breast cancer cell models[J].Scientific Reports,2017,7(1):43408.
[14]ZHOU P,ZHAO H,WANG Q,et al.Photoacoustic-enabled self-guidance in magnetic-hyperthermia Fe@Fe3O4 nanoparticles for theranostics in vivo[J].Advan Healthcare Mater,2018,7(9):e1701201.
[15]AVIGO C,LASCIO N,ARMANETTI P,et al.Organosilicon phantom for photoacoustic imaging[J].J Biomed Opt,2015,20(4):46008.
[16]TA HT,LI Z,HAGEMEYER CE,et al.Molecular imaging of activated platelets via antibody-targeted ultra-small Iron oxide nanoparticles displaying unique dual MRI contrast[J].Biomaterials,2017,134(1):31-42.
[17]YANG M,FAN QL,ZHANG RP,et al.Dragon fruit-like biocage as an Iron trapping nanoplatform for high efficiency targeted cancer multimodality imaging[J].Biomaterials,2015,69(1):30-37.
[18]SUZUKI M,BACHELET-VIOLETTE L,ROUZET F,et al.Ultrasmall superparamagnetic Iron oxide nanoparticles coated with fucoidan for molecular MRI of intraluminal thrombus[J].Nanomedicine,2015,10(1):73-87.
[19]STOETZER C,NICKEL K,WEI?IG A,et al.Olive oil-based lipid emulsions do not influence platelet receptor expression in comparison to medium and long chain triglycerides in vitro[J].Lipids,2016,51(11):1241-1248.
[20]KLOPOCKI AG,YAGO T,MEHTA P,et al.Replacing a lectin domain residue in L-selectin enhances binding to P-selectin glycoprotein ligand-1 but not to 6-sulfo-sialyl Lewis x[J]. J Biol Chem,2008,283(17):11493-11500.
[21]LINDNER J R.Contrast ultrasound molecular imaging of inflammation in cardiovascular disease[J].Cardiovasc Res,2009,84(2):182-189.
[22]APPELDOORN CC,MOLENAAR TJ,BONNEFOY A,et al.Rational optimization of a short human P-selectin-binding peptide leads to nanomolar affinity antagonists[J].J Biol Chem,2003,278(12):10201-10207.
[23]LI B,JUENET M,AID-LAUNAIS R,et al.Development of polymer microcapsules functionalized with fucoidan to target P-Selectin overexpressedincardiovasculardiseases[J].AdvHealthcMater,2017,6(4):1-5.
[24]CHUNG TW,WANG SS,TSAI WJ.Accelerating thrombolysis with chitosan-coated plasminogen activators encapsulated in poly-(lactide-coglycolide)(PLGA)nanoparticles[J].Biomaterials,2008,29(2):228-237.
[25]WEN AM,WANG YM,JIANG K,et al.Shaping bio-inspired nanotechnologies to target thrombosis for dual optical-magnetic resonance imaging[J].J Mater Chem B,2015,3(29):6037-6045.
[26]CICHA IWONA.Thrombosis:novel nanomedical concepts of diagnosis and treatment[J].World J Cardiol,2015,7(8):434-441.

