高濃度氨氮或磷脅迫對亞洲苦草生理特性的影響
康彩霞,戴星照,劉 艷
(1.華東交通大學土木建筑學院,江西 南昌 330013;2.江西省山江湖開發治理委員會辦公室,江西 南昌 330046; 3.江西省環境監測中心站,江西 南昌 330039)
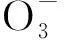
亞洲苦草(Vallisneriaasiatica)是一種常見的沉水植物,分布廣泛,有較強的吸污能力和耐污性,且再生能力強,是治理水體富營養化的重要水生植物[10]。目前生物方法以其低成本、高效安全的特點成為控制湖泊富營養化的研究熱點[11]。因此,本文以富營養化水體為研究背景,以高等水生植物亞洲苦草為研究對象,通過室內靜態模擬試驗,對亞洲苦草葉片中葉綠素a、蛋白質含量以及超氧化物歧化酶(SOD)和過氧化氫酶(CAT)的活性進行了分析,探討了高濃度氨氮或磷營養鹽對亞洲苦草抗氧化生理系統的影響,以便闡明水生植物消失的原因,并為富營養化水體中沉水植物的恢復提供理論依據。
1 材料與方法
1. 1 試驗材料與裝置
(1) 試驗材料:選取于水體中根系發達的成熟亞洲苦草,去除泥土和枯葉,用曝曬過的自來水充分沖洗后浸泡3 d,選取健壯并長勢一致的植株用于試驗。
(2) 試驗裝置:試驗裝置為體積40 L的鋼化玻璃水槽,其尺寸為30 cm(長)×30 cm(寬)×45 cm(高),見圖1。
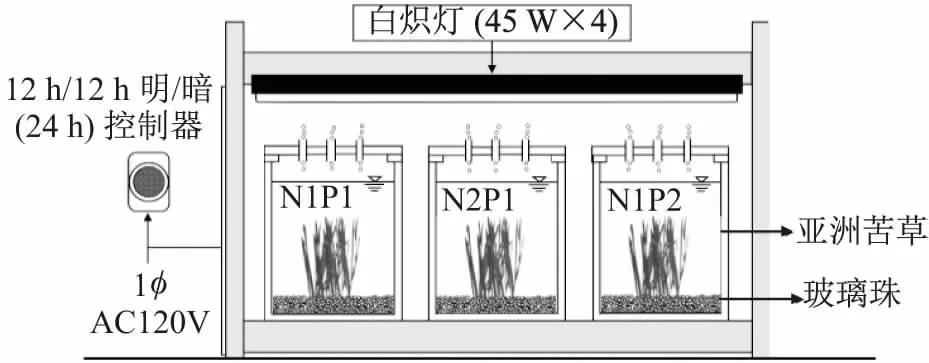
圖1 試驗裝置示意圖Fig.1 Schematic diagram of the experimental device
1. 2 試驗方法

1. 3 測定方法
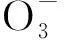
(2) 亞洲苦草葉片中葉綠素a的濃度的測定:取2 g亞洲苦草葉子,加入10 mL丙酮,用研缽研磨成漿,在離心力為12 000×g下離心10 min,取其上清液于645 nm和663 nm波長處測定吸光度值OD645和OD663。葉綠素a的濃度采用Chl.a(mg/g鮮重)=20.21OD645-8.02OD663公式計算[12]。
(3) 亞洲苦草葉片中蛋白質含量和氧化酶活性的測定:另取2 g亞洲苦草葉子,用8 mL的50 mM的磷酸鉀緩沖液研磨,再在緩沖液中加入3 mM的EDTA和0.5% (W/V)的PVP,混合液在4℃、12 000×g離心力下離心10 min,取萃取上清液測定蛋白質的含量和氧化酶的活性。蛋白質的測定根據Lowry等[13]提出的方法進行,即取0.6 mL萃取上清液稀釋5倍,加入3 mL由溶于0.1 M NaOH的2% Na2CO3和溶于1%酒石酸鈉的0.5% CuSO4組成的混合液,在25°C水浴中反應10 min后加入50%(V/V)Folin試劑,靜置30 min,于波長750 nm處測定吸光度值,計算蛋白質的含量。蛋白質標準曲線由牛血清蛋白標準物質在相同的步驟下測定得出。SOD活性單位以抑制氮藍四唑(NBT)光化還原的50%為一個酶活性單位表示[14];CAT活性由萃取液和過氧化氫在24 °C常壓下產生的氧氣量決定[15]。
1. 4 數據處理
數據以平均值±標準偏差SD標記;處理前(0 d)的數據與處理后(20 d)的數據之間的顯著性差異采用統計學單因素方差分析,并采用LSD 檢驗進行兩兩比較(p<0.05)。
2 結果與分析
2. 1 水體中pH值和營養鹽濃度的變化
經過20 d處理后,各試驗組水體中pH值和營養鹽濃度見圖2和表1。
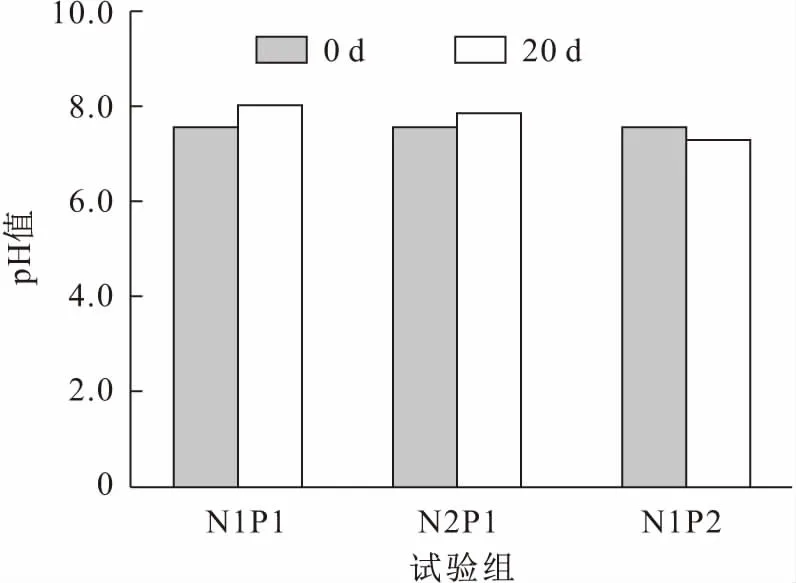
圖2 試驗前后各試驗組水體中pH值變化Fig.2 Changes of pH at the beginning and the end of the experiments
由圖2可見,各試驗組水體中pH值沒有顯著差異,試驗結束后各試驗組水體中pH值在7.29~8.00之間。
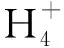
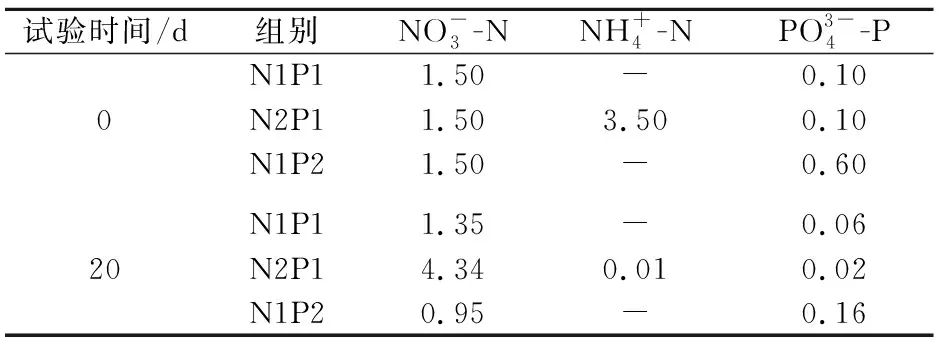
表1 試驗前后各試驗組營養鹽的濃度(mg/L)Table 1 Concentrations of nutrients (mg/L) at the beginning and the end of the experiments
2.2 亞洲苦草葉片中葉綠素a和蛋白質含量的變化
由于本試驗選取的亞洲苦草是健壯并長勢一致的植株,所以在試驗初期(0 d)其葉片中的葉綠素a和蛋白質含量基本一致。經過20 d處理后,亞洲苦草葉片中葉綠素a的含量明顯上升,但與亞洲苦草適宜生存的中濃度氮磷營養鹽(N1P1組)相比,高濃度氨氮(N2P1組)和高濃度磷(N1P2組)處理后的亞洲苦草葉片中葉綠素a含量的上升量要顯著減小,各試驗組之間均存在顯著性差異(見圖3)。與處理前相比,中濃度氮磷營養鹽與高濃度氨氮營養鹽處理后的亞洲苦草葉片中蛋白質含量沒有顯著性差異,見圖4。
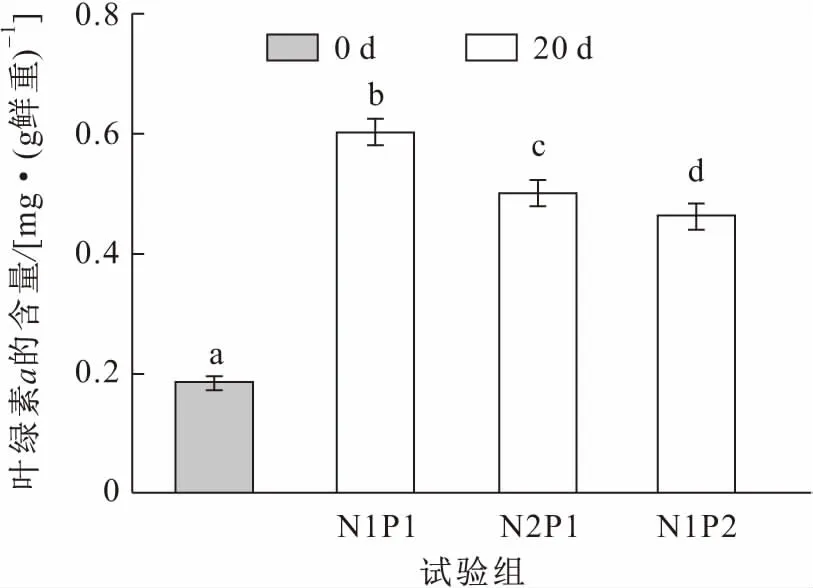
圖3 試驗前后各試驗組亞洲苦草葉片中葉綠素a含量的變化Fig.3 Changes of chlorophyll a content in the leaves of V.asiatica at the beginning and the end of the experiments
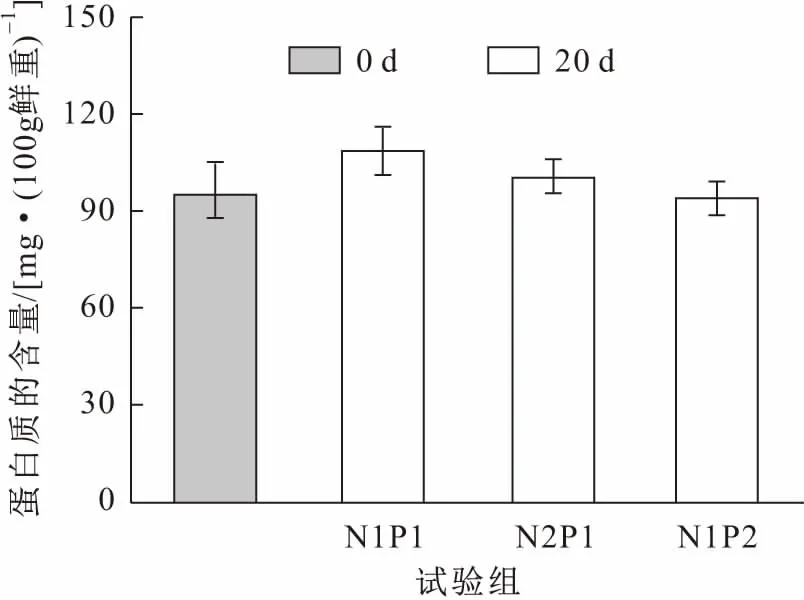
圖4 試驗前后各試驗組亞洲苦草葉片中蛋白質含量的變化Fig.4 Changes of protein contents of in the leaves of V.asiatica at the beginning and the end of the experiments
2. 3 亞洲苦草體內SOD和CAT活性的變化
試驗前后各試驗組亞洲苦草體內SOD和CAT活性的變化見圖5和圖6。

圖5 試驗前后各試驗組亞洲苦草葉片中SOD活性的變化Fig.5 Changes of SOD activities in the leaves of V.asiatica at the beginning and the end of the experiments
由圖5可見,各試驗組的亞洲苦草體內SOD活性與試驗初期相比無任何明顯變化。
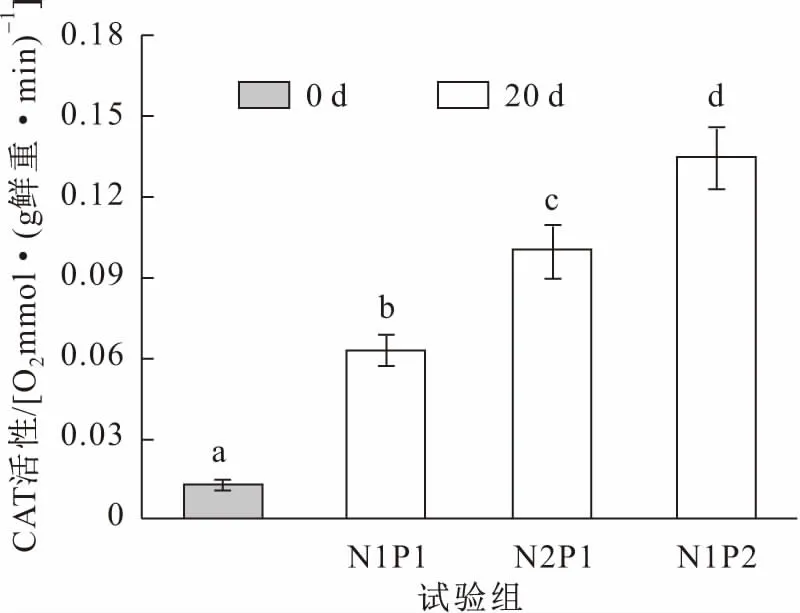
圖6 試驗前后各試驗組亞洲苦草體內CAT活性的變化Fig.6 Changes of CAT activities in the leaves of V.asiatica at the beginning and the end of the experiments
由圖6可見,各試驗組的亞洲苦草體內CAT活性與試驗初期相比明顯上升,且高濃度氨氮(N2P1組)和高濃度磷(N1P2組)處理過的亞洲苦草體內CAT活性要比中濃度營養鹽(N1P1組)處理過的亞洲苦草明顯高很多。
3 討 論
水生植物可以生存的pH值范圍為4~12,適合生長的pH值范圍為6~10[16]。本試驗中,pH值在7.52~8.00之間變化,因此營養鹽濃度是影響亞洲苦草生長的唯一因素。
3. 1 營養鹽對亞洲苦草代謝反應的影響
氮是植物葉綠素的重要組成成分,磷在植物體內也參與光合作用及細胞分裂等其他一些過程,所以氮、磷的補充可以促進植物的生長。經過20 d處理后,亞洲苦草葉片中葉綠素a的含量有明顯上升,表明中濃度氮、磷營養鹽可以促進亞洲苦草的生理代謝;但隨著氨氮或磷濃度的增加,亞洲苦草葉片中葉綠素a的含量與中濃度營養鹽處理后的相比有所下降,表明高濃度氨氮或高濃度磷會抑制亞洲苦草的新陳代謝。葉綠素是植物進行光合作用必不可少的物質,而光合作用是植物體內極為重要的代謝過程,其作用強弱對植物生長及抗逆性具有十分重要的影響[17],因此葉綠素a含量的高低在很大程度上反映了植株的生長狀況和光合作用的效率[17]。環境脅迫可使葉綠素a的含量降低。經中濃度營養鹽處理后,亞洲苦草葉片中葉綠素a的含量顯著增加,表明中濃度氮磷營養鹽可以促進亞洲苦草的光合作用,但隨著氨氮或磷濃度的增加,亞洲苦草光合作用系統受到損傷,光合作用效率受到抑制,這可能是因為高濃度氨氮或高濃度磷會脅迫亞洲苦草產生大量的活性氧,從而對葉綠體結構有損害作用。
植物新陳代謝涉及到的酶絕大多數屬于蛋白質,所以植物體內蛋白質含量常被作為指示外界環境對植物生理影響的指標[17]。本試驗中,各試驗組之間亞洲苦草體內的蛋白質含量沒有顯著性差異,可能是因為處理時間僅為20 d,在短時間內亞洲苦草體內蛋白質的含量無法表現出明顯的區別,而在長時間的高濃度氨氮或磷脅迫下可能會造成亞洲苦草體內蛋白質含量的下降。本試驗結果證明了富營養化水體中高濃度營養鹽是亞洲苦草和其他沉水植物大量衰退的主要原因之一,這與吳義鋒等[18]的研究結果基本一致。
3. 2 營養鹽對亞洲苦草抗氧化反應的影響
經高濃度營養鹽處理后亞洲苦草體內CAT活性急劇上升,表明亞洲苦草受到高濃度營養鹽的脅迫。活性上升的CAT和基本不變的SOD顯示亞洲苦草通過提升自身的CAT酶活性來適應逆境脅迫[19],且CAT比SOD對于高濃度營養鹽的脅迫更加敏感。SOD和CAT作為亞洲苦草自身保護系統的重要組成部分,可以保持活性氧在其產生和清除之間處于動態平衡,避免活性氧過量對植物造成的傷害。SOD通過歧化反應可將有害的超氧自由基轉化為過氧化氫;盡管過氧化氫仍是對有機體有害的活性氧,但是CAT會立即將其分解為完全無害的水[20]。本試驗中亞洲苦草體內SOD活性基本沒有變化,未被SOD歧化降解的超氧自由基可以通過Haber-Weiss反應轉化為毒性更強的羥自由基[21]。所以,高濃度氨氮或高濃度磷對亞洲苦草造成傷害可能一部分歸因于超氧自由基和過氧化氫,另一部分則歸因于毒性更大的羥自由基。在經過20 d處理后,亞洲苦草體內CAT活性急劇上升,表明在遭受高濃度氨氮或高濃度磷脅迫時,亞洲苦草體內保護酶系統啟動,以抵御外界環境脅迫對亞洲苦草造成的氧化損傷。亞洲苦草對氮、磷營養鹽的抗氧化反應機理見圖7。

圖7 亞洲苦草對氮、磷營養鹽的抗氧化反應Fig.7 Antioxidant responses of V.asiatica to N and P nutrients
3. 3 營養鹽對亞洲苦草生理反應的影響
由圖7可知,中濃度的氮、磷營養鹽可以促進亞洲苦草的生長。亞洲苦草在正常的有氧代謝過程中,不可避免地會產生活性氧,SOD和CAT發揮其清除過剩活性氧的功能使亞洲苦草體內活性氧在產生和清除之間維持動態平衡。充足的營養鹽能保證亞洲苦草進行正常的光合作用,體內葉綠素a和蛋白質含量有所提高,生長健康。但是,隨著氨氮或磷濃度的提高,亞洲苦草受到一定的脅迫,CAT活性明顯提高以抵御外界的脅迫,但是抗氧化能力有限,活性氧的動態平衡被打破,產生的大量剩余活性氧對亞洲苦草造成了嚴重的氧化損傷,亞洲苦草的光合作用功能下降,其體內葉綠素a和蛋白質含量相對于中濃度氮、磷營養鹽處理后的含量明顯降低,表明高濃度氨氮或高濃度磷會對亞洲苦草產生脅迫,影響亞洲苦草的健康生長。因此,為了減少對亞洲苦草的氧化損傷,在富營養化水體中恢復沉水植物亞洲苦草時,對氮、磷營養鹽進行雙重控制是非常必要的。
另外,在貧營養水體中,沉水植物可以直接從水層和底泥中吸收氮、磷營養鹽,降低水體中的氮、磷營養物質的濃度,從而抑制藻類生長[22]。隨著水體中營養鹽濃度的增加,藻類大量繁殖,從而對沉水植物產生遮光效應,同時形成的低CO2環境也會抑制沉水植物的生長[23]。雖然在本試驗期間試驗水槽中沒有藻類生長,但在富營養化水體中恢復沉水植物時仍要注意藻類的生長繁殖對其生長的影響。
4 結 論
(1) 對于中高濃度氮、磷營養鹽的脅迫,CAT比SOD更為敏感,亞洲苦草可以通過提高CAT活性來抵御外界環境的脅迫。
(2) 對于高濃度氨氮或高濃度磷脅迫,亞洲苦草的抗氧化保護系統雖然被激活,但是不能保證亞洲苦草的代謝系統免受損傷,直接危害表現為亞洲苦草葉片中葉綠素a的含量明顯下降。
(3) 富營養化水體中沉水植物消失的重要原因之一是氮、磷營養鹽濃度的增加,所以在富營養化水體中恢復沉水植物亞洲苦草時,對氮、磷營養鹽進行雙重控制是至關重要的。
參考文獻:
[1] 何俊,谷孝鴻,劉國鋒.東太湖水生植物及其與環境的相互作用[J].湖泊科學,2008,20(6):790-795.
[2] 楚建周,王圣瑞,金相燦,等.底質營養狀況對黑藻生長及光合作用的影響[J].生態環境,2006,15(4):702-707.
[4] Nimptsch J,Pflugmacher S.Ammonia triggers the promotion of oxidative stress in the aquatic macrophyteMyriophyllummattogrossense[J].Chemosphere,2007,66:708-714.
[5] Wang X L,Lu Y L,He G Z,et al.Multivariate analysis of interactions between phytoplankton biomass and environmental variables in Taihu Lake,China[J].Environ.Monit.Assess.,2007,133:243-253.
[6] Zhu G W,Qin B Q,Gao G,et al.Effects of hydrodynamics on phosphorus concentrations in water of Lake Taihu,a large,shallow,eutrophic lake of China[J].Hydrobiologia,2007,581:53-61.
[7] 朱廣偉.太湖富營養化現狀及原因分析[J].湖泊科學,2008,20(1):21-26.
[8] 簡敏菲,簡美鋒,李玲玉,等.鄱陽湖典型濕地沉水植物的分布格局及其水環境影響因子[J].長江流域資源與環境,2015,24(5):765-772.
[9] 毛玉婷,周曉宇,王毛蘭.枯水期鄱陽湖水體富營養化狀態評價[J].南昌大學學報(理科版),2014,38(6):596-599.
[10]孫祥鐘,王徽勤,李清義,等.中國植物志[M].北京:科學出版社,1992:176-186.
[11]胡光濟,張維昊.湖泊水華生物防治技術研究進展[J].安全與環境工程,2008,15(3):36-40.
[12]Arnon D I.Copper enzymes in isolated chloroplast:Polyphenoloxidase inBetavulgaris[J].PlantPhysiology,1949,24:1-15.
[13]Lowry O H,Rosebrough N J,Farr A L,et al.Protein measurement with the Folin phenol reagent[J].BiologicalChemistry,1951,193:265-275.
[14]Beauchamp C,Fridovich I.Superoxide dismutases:Improved assays and an assay applicable to acrylamide gels[J].AnalyticalBiochemistry,1971,44:276-287.
[15]Greenfield R E,Price V E.Liver catalase Ι:A manometric determination of catalase activity[J].BiologicalChemistry,1954,209:355-361.
[16]楊旻,吳小剛,張維昊,等.富營養化水體生態修復中水生植物的應用研究[J].環境科學與技術,2007,30(7):98-102,121.
[17]Wang C,Zhang S H,Wang P F,et al.Metabolic adaptations to ammonia-induced oxidative stress in leaves of the submerged macrophyteVallisnerianatans(Lour.) Hara[J].AquaticToxicology,2008,87:88-98.
[18]吳義鋒,呂錫武,薛聯青.水體富營養化驅動因子粗糙分析[J].安全與環境工程,2005,12(4):11-14.
[19]Cao T,Ni L Y,Xie P.Acute biochemical responses of a submersed macrophyte,PotamogetoncrispusL.,to high ammonium in an aquarium experiment[J].JournalofFreshwaterEcology,2004,19(2):279-284.
[20]Mishra S,Srivastava S,Tripathi R D,et al.Lead detoxification by coontail (CeratophyllumdemersumL.) involves induction of phytochelatins and antioxidant system in response to its accumulation[J].Chemosphere,2006,65:1027-1039.
[21]Yu B P.Cellular defenses against damage from reactive oxygen species[J].PhysiologicalReviews,1994,74:139-162.
[22]Pflugmacher S,Jung K,Lundvall L,et al.Effects of cyanobacterial toxins and cyanobacterial cell-free crude extract on germination of alfalfa (Medicagosativa) and induction of oxidative stress[J].EnvironmentalToxicologyandChemistry,2006,25:2381-2387.
[23]Simpson P S,Eaton J W.Comparative studies of the photosynthesis of the submerged macrophyteElodeacanadjensisand the filamentous algaeCladophoraglomerataandSpirogyrasp.[J].AquaticBotany,1986,24:1-12.

