結直腸癌患者術前GPS與術后并發癥及預后的相關性
張宇澄 盛宇偉 喬治 宋海瑚 沈彪
上海市第一人民醫院寶山分院1普外科,2乳腺外科(上海 200940)
結直腸癌是一種常見的消化系統惡性腫瘤,發病率及死亡率僅次于胃癌。其常用的治療方式有手術及放化療,手術治療中的腹腔鏡已在臨床中被廣泛采用[1-3]。格拉斯哥預后評分系統(glasgow prognosis score,GPS)以炎性反應及營養為基礎,證實與多種癌癥的不良預后有關[4-6]。近年來,有許多GPS與腫瘤關系方面的研究探索,龔蘭等[7]發現,患者術前CEA及腫瘤分期越高,GPS評分也越高,說明消化系統腫瘤與GPS評分之間存在一定的關系,但僅憑GPS評分對腫瘤預后評估,預測能力存在一定的局限性。EREN等[8]證實,GPS是惡性腫瘤總生存時間的獨立預后因素,同樣也沒有對單一一種惡性腫瘤進行分析。同時,崔瑤等[9]發現,GPS不僅是胃癌術后生存時間的預后因素,還與圍手術期并發癥發生率有關,但沒有說明是否適用于結直腸癌。從ROXBURGH等[10]研究發現中可以看出,機體炎性狀態也隨時影響著腫瘤的發生、進展及預后。而結直腸癌腹腔鏡術后預后與全身炎癥狀態密切相關,且近年來的研究均顯示GPS可預測多種腫瘤的短期和長期的預后狀態,但GPS是否可以作為結直腸癌腹腔鏡切除的預后指標目前尚不清楚。本文旨在通過對腹腔鏡下結直腸癌切除患者進行,分析其GPS評分與術后生存情況,探討GPS評分與結直腸癌術后并發癥及預后的關系,以減輕病痛,避免復發,改善預后。
1 對象與方法
1.1 研究對象回顧性分析2014年3月至2015年9月我院進行腹腔鏡下結直腸癌切除術的患者120例作為研究對象,其中男78例,女42例。患者年齡36~72歲,平均(52.92±10.04)歲。納入標準:(1)患者病例資料完整;(2)經病理科確診為結直腸癌,癌癥類型明確并進行分期;(3)年齡>30歲。排除標準:(1)合并感染及其他系統疾病等對炎性反應指標有影響的疾病。(2)出現消化系統出血、梗阻以及穿孔等急診手術患者。(3)合并其他腫瘤。(4)圍手術期死亡患者。本研究患者均接受腹腔鏡手術治療。所有參與者均簽署有關知情同意書,并獲我院倫理委員會批準。
1.2 研究方法
1.2.1 臨床資料記錄患者入院后整理并收集完整臨床資料,包括身高、病程、病史、合并癥、病程、腫瘤部位、腫瘤大小、病理學類型、腫瘤位置、脈管癌栓、淋巴結轉移情況。
1.2.2 血清CRP、ALB及CEA水平的測定所有研究對象進行術前及術后隨訪過程中抽血檢驗,抽血方式為:晨起空腹狀態下抽取靜脈血液3 mL,依次進行抗凝、離心,取血漿置Eppendorf管中,在-80℃的冰箱中冷凍保存待檢。(1)CRP含量測定:采用免疫濁度法,使用HITACtti7600全自動生化分析儀測定及湖南永和陽光科技有限責任公司hCRP試劑盒對CRP水平進行測定(CRP>10 mg/L判定為陽性)。(2)ALB含量測定:采用溴甲酚綠方法,使用HITACtti7600全自動生化分析儀及北京利德曼公司試劑盒對ALB水平進行測定(ALB<35 g/L判定為陽性)。(3)CEA含量測定:ELISA法直接檢測血清CEA濃度(CEA>5 ng/mL判定為陽性)。
1.2.3 GPS評分指標患者外周血CRP水平以及ALB水平均判定陽性記作2分;2項指標中有1項判定為陰性記作1分;2項指標均為陰性記作0分。
1.3 手術方式患者入院后予以二級護理,低鹽低脂飲食,術前進行灌腸、控制血壓血糖、備血等術前準備;在全麻下行“腹腔鏡結直腸癌根治術”,從建立氣腹、分離腸段、結扎血管、清掃淋巴結、切除腫瘤、吻合腸段等六部進行手術。術后觀察患者生命體征變化情況;給予一級護理,對其作出“心電監護、吸氧、抗炎、抑酸”醫囑,密切觀察電解質平衡,如有其他不適進行對癥處理。
1.4 隨訪對所有參與研究的120名患者進行為期18個月的隨訪,每位患者隨訪起始時間為治療結束后3個月,每3個月門診隨訪一次,每次隨訪時對研究對象進行CEA值及中性粒細胞、血小板、淋巴細胞水平檢測以及GPS評分。終點事件為:患者結直腸癌復發、分期上升、出現其他器官轉移和因結直腸癌及其并發癥導致死亡。患者拒絕訪問、中途退出、死于其他與研究無關的原因定義為失訪。根據隨訪結果,將出現終點事件的患者定義為不良預后組,其余患者定義為預后良好組。分析兩組的基線資料(發病年齡、體質量指數、病理學類型、腫瘤分型、TNM分期)、CEA值,及中性粒細胞、血小板、淋巴細胞水平以及GPS評分等。
1.5 統計學方法采用SPSS 24.0軟件進行統計學分析,腫瘤大小、年齡、體質量指數、CEA、中性粒細胞、血小板、淋巴細胞水平等計量資料用±s來表示,病理學6類型、腫瘤分型、TNM分期等計數資料用例數表示。采用Kaplan-Meier法繪制患者生存曲線,計算不良預后率。單因素分析對結直腸癌腹腔鏡手術患者預后影響的因素。以COX回歸對觀察指標進行分析,篩選結直腸癌腹腔鏡手術患者預后顯著影響的獨立影響因素。P<0.05時認為差異有統計學意義。
2 結果
2.1 患者一般資料分析本研究共納入120例患者,男78例,女42例;平均腫瘤大小(4.53±0.63)cm;TNM分期Ⅰ期23例,Ⅱ期97例;平均淋巴結轉移8.34個;脈管癌栓陰性89例,陽性31例;腺癌64例,黏液腺癌56例;術前血清CEA陽性41例,陰性79例;術前血清CRP陽性69例,陰性51例;術前血清ALB陽性65例,陰性55例。一般資料詳見表1。
2.2 隨訪結果在隨訪結束時,全體患者失訪9例,69例到隨訪結束未發生終點事件,42例出現了終點事件,其中結直腸癌復發18例、分期上升11例、肝轉移7例、死亡6例。Kaplan-Meier生存曲線(圖1)顯示,隨著時間延長,患者中不良預后的產生例數增多,在隨訪第5個月和12個月產生不良預后的例數增長較為明顯,患者的不良預后率為37.84%。

表1 結直腸癌腹腔鏡手術患者一般資料Tab.1 General data of colorectal cancer patients undergoing laparoscopic surgery 例

圖1 結直腸癌腹腔鏡手術患者不良預后發生情況(Kaplan-Meier法)Fig.1 The circumstance of poor prognosis in colorectal cancer patients undergoing laparoscopic surgery(Kaplan-Meier method)
2.2 影響某疾病患者預后轉歸情況的單因素分析將可能影響某疾病患者預后的因素(發病年齡、體質量指數、病理學類型、腫瘤分型、TNM分期、血清CEA水平、中性粒細胞、血小板、淋巴細胞水平以及GPS評分)逐個納入COX比例風險模型中進行單因素分析,結果顯示:體質量指數、與血小板均對結直腸癌腹腔鏡手術患者預后影響無統計學意義(P>0.05);而血清指標CEA(術前)(P=0.013)、中性粒細胞(術前)(P=0.025)、淋巴細胞(術前)(P=0.029)以及GPS評分(術前)(P=0.004)對結直腸癌腹腔鏡手術患者預后預后影響顯著,差異有統計學意義(P<0.05),見表2。
2.3 影響某疾病預后的多因素COX回歸分析篩選單因素COX回歸有統計學意義的因素進行多因素COX回歸分析,結果顯示:中性粒細胞和淋巴細胞預后的影響不明顯(P>0.05);CEA(P=0.035)和GPS評分(P=0.023)是影響預后的獨立影響因素;進一步分析發現,根據RR值,對患者預 后的影響從大到小依次是CEA、GPS評分,見表3。
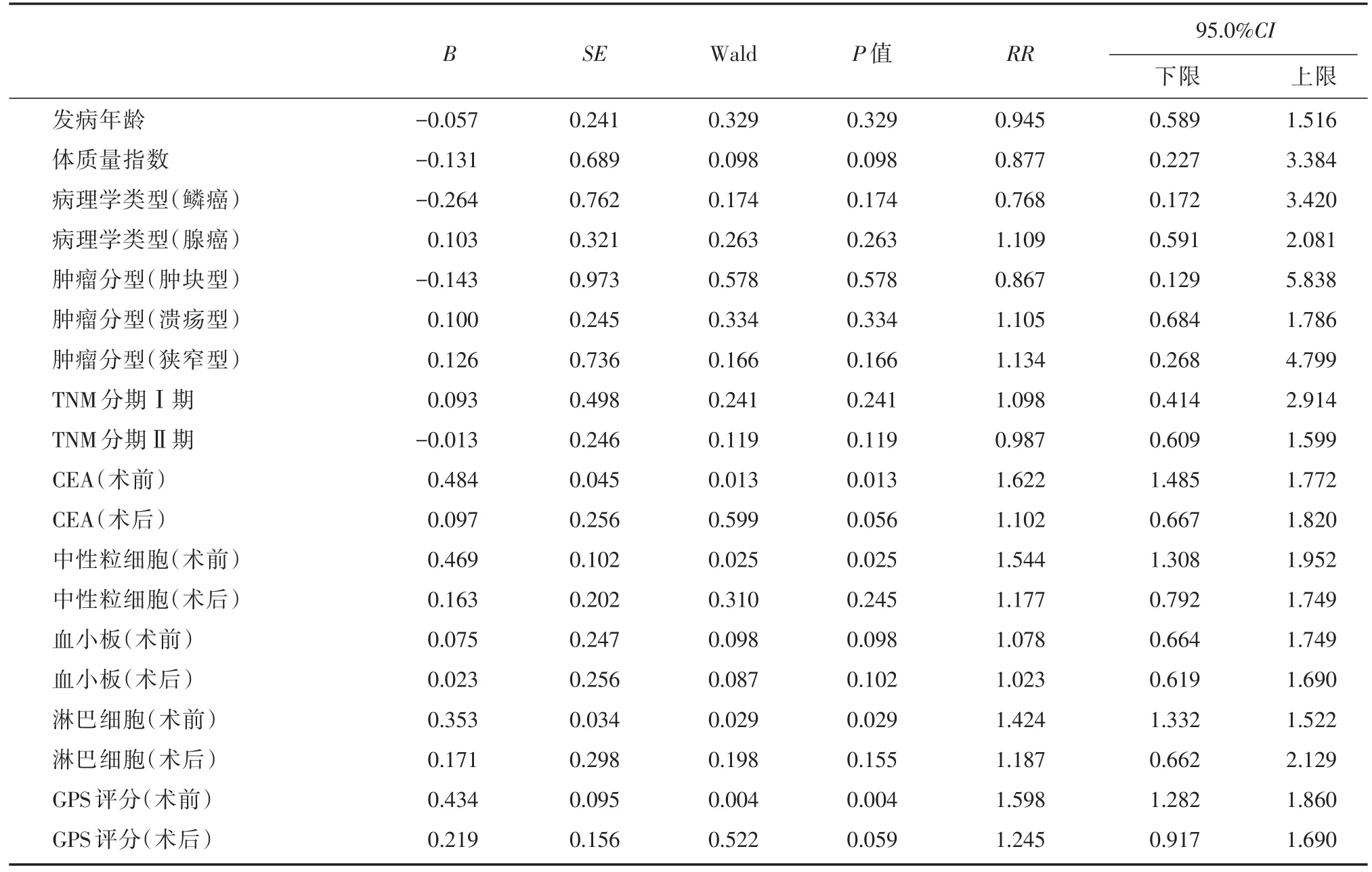
表2 結直腸癌腹腔鏡手術患者不良預后的COX單因素分析Tab.2 COX single factor analysis of the prognosis of colorectal cancer patients undergoing laparoscopic surgery

表3 結直腸癌腹腔鏡手術患者不良預后的COX多因素分析Tab.3 COX multivariate factor analysis of the prognosis of colorectal cancer patients undergoing laparoscopic surgery
3 討論
近年來結直腸癌作為常見的消化系統腫瘤,發病率呈逐年上升趨勢[11]。隨著對疾病的認識不斷加深以及臨床研究使得結直腸癌治療后能夠有更好的預后,關于其預后的研究一直是近年來的研究熱點。近幾年研究證明,TGF-β1、E-cadherin、Stat3、miR-152等生化指標及蛋白可不同程度地預測結直腸癌預后[12-15]。目前,臨床上主要通過CEA水平、TNM分期、病理分型等基礎檢測手段進行疾病預測,然而,隨著人們生活環境的改變,疾病也在發生著變異,目前迫切需求新的更為準確的預測指標來對結直腸癌患者進行預后評估。本研究將血清CEA水平和疾病GPS評分同時進行分析,來提高預測結直腸癌患者預后的準確性。
由于腫瘤細胞變異程度較大,對疾病的治療困難加劇,患者預后效果顯著降低。SIEGEL等[16]對結直腸癌流行病學研究表明,1、3、5年總體生存率為94.23%、74.53%、55.14%,本研究隨訪時間為18個月,截止隨訪結束樣本生存率為95%,并且在隨訪期內隨時間推移逐步降低。與SIEGEL等的研究結果基本一致。本研究定義終點事件為患者自入選時間起于隨訪期間發生不良預后事件。研究結果顯示,由于發生終點事件的人數較多,隨訪期間的第5個月和第12個月左右,生存曲線下降較為明顯,其中發生結直腸癌復發的患者約35%,分期上升的約25%,出現其他器官轉移的約10%,因本疾病及其并發癥導致死亡的約30%。筆者認為,發生生存率的偏差和終點事件的原因可能是由于隨訪者的年齡較高,患者多合并有如糖尿病、高血壓和其他系統疾病等慢性疾病,或由于結直腸癌患者有較多致病危險因素,對預后產生了不良影響。
經過流行病統計學分析研究[17],結直腸癌患者的年齡80%分布在50~65歲之間,原因主要是以生活習慣以及生活環境為主的危險因素導致細胞癌變,同時老年人的免疫力較弱,極易發生淋巴轉移,治療及術后恢復難度較大。在結腸癌患者當中男性與女性人數之比大約為1∶0.5,男性要顯著多余女性,且預后與女性相比較差,原因是由雌孕激素以及生育對女性的作用抵制癌細胞的突變。病理學類型方面,結直腸癌病理學類型分為黏液腺癌和腺癌兩類,從統計學上看[18],腺癌的發生率要遠高于黏液腺癌,且分化程度低,預后也極差。同時,CEA作為大腸癌組織的一種抗原可以引起患者的免疫反應,廣泛存在與各種消化系統的惡性腫瘤中,同時正常組織也會有存在,但是是低水平。雖然其對結直腸癌有一定的診斷作用,但是由于其特異性和靈敏性不高,因此對腫瘤的早期及預后判斷作用不明顯。有研究表明[19-20],炎性作用在腫瘤的發生發展中起到了決定性作用,隨著惡性腫瘤的發展,炎性細胞的水平也隨之升高,例如中性粒細胞、血小板、淋巴細胞水平均可能隨著癌細胞的突變而升高。而GPS更是以炎性和營養性為基礎對疾病的總和評分,來判定術前術后的健康情況。
基于以往研究對影響結直腸癌患者預后危險因素的分析,我們將發病年齡、體質量指數、病理學類型、腫瘤分型、TNM分期、血清CEA水平、中性粒細胞、血小板、淋巴細胞水平以及GPS評分逐個納入COX比例風險模型中進行單因素分析,結果顯示,血清學指標CEA、中性粒細胞、淋巴細胞以及GPS評分為影響結直腸癌患者預后的獨立危險因素,其中影響大小依次是CEA、GPS評分、中性粒細胞、淋巴細胞。我們分析CEA(術前)之所以為最嚴重的危險因素是因為CEA與腫瘤細胞的黏附與凋亡有密切關系,普遍存在于惡性腫瘤患者體內,同時隨著CEA水平的升高,引起細胞的之間極性消失,從而導致細胞排列亂序,進而促進癌細胞的轉移[21],因此CEA水平和結直腸癌患者的預后情況有著密切的聯系。雖然腫瘤的發生發展與炎性因素有著一定的聯系,中性粒細胞以及淋巴細胞會有一定水平的升高,但是中性粒細胞以及淋巴細胞的影響因素較為廣泛,同時其也影響著自身的各個方面,因此中性粒細胞以及淋巴細胞的影響因素較為小。在對結直腸癌患者預后的研究中,GPS評分較少被考慮到,但是隨著近幾年的研究發現,腫瘤的發生發展與炎癥的發展有著密切的聯系,而作為專項炎性指標的評分標準,GPS評分與腫瘤的預后研究則成為現如今的熱點,研究表明[22],隨著腫瘤的發展、擴散以及轉移,炎性指標則也隨之升高,因而導致GPS評分也相應的提高。基于以上的研究,筆者認為可以在術前及術后對患者進行GPS評分,來了解判定患者身體狀況以及預后恢復情況,對疾病的發生發展有更準確的認識。
但由于GPS評分僅包括血清CPR及血清ALB兩個指標,與目前作為預后判斷金標準的TNM分期相比,診斷性能稍弱,但由于其檢測方便,給患者帶來痛苦更少,成本較低,同時CEA廣泛存在于結直腸癌中,但是正常人身體中也有微量存在,因此二者分別單獨評估結直腸癌患者預后時敏感性相比而言較低,臨床應用價值不大。
此外,本研究尚存在一些不足,研究隨訪對象人數較少,項目分析不完善且隨訪時間短,納入結直腸癌腹腔鏡手術患者預后的影響因素較少。筆者將在后續研究中,進一步增加調查人數,延長隨訪時間,多關注前言研究以更精確掌握靜脈血栓相關危險因素,筆者在后續研究中會建立更為完整精確的評分系統或回歸方程來評估預后。
綜上所述,本研究表明CEA和GPS評分是影響結直腸癌患者預后的獨立危險因素,在臨床上具有協助篩選具有預后不良風險患者的作用,從而制定高效的治療方案,提高患者預后。
[1]李道娟,李倩,賀宇彤.結直腸癌流行病學趨勢[J].腫瘤防治研究,2015,42(3):305-310.
[2]姚宏偉,姚響蕓,孫濤,等.腹腔鏡結直腸癌根治性切除聯合同期腹腔鏡或開腹肝大部切除術治療同時性結直腸癌肝轉移的療效分析[J].中華消化外科雜志,2016,15(2):128-134.
[3]JUSTIN G,RODRIGO D,XIN W,et al.The consensus molecular subtypes of colorectal cancer:[J].Nature Medicine,2015,21(11):1350-6.
[4]宋旭敏,任青,程忠平.格拉斯哥預后評分預測腫瘤的臨床價值[J].醫學綜述,2017,23(12):2354-2358.
[5]崔瑤,李劍,劉明月,等.格拉斯哥預后評分對食管胃結合部腺癌患者預后的的預測價值[J].中華胃腸外科雜志,2016,19(1):54-57.
[6]WARD F G,HERNANDEZ M,PALLOT D,et al.Health state preference weights for the glasgow outcome scale following traumatic brain injury:a systematic review and mapping study[J].Value in Health,2016,20(1):141-151.
[7]龔蘭,吳瑜霞,陳振宇,等.GPS評分與結直腸癌預后的關系[J].檢驗醫學與臨床,2016,13(14):1987-1989.
[8]EREN T,BURCU B,TOMBALAK E,et al.Clinical significance of the glasgow prognostic score for survival after colorectal cancer surgery[J].J Gastrointest Surg,2016,20(6):1231-1238.
[9]崔瑤,李劍,曹養輝,等.高敏感格拉斯哥評分對進展期胃癌患者新輔助化療療效和預后的預測作用[J].中華腫瘤雜志,2017,39(3):195-200.
[10]ROXBURGH C S,MCMILLAN D C.Cancer and systemic inflammation:treat the tumour and treat the host.[J].British Journal of Cancer,2014,110(6):1409-12.
[11]鄭民華,馬君俊.結直腸癌肝轉移的腹腔鏡微創手術治療[J].中華胃腸外科雜志,2015(6):521-524.
[12]劉賢偉,曹俊達,熊功友,等.TGF-β1、Smad7與樹突狀細胞在結直腸癌肝轉移中作用的初步研究[J].中國普通外科雜志,2015,24(1):63-69.
[13]秦樂,曾妍.E-cadherin缺失表達與結直腸癌患者預后相關性多元Cox回歸分析[J].中國臨床藥理學雜志,2017,33(1):7-9.
[14]RATSIMANDRESY R A,INDRAMOHAN M,DORFLEUTNER A,et al.The AIM2 inflammasome is a central regulator of intestinal homeostasis through the IL-18/IL-22/STAT3 pathway[J].Cellular&Molecular Immunology,2017,14(1):127.
[15]汪毅,袁偉,馬肖,等.miR-152在結直腸癌組織中的表達及其與預后的關系[J].中華腫瘤雜志,2016,38(10):763-766.
[16]SIEGEL R L,MILLER K D,FEDEWA S A,et al.Colorectal cancer statistics,2017[J].Ca A Cancer Journal for Clinicians,2017,67(3):177.
[17]MEESTER R G S,DOUBENI C A,ZAUBER A G,et al.Public health impact of achieving 80%colorectal cancer screening rates in the United States by 2018[J].Cancer,2015,81(5):2281.
[18]王曉娜,梁寒,王家倉,等.1829例結直腸癌患者的臨床病理特征及預后分析[J].中華胃腸外科雜志,2004,7(6):439-442.
[19]陳宣辰,程軍.結直腸癌相關炎性因子的研究進展[J].中國腫瘤生物治療雜志,2012,19(1):103-106.
[20]楊靜,朱元民,劉玉蘭.菌群與黏膜慢性炎性反應在結直腸腫瘤發病中的作用[J].中華消化雜志,2011,31(9):643-645.
[21]ZHOU Z M,FENG Z,ZHOU J,et al.Capillary electrophoresischemiluminescence detection for carcino-embryonic antigen based on aptamer/graphene oxide structure.[J].Biosensors&Bioelectronics,2015,64:493-498.
[22]CUI Y,LI J,CAO Y H,et al.Predictive and prognostic significance of high-sensitivity modified Glasgow Prognostic Score(HS-mGPS)in advanced gastric cancer patients treated with neoadjuvant chemotherapy[J].Zhonghua Zhong Liu Za Zhi.2017,39(3):195-200.

