不同水解度的大豆分離蛋白結構與功能性關系探究
劉汝萃,曲玲玲,牛祥臣,李順秀,李成輝,劉軍
(山東禹王生態食業有限公司,山東德州251200)
近年來,隨著大豆蛋白的結構與功能關系的不斷研究,以及對其營養功能的深入了解,為滿足人們不斷提高生活水平的需求,合理開發優質的蛋白質資源,已經成為當今的熱點話題。
通過酶法改性使得蛋白質大分子水解成較小分子,改變其功能特性,過程中水解度對其功能特性起著主要影響[1],且酶法改性具有改性條件溫和,副產物少等優點得到廣泛利用[2]。蛋白的酶法改性過程中水解度是一個關鍵性因素,一定程度的酶解能夠改變蛋白分子的大小、構象及分子間/內作用力,從而增強其功能性[3-4]。但酶解過度又會造成一些功能性質的喪失,因此蛋白酶解程度的控制對于獲得具有良好功能性質的蛋白制品起到至關重要的作用[5]。蛋白質的持水性、粘度等在食品行業的生產過程中發揮著重要的作用,尤其是對奶油,甜食,糕點的生產中有良好的應用[6-8]。
因此本試驗研究了不同水解度(hydrolyzing degree,DH)下的大豆分離蛋白(soybean protein isolated,SPI)的結構、粘度、溶解性和持水性變化,同時首次在大豆蛋白的分析中利用快速粘度分析儀(rapid viscosity analyzer,RVA)特征譜進行分析,了解蛋白功能性質和DH間的相關性,且探究不同DH下的SPI的結構與其功能性質間關系,旨在為今后SPI能夠更好的應用于食品行業提供理論依據。
1 材料與方法
1.1 材料與試劑
大豆分離蛋白:山東禹王生態食業有限公司;堿性蛋白酶(2.4AU,保存于-4℃):諾維信生物技術有限公司。其它試劑皆為分析純。
1.2 儀器與設備
LG10-2.4A高速離心機:北京京立離心機廠;FA25高剪切分散乳化機:FLUKO儀器有限公司;JJ-1增力電動攪拌器、HH-6數顯恒溫水浴鍋:常州國華電器有限公司;ML 1502E電子分析天平:梅特勒-托利多有限公司;PHSJ-4F pH計:上海儀電科學儀器;4500 RVA快速粘度測定儀:波通瑞華科學儀器;LPG-5高速離心式噴霧干燥機:江蘇先鋒有限公司。
1.3 試驗方法
1.3.1 pH-stat法測定SPI的DH
參考姚玉靜的方法[9],略有改動。稱取一定量SPI,配制成5%的溶液,攪拌至底物均勻分散于水中,水浴溫度55℃,pH調到10,按10%的質量比添加堿性蛋白酶,反應過程中及時加入1 mol/L的NaOH,使系統保持在pH為10,酶解400min,按公式(1)計算SPI的DH,并繪制水解度曲線。
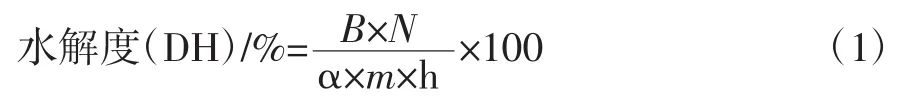
式中:B為消耗堿量,mL;N為堿的摩爾濃度,mol/mL;α為氨基的平均解離度;pH為10、溫度為55℃時,α=0.44;m 為被酶解蛋白的質量,g;h為每克蛋白質底物具有的肽鍵毫摩爾數,大豆分離蛋白h=8.38(mmol/g蛋白質)。
1.3.2 不同DH的SPI樣品制備
將一定量SPI樣品,配置5%的底物濃度的蛋白液,攪拌至均勻分散于水中,水浴溫度55℃,調節pH為10,按0.1%的比例添加堿性蛋白酶,反應過程中及時加入1 mol/L的NaOH溶液,使體系pH值保持在10,酶解不同的時間,噴霧干燥酶解液即得不同酶解程度的SPI樣品。
1.3.3 SDS-PAGE電泳測定方法
SDS-PAGE不連續電泳各部分凝膠的配制見表1。
將配好濃縮膠平穩加入距玻璃板上部邊緣5 mm處,快速插進樣梳,靜置40min,拔出樣梳。樣品和marker變性經100℃水浴5min,上樣。連接電極,調節電壓(濃縮膠時電壓為80 V,等到溴酚藍前沿進入分離膠后加壓到120 V)。將緩沖液加到電泳槽里,連接好電源,開始電泳,先將電流調到10 mA,然后進入分離膠后調至20 mA,待溴酚藍距離膠片邊緣約5 mm時,關閉電泳儀。電泳結束后,小刀沾水撬開未放梳子端的玻璃板,取出膠片放入固定液中,固定30min后,對固定液進行回收,加入染色液染色12 h左右,再用脫色液脫色,用水平搖床脫色,直到膠片上條帶清晰[10]。

表1 SDS-PAGE不連續電泳各部分凝膠的配制Table 1 Gel formulation of SDS-PAGE electrophoresis
1.3.4 持水性測定
稱取10 gSPI樣品于燒杯中,先加入20 g蒸餾水,混合攪拌直到產品完全溶于水中。然后傾斜/翻倒燒杯,觀察溶液的反應是類似膏狀還是液體,溶液的反應應該像液體一樣,類似薄煎餅的糊狀,順著杯子的一側滑下來。如果溶液不流動,則需要持續加水并攪拌,直到溶液可以滑動下來。如樣品較稠,則需要加蒸餾水(1 g/次)直到溶液可以被倒出來,調整后記錄共添加蒸餾水的質量,根據公式(2)計算持水性。
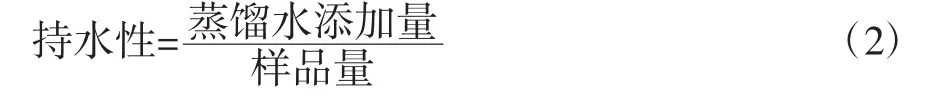
1.3.5 溶解性測定
參照Qi[11]的方法,稍有改動。配制2%的蛋白溶液,之后進行磁力攪拌1 h,再4 500 r/min離心10min,采用凱氏定氮法(N×6.25)[12]測定上清液中的氮含量。根據公式(3)計算蛋白樣品的溶解性。

1.3.6 RVA 粘度測定
將制備得到的不同DH的SPI樣品進行粘度測定,稱取10 g樣品,按照1:3(質量比)的比例加入蒸餾水制得蛋白乳狀物。混合于RVA樣品缽中,攪拌均勻。測定程序如下:樣品放入粘度計中速率以160 r/min的轉速攪拌,每份樣品在50℃下保持1min,然后于8min內線性加熱到95℃,并持續4min。然后冷卻到50℃,持續3min,整個過程為22min。用RVA配套軟件獲得RVA曲線并進行分析。
1.4 統計分析
采用Excel 2007軟件和SPSS 17.0軟件對數據進行處理、繪圖,對結果進行統計、分析。除非另有說明,所有試驗重復3次,并且結果表示為重復分析的平均值±標準偏差。利用SPSS系統對數據進行方差分析(Analysis of Variance,ANOVA)和最小顯著差異(Least-Significant Difference,LSD)試驗。顯著性水平設定為P<0.05。
2 結果與分析
2.1 SPI的 DH 分析
pH-stat法測定SPI不同酶解時間下的DH情況,結果如圖1所示。
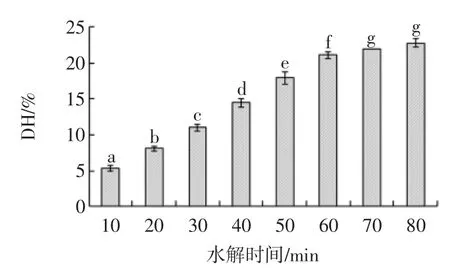
圖1 不同水解時間下DH曲線圖Fig.1 The graph of hydrolysis under different hydrolysis time
由圖1得出,采用堿性蛋白酶酶解SPI,在60min內時酶解顯著性增加(P<0.05),在酶解 60min 時 SPI的 DH 為(21.1±0.5)%。在 60min~80min 之后,隨著酶解時間的繼續延長,SPI的DH的增長速度趨緩,最終DH 達到(22.80±0.6)%。根據水解時間與 DH 的變化曲線,選擇0~60min作為制備酶解SPI的酶解時間進行以下試驗。堿性蛋白酶酶解 0、10、20、30、40、50、60min,制得 SPI的 DH 分別為0%、5.4%、8.1%、11.0%、14.5%、17.9%、21.1%。
2.2 不同DH的SPI的SDS-PAGE凝膠電泳分析
對不同DH的SPI進行SDS-PAGE凝膠電泳,結果如圖2所示。
由圖2的不同酶解時間下的SDS-PAGE電泳圖可以看出,SPI水解后,隨著DH的升高(圖由左至右),A亞基和B亞基附近的低分子蛋白條帶逐漸減少。趙謀明等[13]研究表明,使用堿性蛋白酶酶解時,酶解主要作用在7S和11S的酸性亞基上。圖2中DH在21.1%時的條帶上看,7S和11S的酸性亞基已經一部分被降解。通常來說,堿性蛋白酶酶解對堿性亞基作用較弱,依然有堿性亞基存在。水解度的升高,使得分子量逐漸減小,進而使溶液粘度下降,從而有利于蛋白的起泡性[14]。而隨著酶解時間的延長,7S亞基條帶變化并不是特別明顯,說明堿性蛋白酶對7S敏感性較低。
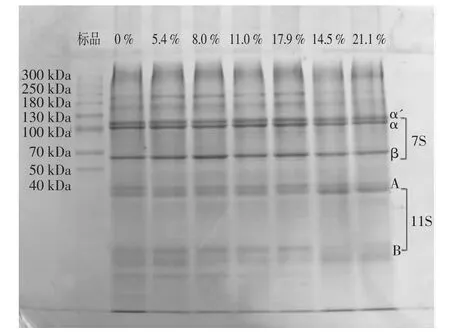
圖2 不同DH的SPI的SDS-PAGE電泳圖Fig.2 The SDS-PAGE electrophoresis of soy separated protein with different hydrolysis
2.3 不同DH的SPI的持水性分析
在食品加工和保藏過程中,蛋白質的持水能力比其結合水的能力更為重要,持水能力是指蛋白質吸水并將水分保留在蛋白質組織中的能力,蛋白質的持水能力與結合水的能力正相關,蛋白質截留水的能力與絞肉制品的多汁性和嫩度有關,也與焙烤食品和其他凝膠類食品的質構相關,適當的選擇持水性在食品的加工中起到重要的意義[15]。
對不同DH的SPI的進行持水性分析,結果如圖3所示。

圖3 不同DH的SPI的持水性圖Fig.3 The Water-holding graph of soy separated protein with different hydrolysis
由圖3得出,不同DH的SPI的持水性隨著水解度的增大而顯著性降低(P<0.05),在 DH 為21.1%時,最終持水性由 2.85降低至 2.2。劉宏芳等[16]認為酶解修飾處理明顯地降低了持水性,這可能是由于所用的SPI是商品化產品,在生產過程中通過某些處理使得保水性最大化,因此,酶解修飾處理反而降低它的持水性。從試驗結果來看,酶解修飾的分離蛋白產品持水性均顯著下降,且水解度增大,持水性明顯降低。這是由于DH進一步增大,形成更多的小分子,更加不利于形成蛋白質的網狀結構(凝膠),導致蛋白的持水能力降低。同時研究表明:蛋白的持水性強弱能進一步改善產品的溶脹特性,而良好的溶脹特性是良好持水性蛋白質制品的必須具備條件之一。
2.4 不同DH的SPI的溶解性分析
測定不同DH的SPI的溶解性,結果見圖4所示。
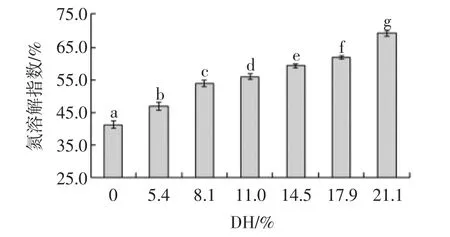
圖4 不同DH的SPI的溶解性圖Fig.4 The solubility graph of soy separated protein with different hydrolysis
由圖4可以看出,不同DH的SPI的溶解性隨著水解度的增大而顯著性增加(P<0.05),在 DH 為21.1%時,最終溶解性由(41.33±1.18)%升高至(61.25±0.96)%。這是由于隨著DH的提高,蛋白質由大分子解離為小分子,蛋白質顆粒變小,表面積增加,相互作用加強,因此溶解性增加。李秀川等[17]研究SPI經水解后斷裂成小分子短鏈物質,使得-NH2和-COOH的數目增多,極性增加,電荷密度增大,分子間相互排斥作用增加,親水性增強,從而提高了溶解性。這一點在實際生產中制造需要補充蛋白源的酸性飲料來說有著重要意義。
2.5 不同DH的SPI的RVA粘度分析
對不同DH的SPI的進行RVA粘度分析,結果如圖5所示。

圖5 不同DH的SPI的RVA圖譜Fig.5 The graph of RVA of soy separated protein with different hydrolysis
由圖5可以看出,隨著DH的增加,SPI的最低粘度和最終粘度都呈降低的趨勢。RVA的最低粘度由629 cp降低至285 cp,RVA的最終粘度由1 945 cp降低至545 cp。這也許是由于蛋白質天然三級結構較致密,蛋白酶作用于大豆分離蛋白后,隨著水解的進行,小分子肽類增多,分子量逐漸減小,與圖2電泳結果一致。反應進行中原來的蛋白質網狀結構被破壞,膨脹性減小,導致溶液RVA粘度下降。
食品工業生產中粘度是非常重要的指標,通常根據其粘度來設計食品配方、控制結構及適口性。在蛋白飲料或高蛋白果胨加工中,經常會因為大豆蛋白的粘度隨濃度增高而急劇升高、流動性差、作業性不好而影響生產應用,適當程度的酶解具有抑制蛋白質形成凝膠的性質,還可以保持溶解狀態,更具有開發利用價值。
2.6 SPI的DH與特征值分析結果
對不同DH的SPI與其功能性指標的相關性分析結果見表2所示。

表2 SPI的DH與其特征值的相關性Table 2 The correlation between DH and eigenvalue of SPI
試驗結果表明:SPI的DH與RVA粘度值、持水性之間都呈顯著負相關,與溶解度之間呈現正相關關系。相關性數值較大,都大于0.9,說明其相關程度較大。蛋白質的其他功能特性如起泡性、乳化性、凝膠形成性、潤濕性、水合性和分散性等的發揮都與溶解性密切相關,溶解性對蛋白質的提取、純化、分離及加工條件的確定也是至關重要的[18-19]。
3 結論
綜上所述,研究60min內酶解SPI的DH與其功能性的關系發現:隨著SPI的DH升高,其SPI的SDS-PAGE凝膠電泳顯示其分子量降低,小分子的蛋白逐漸增多,因為水解進行時,蛋白質分子中的疏水氨基酸及維持蛋白質穩定結構的氫鍵、范德華力、離子鍵等鍵也受到不同程度的破壞,進而對大豆蛋白功能性質產生影響。隨著DH的增大,持水性逐漸降低,溶解性逐漸增加,粘度值也明顯降低。其不同DH的SPI與功能性相關性結果都在0.9以上,相關性較高;SPI的DH與RVA粘度值、持水性之間都呈顯著負相關,與溶解度之間呈現正相關關系。大豆分離蛋白酶解由于其功能特性發生了顯著的變化,因此,在食品加工中的應用也就更為廣泛,選擇適當的酶解程度可以應用于糕點及乳制品、蛋白飲料等加工過程中。
[1]何希強,肖懷秋,李玉珍.豌豆蛋白酶法水解及產物特性研究[J].糧油食品科技,2012,20(5):8-11
[2]李玉珍,肖懷秋.大豆分離蛋白不同酶解方式水解度與乳化性和起泡性關系[J].食品與發酵科技,2009,45(4):30-32
[3]孔祥珍,周惠明,錢海峰.小麥面筋蛋白酶解物的制備及其功能性質研究[J].中國農業科學,2006,39(3):593-598
[4]張欣,施利利,丁得亮,等.稻米蛋白質相關性狀與RVA特征譜及食味品質的關系[J].食品科技,2014(10):188-191
[5]楊柳,江連洲,李楊,等.水酶法提取的大豆蛋白功能特性研究[J].食品與發酵工業,2010(6):80-84
[6]Damodaran S.Protein stabilization of emulsions and foams[J].Journal of Food Science,2005,70(3):54-66
[7]Agyare KK,Addo K,Xiong YL.Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH,temperature and salt[J].Food Hydrocolloids,2009,23(1):72-81
[8]Zhong F,Wang Z,Xu S,et al.Functional properties of proteolytic enzyme Modified Soy Protein Isolate[J].Food chemistry,2007,100(3):1371-1375
[9]姚玉靜,崔春,邱禮平,等.pH-stat法和早醛滴定法測定大豆蛋白水解度準確性比較[J].食品工業科技,2008(9):268-270
[10]黃薇,宋永康,余華,等.大豆蛋白酶解肽蛋白Tricine-SDSPAGE分離體系的建立[J].中國糧油學報,2013,28(10):10-14
[11]Qi M,Hettiarachchy N S,Kalapathy U.Solubility and emulsifying properties of soy protein isolates modified by pancreatin[J].Food Sci,1997,62(6):1110-1115
[12]魯健章,孫麗華,周彥鋼.凱氏定氮法測定魚蛋白質含量的干擾因素分析[J].食品科學,2010,31(19):453-456
[13]趙謀明,張遠紅,崔春,等.胃蛋白酶前處理對大豆蛋白酶解特性的影響[J].華南理工大學學報(自然科學版),2012,40(8):110-115
[14]王章存,李樂靜,袁道強,等.豆粕酶解過程中蛋白質分子亞基組成及其抗原性變化[J].食品科學,2013,34(9):267-270
[15]姜紅,遲玉杰,胥偉,等.酸法去酰胺提高大豆分離蛋白持水性的研究[J].食品與發酵工業,2011,37(8):32-36
[16]劉宏芳,侯瑤,趙新淮.大豆蛋白限制性酶解修飾與產品的溶解性和保水性變化[J].東北農業大學學報,2009,40(1):97-103
[17]李秀川,遲玉杰.大豆分離蛋白溶解性能與水解度相關的研究[J].中國糧油學報,2009,24(7):37-40
[18]費國源,孫培龍.蛋白酶改性處理對小麥面筋蛋白溶解度和起泡性的影響[J].農產品加工(學刊),2009(1):32-34
[19]龐雪風,胡傳榮,何東平,等.不同酶解程度牡丹籽蛋白與大豆分離蛋白功能特性的比較[J].中國油脂,2014(9):23-26

