低氧訓練通過HIF-1α - miR-122-5p-SREBP-1c調節肥胖大鼠肝臟脂代謝的機制研究
荊 文,李傳芬,馮連世,路瑛麗
?
低氧訓練通過HIF-1α - miR-122-5p-SREBP-1c調節肥胖大鼠肝臟脂代謝的機制研究
荊 文1,李傳芬2,馮連世3,路瑛麗3
1.山東師范大學 體育學院,山東 濟南 250014;2.濟南軍區總醫院 神經內科,山東 濟南 250031;3.國家體育總局體育科學研究所,北京 100061
目的:探討低氧訓練對肥胖大鼠肝臟中miR-122-5p及其上下游調節因子在轉錄水平表達的影響,并在細胞中驗證miR-122-5p的表達對下游脂代謝相關基因的調節。方法:雄性SD大鼠經10周高脂飲食誘導建立肥胖大鼠模型,適應性訓練后隨機分為常氧安靜組(N組)和低氧訓練組(H組)。4周后測量體重、體脂、血清脂類含量,利用實時熒光定量PCR檢測肝臟中miR-122-5p及上下游調節因子轉錄水平的相對表達。將大鼠正常肝細胞BRL-3A分為未轉染組(C組)、過表達miR-122-5p組(Up組)、抑制表達miR-122-5p組(Down組)和空載體組(Nc組),慢病毒轉染建立穩定轉染細胞系,利用實時熒光定量PCR檢測miR-122-5p及下游脂代謝調節因子轉錄水平的相對表達。結果:與N組相比,H組大鼠體重、體脂顯著降低(<0.01),血清脂類含量顯著改善(<0.05或<0.01),肝臟miR-122-5p及C/EBPα、SREBP-1c、FASN、ACC1 mRNA的相對表達水平顯著降低(<0.05或<0.01),HIF-1α、CPT1A mRNA的相對表達水平顯著升高(<0.05或<0.01)。在BRL-3A細胞中過表達或抑制表達miR-122-5p,導致SREBP-1c、FASN、ACC1 mRNA相對表達水平顯著升高或降低(<0.05或<0.01),CPT1A mRNA的相對表達水平顯著降低或升高(<0.05或<0.01)。結論:低氧訓練可能通過HIF-1α - miR-122-5p - SREBP-1c途徑調節肥胖大鼠肝臟脂代謝,低氧訓練誘導HIF-1α的表達升高,依次下調C/EBPα和miR-122-5p的表達,進而通過升高SREBP-1c、FASN、ACC1和降低CPT1A的表達,抑制肝臟中脂肪酸的合成,促進脂肪酸的氧化,改善肝臟脂類的代謝。
低氧訓練;miR-122-5p;肥胖;肝臟;脂代謝
超重和肥胖是由脂肪過量堆積引起的健康損傷,是脂肪肝、糖尿病和心腦血管疾病等多種慢性病的主要危險因素。低碳高脂的膳食結構、久坐不動的生活方式使得越來越多的人罹患肥胖癥,據2017年10月世界衛生組織報道[1],1975~2016年全球肥胖流行率增長近3倍。國家體育總局《2014年國民體質監測公報》顯示,超重與肥胖問題已經成為影響我國成年、老年人群體質的突出問題[2],而肥胖會引起肝臟脂質代謝異常,導致肝臟損傷[14]。超重和肥胖人群常用急慢性低氧暴露來降低體重,但不同的被試、不同的低氧程度和暴露時間減重效果不同[15]。以往的研究證實,低氧訓練能夠顯著降低肥胖人群的體重、體脂[3,6,14],改善血脂和肝臟脂類代謝[8,20]。
微小RNA(microRNA, miRNA)是一類僅有22 nt左右的內源性單鏈非編碼RNA,一般位于基因與基因之間、基因的內含子或外顯子區域,在進化上具有高度保守性[22],主要通過與其靶基因3′端非翻譯區互補結合,引起靶基因mRNA降解或阻止其翻譯[9]。miR-122是肝臟組織特異性miRNA,在肝臟中高表達,約占肝臟總miRNA的70%,參與肝臟脂質穩態的調節[17]。miR-122前體是由一條反向互補的單鏈形成的發夾結構,加工為成熟miR-122時,根據在前體中的位置分為兩條,位于5’端的命名為miR-122-5p,而位于3’端的命名為miR-122-3p。miR-122在調節肝臟功能中發揮著重要的作用,有研究表明,miR-122能夠調節膽固醇的生物合成[18]、脂肪酸合成和β-氧化[12]。
前期研究發現,低氧訓練能顯著降低肥胖大鼠肝臟中miR-122-5p的表達水平,但低氧訓練通過miR-122-5p調節肝臟脂代謝的分子機制還未完全清楚。因此,本研究擬以miR-122-5p為核心,研究低氧訓練對肥胖大鼠肝臟中miR-122-5p及其上游轉錄調節因子低氧誘導因子-1α(Hypoxia Inducible Factor-1α, HIF-1α)、CCAAT增強子結合蛋白α(CCAAT/enhancer binding proteinα,C/EBPα)、以及下游脂代謝調節因子固醇調節元件結合蛋白-1c(Sterol Regulatory Element Binding Protein-1c, SREBP-1c)、二脂酰甘油酰基轉移酶2(Diacylgycerol Acyltransferase 2, DGAT2)、脂肪酸合成酶(Fatty Acid Synthetase, FASN)、乙酰輔酶A羧化酶1(Acetyl-CoA Carboxylase 1, ACC1)和肉毒堿棕櫚酰基轉移酶1A(Carnitine Palmitoyl Transferase 1 A, CPT1A)表達的影響,并在大鼠正常肝細胞BRL-3A中過表達和抑制表達miR-122-5p,驗證miR-122-5p與其下游脂代謝相關基因表達的關系,探討miR-122-5p在低氧訓練中調節肝臟脂代謝的作用及機制,為低氧訓練應用于降低體重和體脂,改善由肥胖引起的代謝疾病等提供一定的理論依據。
1 材料與方法
1.1 動物實驗
1.1.1 實驗動物及分組
50只21天齡離乳雄性SD大鼠(購自北京維通利華實驗動物有限公司),普通飼料適應性喂養1周后,隨機分為兩組:普通飲食組10只,普通飼料(能量百分比:碳水化合物65%、脂肪15%、蛋白質20%)喂養;高脂飲食組40只,高脂飼料(能量百分比:碳水化合物35%、脂肪45%、蛋白質20%)喂養。分籠飼養,每籠5只,自由飲食,自然光照,室溫保持22 ℃左右,濕度保持40%~60%。10周后,從高脂飲食組挑選體重大于普通飲食組平均體重20%的大鼠作為肥胖組,共21只。
1.1.2 運動方案設計
常氧環境下肥胖組大鼠水平跑臺適應性訓練5天(訓練速度從20 m/min遞增到25 m/min,運動時間從20 min/天遞增到60 min/天)后,根據實驗大鼠適應性訓練情況,選取了16只大鼠隨機分為2組:常氧安靜組(N組)和低氧訓練組(H組,氧氣含量為13.6%),每組8只。H組用大鼠水平跑臺進行耐力訓練,訓練強度20 m/min,持續運動1 h/天、5 天/周、共4周[20]。
1.1.3 取材
H組大鼠最后一次訓練后恢復24 h,與N組一起取材。大鼠取材前禁食禁水12 h,稱重,按0.3 mL/100 g體重的劑量腹腔注射10%水合三氯乙醛溶液麻醉大鼠,測量鼻尖至肛門的距離作為體長,計算Lee′s index=體重1/3(g)/體長(cm);將大鼠固定于取材板上,打開腹腔,腹主動脈取血,分離血清-20 ℃保存待測;取肝右葉液氮速凍,-80 ℃保存待測;取腎周和附睪脂肪,在預冷的生理鹽水中漂洗去血,濾紙吸干水分,稱重,計算脂肪重和脂體比(脂肪重/體重×100%)[4]。
1.1.4 血清脂類含量測定
利用全自動生化分析儀檢測血清總膽固醇(Total Cholesterol, TC)、甘油三酯(Triglyceride, TG)、低密度脂蛋白膽固醇(Low Density Lipoprotein Cholesterol, LDL-C)和高密度脂蛋白膽固醇(HighDensity Lipoprotein Cholesterol, HDL-C)的含量。
1.1.5 實時熒光定量PCR
提取肝臟組織總RNA(動物組織總RNA提取試劑盒,Tiangen),瓊脂糖凝膠電泳檢查總RNA的質量,分別反轉錄合成miRNA和mRNA對應的cDNA(miRcute miRNA cDNA第一鏈合成試劑盒、TIANScript RT Kit,Tiangen),利用LightCycler480(Roche)進行實時熒光定量PCR反應(miRcute miRNA熒光定量檢測試劑盒SYBR Green、Talent熒光定量檢測試劑盒SYBR Green,Tiangen),分別以U6和β-actin作為內參檢測肝臟中miR-122-5p的相對表達水平,以及HIF-1α、C/EBPα、SREBP-1c、DGAT2、FASN、ACC1和CPT1AmRNA的相對表達,反應條件為95℃預變性2 min,PCR反應(94℃、10s,60℃、40s)40個循環。利用=2-△△Ct計算相對表達量。實驗所用引物由生工生物工程(上海)股份有限公司設計合成(表1)。
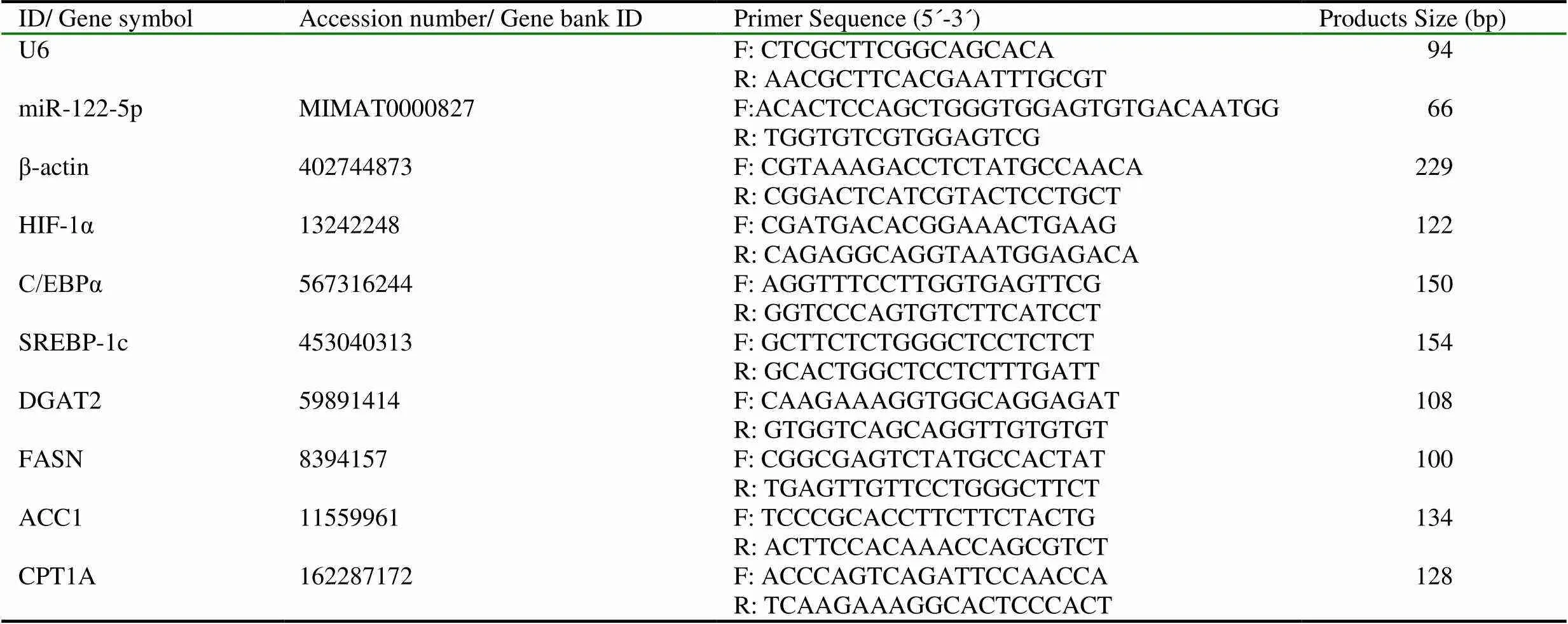
表1 實時熒光定量PCR引物
1.2 BRL-3A細胞實驗
1.2.1 細胞株及慢病毒載體構建
大鼠正常肝細胞BRL-3A購于廣州吉妮歐生物科技有限公司。miR-122-5p過表達和抑制表達慢病毒載體的構建和包裝由上海吉凱基因化學技術有限公司完成,滴度分別為4×108TU/mL和6×108TU/mL。
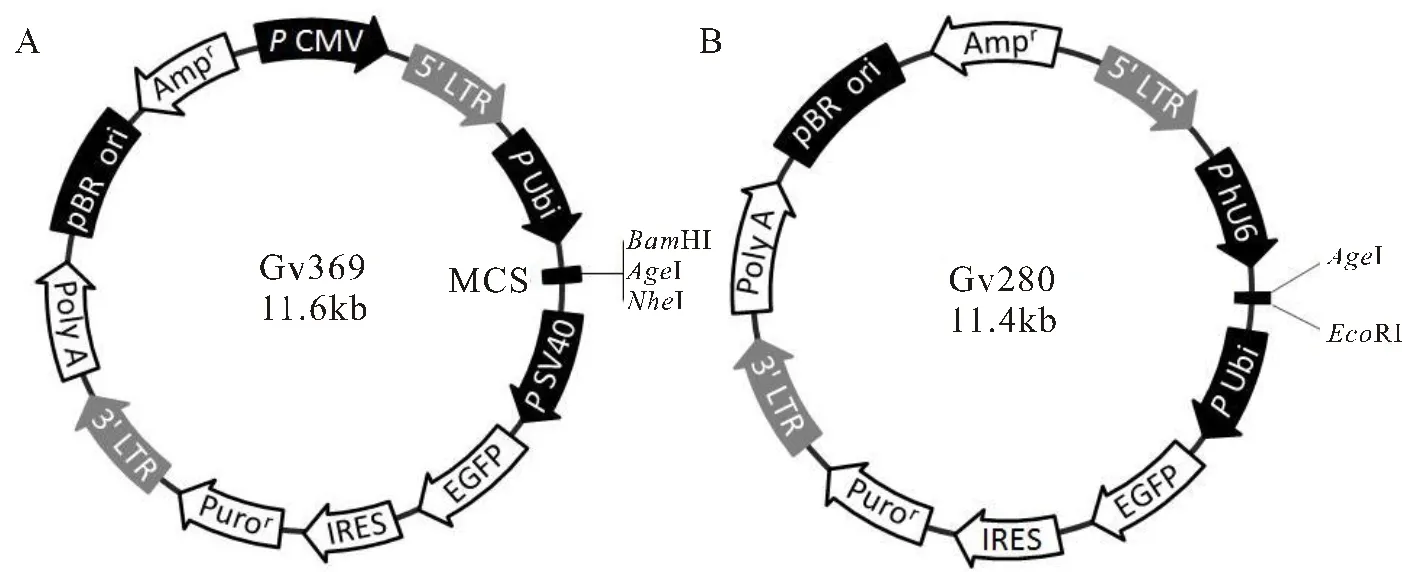
圖1 miR-122-5p過表達和抑制表達慢病毒載體
Figure 1. Overexpression or InhibitionExpression of miR-122-5p Lentivirus Vector
注:A為miR-122-5p過表達慢病毒載體,插入序列是通過化學合成的miR-122-5p前體。B為miR-122-5p抑制表達慢病毒載體,插入序列是miR-122-5p的互補序列。
1.2.2 建立穩定轉染細胞系
1. 鋪板:完全培養基調整BRL-3A細胞的密度為(3~5)×104個/mL,鋪板在96孔板(100μL/孔),在CO2培養箱中37 ℃培養24 h,至細胞的密度達到20%~30%。
2. 感染:BRL-3A細胞分為4組:C組(control組,未轉染慢病毒)、Up組(轉染miR-122-5p過表達慢病毒)、Down組(轉染miR-122-5p抑制表達慢病毒)、Nc組(negative control組,轉染空載體慢病毒)。根據預實驗確定MOI(multiplicity of infection)值為100,按公式(病毒體積=MOI×細胞數目/病毒滴度)計算加入病毒體積。
3. 培養:在CO2培養箱中37 ℃培養10 h后觀察細胞情況,并更換為新鮮完全培養基。
4. 建立穩轉細胞系:感染2~4天根據熒光觀察感染效率,建立穩定感染細胞系(圖2)。
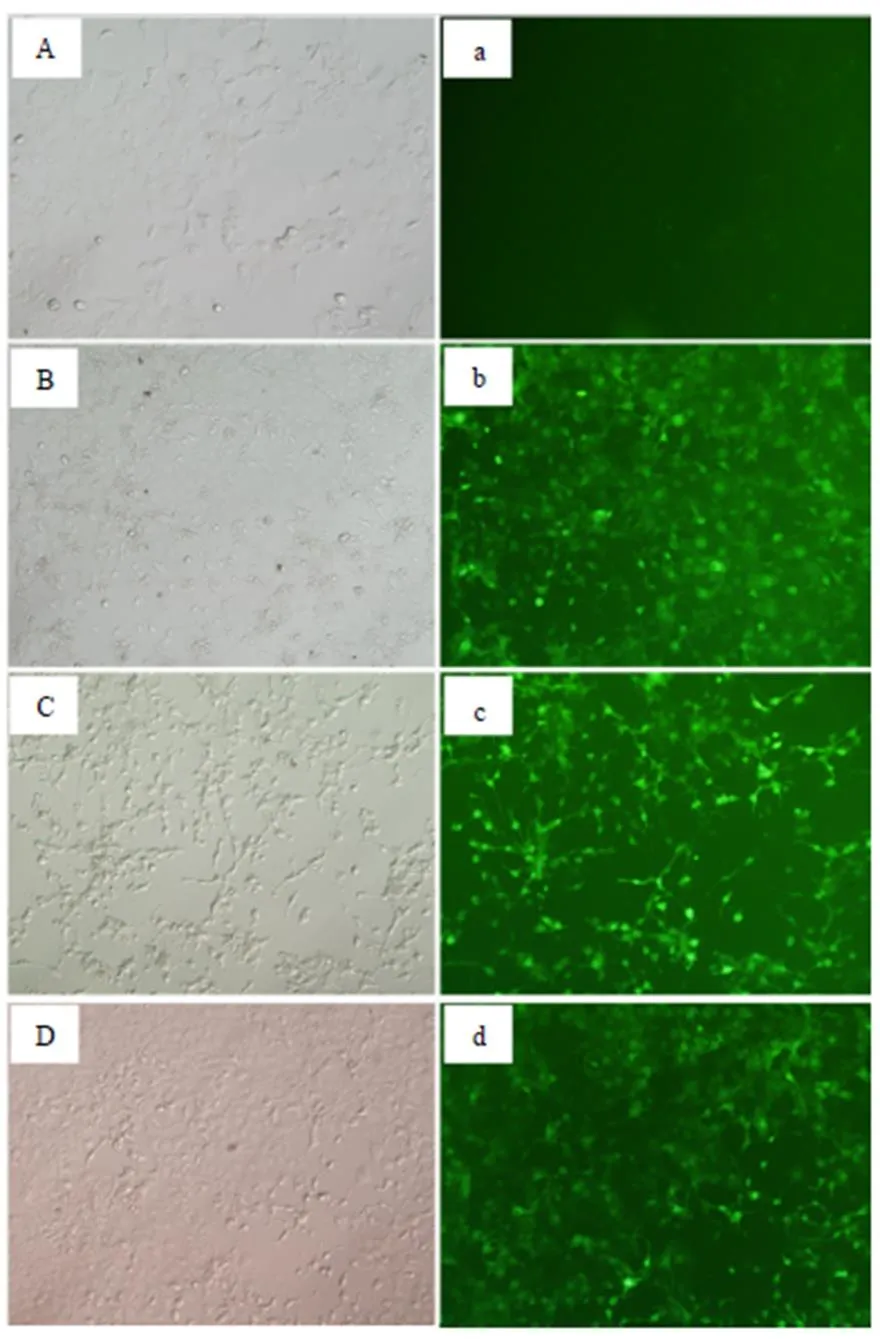
圖2 過表達和抑制表達miR-122-5p穩定轉染細胞系的建立
Figure 2. Establishment of Stable Transfection Cell Line of Overexpression and InhibitionExpression of miR-122-5p
注:A、B、C、D分別為C組、Up組、Down組和Nc組明視野圖,a、b、c、d分別為C組、Up組、Down組和Nc組熒光圖,200×。
1.2.3 實時熒光定量PCR
將C組、Up組、Down組和Nc組細胞復蘇,在CO2培養箱中37 ℃培養2~4天,至細胞密度達80%~90%。棄去原培養基,DMEM沖洗,Trizol法分別提取4組細胞總RNA,瓊脂糖凝膠電泳檢查總RNA質量,根據OD260的值計算RNA濃度(1OD=40μg/mL)。miR-122-5p的相對表達量檢測和相關基因轉錄水平的相對表達量檢測方法與動物實驗一致。
1.3 數據統計
2 結果
2.1 低氧訓練顯著降低肥胖大鼠體重和體脂
H組比N組大鼠的體重、Lee’s index、脂肪重均極顯著下降(<0.01),脂體比顯著降低(<0.05,圖3)。
Figure 3. Effects of Hypoxic Training on Morphological Indexes of Obese Rats
注:獨立樣本檢驗,*表示兩組間有顯著性差異(<0.05),**表示兩組間有極顯著性差異(<0.01),下同。
2.2 低氧訓練顯著改善肥胖大鼠血清脂類含量
低氧訓練顯著降低肥胖大鼠血清TC、TG、LDL-C含量(<0.05或<0.01),顯著升高HDL-C含量(<0.05,圖4)。
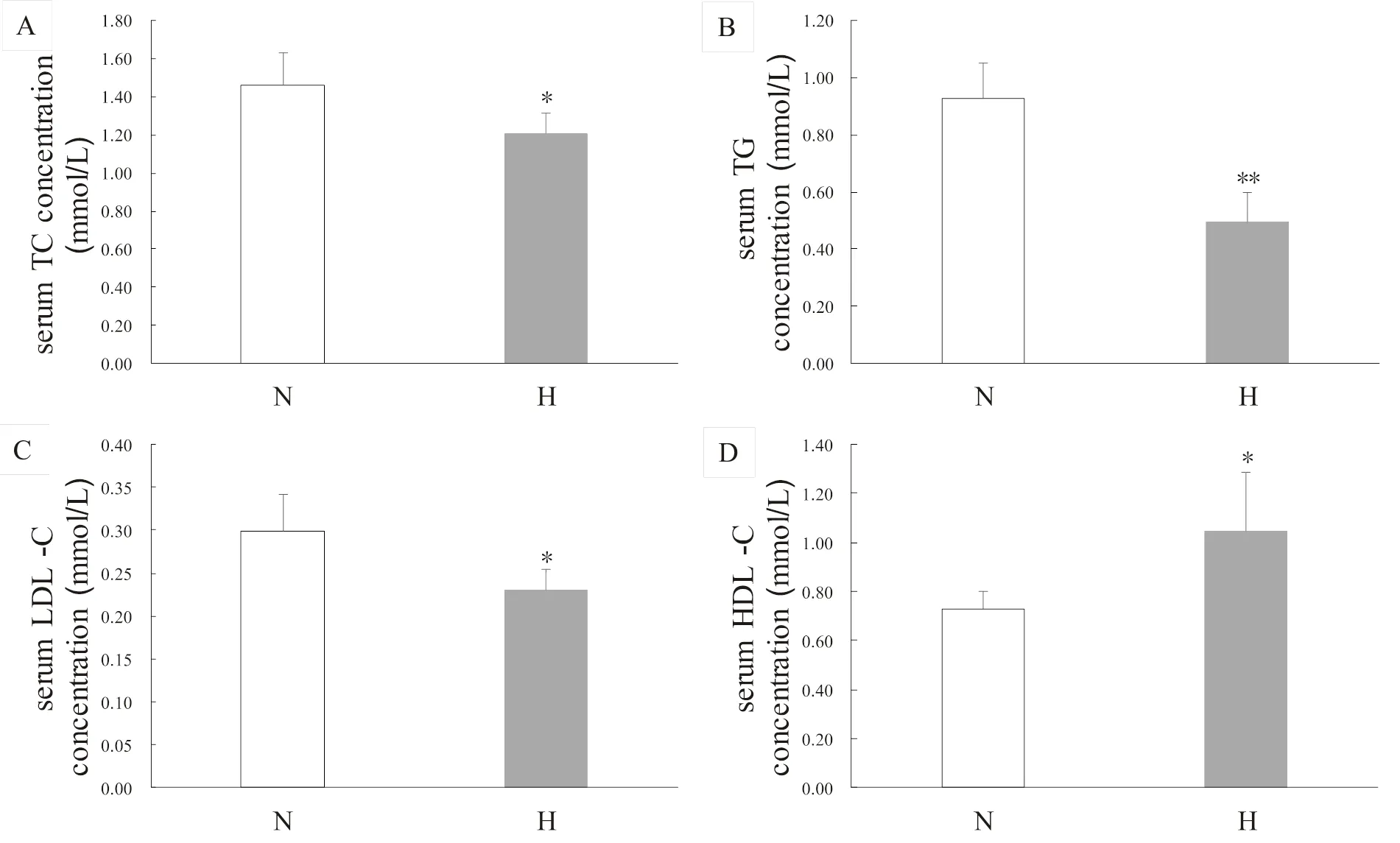
圖4 低氧訓練對肥胖大鼠血脂含量的影響
Figure 4. Effects of Hypoxic Training on Serum Lipids Concentration of Obese Rats
2.3 低氧訓練對肥胖大鼠肝臟miR-122-5p及脂代謝相關調節因子轉錄水平的影響
低氧訓練顯著下調了miR-122-5p及C/EBPα、SREBP-1c、FASN、ACC1 mRNA相對表達水平,顯著上調了HIF-1α、CPT1α mRNA的相對表達水平(<0.05或<0.01),DGAT2表達下調但無顯著差異(>0.05,圖5)。
2.4 miR-122-5p過表達和抑制表達對BRL-3A細胞脂代謝相關調節因子轉錄水平的影響
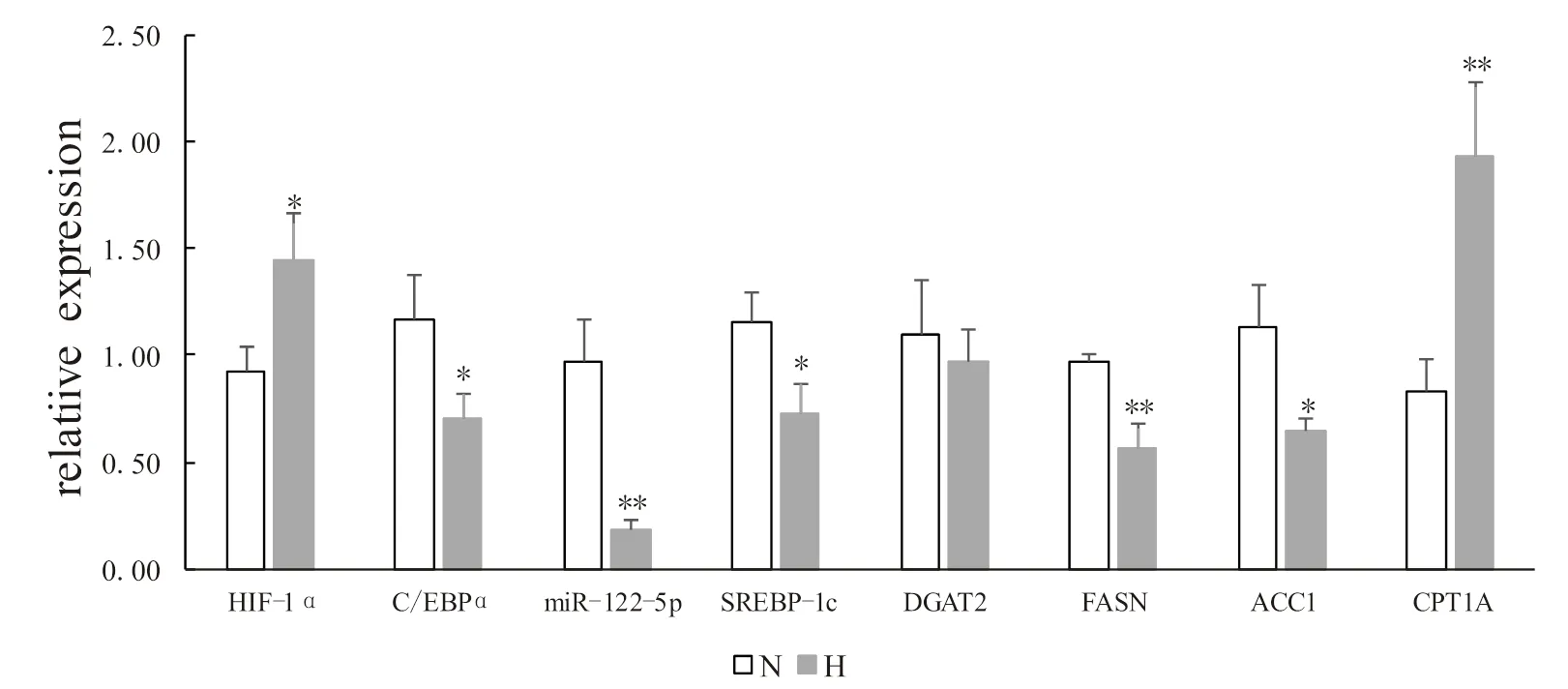
圖5 低氧訓練對miR-122-5p及脂代謝相關調節因子轉錄水平的影響
Figure5. Effects of HypoxicTraining on Transcription Level of miR-122-5p and Lipid Metabolism Related Regulators
與C組相比,Up組miR-122-5p相對表達水平極顯著升高(<0.01),Down組極顯著降低(<0.01),Nc組無顯著變化(>0.05,圖6)。
與C組相比,Up組SREBP-1c、FASN、ACC1 mRNA相對表達水平顯著升高(<0.05或<0.01),CPT1A mRNA相對表達水平顯著降低(<0.05);Down組SREBP-1c、FASN、ACC1 mRNA相對表達水平顯著降低(<0.05或<0.01),CPT1A mRNA相對表達水平顯著升高(<0.01);Nc組各調節因子轉錄水平均無顯著變化(>0.05);DGAT2在Up組和Down組分別表現出升高和降低的趨勢,但無顯著差異(>0.05,圖6)。
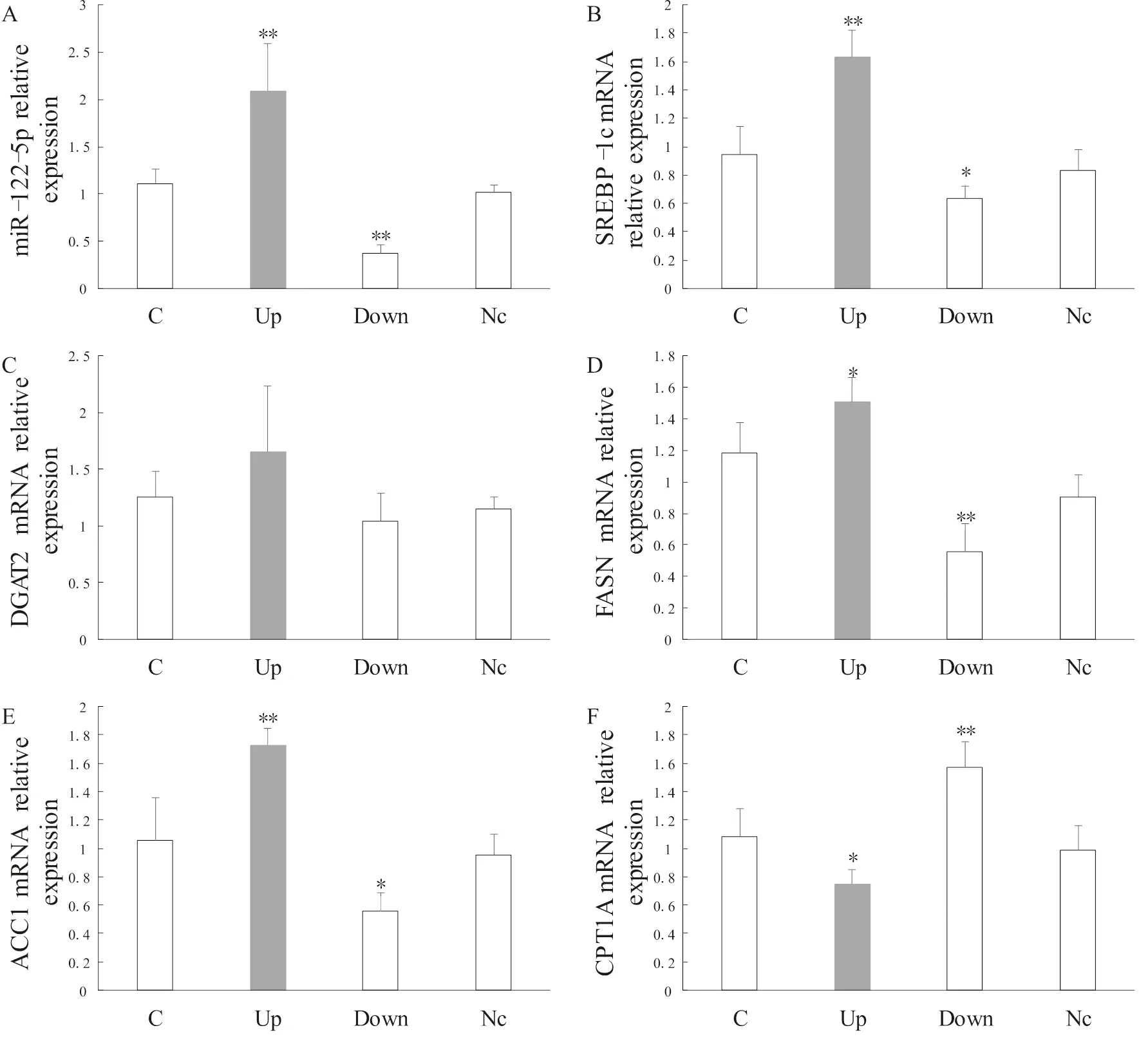
圖6 BRL-3A細胞中miR-122-5p及脂代謝相關調節因子轉錄水平的相對表達
Figure6. Relative Expression of miR-122-5p and Lipid MetabolismRelated Regulatory Factors in BRL-3A Cells
注:單因素方差分析,*表示該組與C組相比有顯著性差異(<0.05),**表示該組與C組相比有極顯著性差異(<0.01)。
3 分析與討論
3.1 低氧訓練刺激肥胖大鼠肝臟HIF-1α表達升高
肥胖及由其引起的慢性相關疾病已嚴重威脅人類健康,低氧訓練是降低體重和體脂[5,6]、改善血脂含量、調節肝臟脂代謝的有效方法[8,11,16,20]。低氧訓練會引起機體血液重新分配,使肝臟處于相對缺血缺氧狀態,HIF-1α是對氧氣敏感的轉錄因子,調控低氧誘導基因的表達,協調細胞對低氧環境的反應。有研究表明,游離脂肪酸產生的脂肪毒性是導致非酒精性脂肪性肝炎的重要病理機制,上調HIF-1α是降低非酒精性脂肪肝的一種可能策略[25]。而低氧訓練能顯著上調肥胖大鼠肝臟中HIF-1αmRNA的表達水平,表明機體為應對低氧和訓練的雙重刺激,產生了深刻的適應性反應[7],HIF-1αmRNA的表達與本研究結果一致,提示低氧訓練可能通過上調HIF-1α的表達應對肝臟低氧的刺激,降低脂質對肝臟的損傷。
3.2 高表達HIF-1α下調了其下游效應因子C/EBPα的表達
低氧訓練上調肝臟中HIF-1αmRNA的表達水平,引起C/EBPα的表達水平下降。研究表明,缺氧使膀胱癌細胞高表達HIF-1α蛋白,導致C/EBPα的mRNA和蛋白表達降低;而抑制HIF-1α的表達可以增強C/EBPα的表達,提示C/EBPα可能是HIF-1α的下游效應因子[26],本研究結果進一步證明高表達的HIF-1α下調了C/EBPα的表達。
3.3 低氧訓練引起的C/EBPα表達水平的降低可能是miR-122-5p表達下降的主要原因
表達下調的C/EBPα可能會導致肝臟miR-122-5p的表達降低。有研究表明,miR-122啟動子區含有C/EBPα的多個結合位點,能在體內外互相結合,抑制C/EBPα的表達,能顯著降低miR-122的啟動子活性,減少內源性miR-122的表達水平[27]。白介素-6和腫瘤壞死因子-α通過下調轉錄因子C/EBPα,而阻斷C/EBPα介導miR-122的轉錄,抑制miR-122的表達[19],該研究進一步證明了C/EBPα對miR-122表達的調節作用。
3.4 miR-122-5p通過調節SREBP-1c的表達影響脂肪酸和膽固醇的代謝
本研究中低氧訓練導致肥胖大鼠肝臟中miR-122-5p的表達降低可能是低氧訓練調節肝臟脂代謝的重要途徑。miR-122是肝臟中含量最多的miRNA,已有研究證明,miR-122在調節血漿膽固醇[18]和肝臟脂類代謝中發揮重要作用。在正常小鼠中抑制miR-122的表達,導致血漿膽固醇含量顯著降低,肝臟脂肪酸和膽固醇合成速率顯著下調,增加肝臟脂肪酸氧化。在飲食誘導的小鼠肥胖模型中,下調miR-122的表達水平,同樣能顯著降低血漿膽固醇含量,減少脂肪的生成,改善肝臟脂肪變性[13]。
SREBP是體內膽固醇和脂肪酸代謝的重要核轉錄調節因子,存在3種異構體:SREBP-1a、1c和2[10],肝臟和脂肪細胞中高表達SREBP-1c,而SREBP-1a、1c與脂肪酸代謝相關酶的表達相關[24],SREBP-1c可以通過影響FASN和ACC1的表達對機體脂肪合成進行調節,3周低氧訓練能夠較好的抑制肥胖大鼠肝臟SREBP-1c mRNA和蛋白表達[5],從而通過改變SREBP-1c的表達調節脂肪酸的代謝。
低氧訓練可能通過下調肝臟中miR-122-5p的表達水平間接抑制SREBP-1c的表達,發揮減少肝臟脂肪酸合成的作用。在體內抑制miR-122的功能可降低血清膽固醇和脂肪酸水平。體外抑制miR-122的表達,使細胞因子信號抑制因子3(suppressor of cytokine signaling 3, SOCS3)表達降低時,SREBP1表達下調;在抑制miR-122表達的細胞中過表達SOCS3,可使SREBP1的表達恢復,表明miR-122通過改變SOCS3的表達間接調節SREBP1的表達[23]。也有研究證明,抑制miR-122的表達可以降低SREBP1和SREBP2的水平[21],miR-122和SREBP-1c之間有相互促進作用[28]。
綜上所述,低氧訓練引起的缺氧刺激上調了肝臟HIF-1α的表達水平,而C/EBPα是HIF-1α的下游效應因子,高表達的HIF-1α降低了C/EBPα的表達;C/EBPα與miR-122-5p具有共表達的特點,低表達的C/EBPα抑制了miR-122-5p的表達;下調的miR-122-5p通過降低SREBP-1c、FASN、ACC1的表達,升高CPT1A的表達,調節肝臟中脂肪酸的合成與氧化。因此,HIF-1α-miR-122-5p-SREBP-1c途徑可能在低氧訓練調節肥胖大鼠肝臟脂類代謝過程中發揮重要作用。
4 結論
低氧訓練可以有效地降低肥胖大鼠體重和體脂,改善血清脂類含量,調節肝臟中脂類的代謝。低氧訓練可能通過HIF-1α-miR-122-5p-SREBP-1c途徑調節肝臟脂代謝。低氧訓練上調肝臟HIF-1α的表達水平,降低C/EBPα的表達,抑制miR-122-5p的表達,間接引起SREBP-1c、FASN、ACC1的表達降低,上調了CPT1A的表達,導致肝臟中脂肪酸合成減少,脂肪酸氧化增加,減弱肝臟遭受脂質的損傷,起到保護肝臟的作用。
[1] 肥胖和超重[EB/OL].http://www.who.int/mediacentre/factsheets/ fs311/ zh/.
[2] 2014年國民體質監測公報 [EB/OL]. http://www. sport.gov.cn/ n16/n1077/ n1227/7328132.html.
[3] 馮連世, 張漓, 高炳宏, 等. 不同環境下有氧運動對超重和肥胖青少年體重與體脂含量的影響[J]. 體育科學, 2013, 33(11): 58-65.
[4] 荊文. 低氧訓練對高脂飲食大鼠肝臟microRNA表達及脂代謝的調節研究[D]. 上海: 上海體育學院, 2014: 27.
[5] 王金昊, 路瑛麗, 馮連世, 等. 高住高練對肥胖大鼠肝臟SREBP-1c表達的影響[J].中國運動醫學雜志, 2012, 31(07): 590-595,622.
[6] 王茹, 蘇利強, 楊欽, 等. 低氧訓練對肥胖青少年減控體重的影響與血鎂濃度相關[J]. 體育科學, 2016, 36(9): 28-35,47.
[7] 徐建方, 馮連世, 路瑛麗, 等. 不同模式低氧耐力訓練對大鼠肝組織HIF-1α、HO-1 mRNA 表達的影響[J]. 中國體育科技, 2011, 47(1): 126-129.
[8] 朱磊,路瑛麗, 馮連世. 低氧訓練誘導miR-27/PPARγ調控肥胖大鼠肝臟脂肪酸代謝變化的研究[J]. 中國體育科技, 2018, 54(1): 115-122.
[9] AMBROS V. The functions of animal microRNAs [J]. Nature, 2004, 431(7006): 350–355.
[10]BROWN M S, GOLDSTEIN J L. The SREBP pathway: regulat-ion of cholesterol metabolism by proteolysis of membrane-bound transcription factor [J]. Cell, 1997, 89 (3): 331-340.
[11]CAMACHO-CARDENOSA A,CAMACHO-CARDENOSA M, BURTSCHER M,. High-intensity interval training in normo baric hypoxia leads to greater body fat loss in overweight/ obese women than high-intensity interval training in normoxia [J]. Front Physiol, 2018, 9: 60.
[12]ELHANATI S, BEN-HAMO R, KANFI Y,. Reciprocal regulation between SIRT6 and miR-122 controls liver metabol-ism and predicts hepatocarcinoma prognosis [J]. Cell Rep, 2016, 14(2): 234-242.
[13]ESAU C, DAVIS S, MURRAY S F,. miR-122 regulation of lipid metabolism revealed by in vivo antisense targeting [J]. Cell Metab, 2006, 3(2): 87–98.
[14]GOODMAN Z D. The impact of obesity on liver histology [J]. Clin Liver Dis, 2014, 18(1): 33-40.
[15]HOBBINS L, HUNTER S, GAOUA N,. Normobaric hypoxic conditioning to maximize weight loss and ameliorate cardio-metabolic health in obese populations: a systematic review [J]. Am J Physiol Regul Integr Comp Physiol, 2017, 313(3): R251-R264.
[16]HORTON J D, SHIMANO H. Disruption of LDL receptor gene in transgenic SREBP-1a mice unmasks hyperlipidemia resulting from production of lipid-rich VLDL [J]. J Clin Invest, 1999, 103 (7): 1067-1076.
[17]JOPLING C. Liver-specific microRNA-122: Biogenesis and function [J]. RNA Biol, 2012, 9: 137–142.
[18]Krützfeldt J, RAJEWSKY N, BRAICH R,. Silencing of micro RNAs in vivo with ‘antagomirs’ [J]. Nature, 2005, 438 (7068): 685–689.
[19]LI C, DENG M, HU J,. Chronic inflammation contributes to the development of hepatocellular carcinoma by decreasing miR-122 levels [J]. Oncotarget, 2016, 7(13): 17021-17034.
[20]LU Y L, JING W, FENG L S,. Effects of hypoxic exercise training on microRNA expression and lipid metabolism in obese rat livers [J]. J Zhejiang Univ Sci B, 2014, 15(9): 820-829.
[21]MENON B, SINDEN J, FRANZO-ROMAIN M,. Regulation of LH receptor mRNA binding protein by miR-122 in rat ovaries [J]. Endocrinology, 2013,154(12): 4826–4834.
[22]RODRIGUEZ A, Griffiths J S, Ashurst J L,. Identification of mammalian miRNA host genes and transcription units [J]. Genome Res, 2004, 14 (10A):1902-1910.
[23]Shibata C, Kishikawa T, Otsuka M,. Inhibition of microRNA122 decreases SREBP1 expression by modulating suppressor of cytokine signaling 3 expression [J]. Biochem Biophys Res Commun, 2013, 438(1): 230-235.
[24]Yang Q, Huang G, Tian Q,. "Living High-Training Low" improved weight loss and glucagon-like peptide-1 level in a 4-week weight loss program in adolescents with obesity: A pilot study [J]. Medicine (Baltimore), 2018, 97(8): e9943.
[25]Yoo W, Noh K H, Ahn J H,. HIF-1α expression as a protective strategy of HepG2 cells against fatty acid-induced toxicity [J]. J Cell Biochem, 2014, 115(6):1147-1158.
[26]Xue M, Li X, Chen W. Hypoxia regulates the expression and localization of CCAAT/enhancer binding protein α by hypoxia inducible factor-1α in bladder transitional carcinoma cells [J]. Mol Med Rep, 2015, 12(2): 2121-2127.
[27]Zeng C, Wang R, Li D,. A novel GSK-3 beta-C/EBP alpha-miR-122-insulin-like growth factor 1 receptor regulatory circuitry in human hepatocellular carcinoma [J]. Hepatology, 2010, 52(5):1702-1712.
[28]Zhai X, Cheng F, Ji L,. Leptin reduces microRNA-122 level in hepatic stellate cells in vitro and in vivo [J]. Mol Immunol, 2017, 92: 68-75.
The Mechanism of Hypoxic Training RegulatingLipid Metabolism by HIF-1α - miR-122-5p - SREBP-1c in Obese Rat Liver
JING Wen1, LI Chuan-fen2, FENG Lian-shi3, LU Ying-li3
1. Shandong Normal University, Jinan 250014, China; 2. Jinan Military General Hospital, Jinan 250031, China; 3. China Institute of Sport Science, Beijing 100061, China.
Objective: To investigate the effects of hypoxic training on the expression of miR-122-5p and the transcriptional levels of lipid metabolism regulatory factors in the liver of obese rats, and to verify the role of miR-122-5p on the expression of lipid metabolism related genes in vitro, to investigate the mechanism of miR-122-5p in regulating liver lipid metabolism during hypoxic training. Methods: Male Sprague-Dawley (SD) rats were induced to establish obese rat model by high-fat diet for 10 weeks. After adaptive training, obese rats were randomly divided into two groups: normoxic sedentary group (N group) and hypoxic training group (H group). 4 weeks later, body weight, body fat and serum lipid content of rats were measured, and the relative expression of miR-122-5p and transcription level of lipid metabolism important regulatory factors in liver were detected by real-time quantitative PCR. The BRL-3A cells were divided into four groups: untransfected group (C group), overexpression miR-122-5p group (Up group), suppressive expression miR-122-5p group (Down group) and empty vector group (Nc group). The cells were transfected with lentivirus to establish stable transfection cell lines. Real-time quantitative PCR was used to detect the relative expression levels of miR-122-5p and lipid metabolism regulating factors. Results: Compared with N group, the body weight and body fat of rats in H group decreased significantly (<0.01), and the serum lipid concentration significantly improved (<0.05 or<0.01). The relative expression levels of miR-122-5p and C/EBPα, SREBP-1c, FASN, ACC1 mRNA were significantly down-regulated (<0.05 or<0.01), and the relative expression levels of HIF-1α and CPT1A mRNA were significantly up-regulated (<0.05 or<0.01) in H group. Overexpression or inhibition of miR-122-5p in BRL-3A cell resulted in a significant increase or decrease in the relative expression levels of SREBP-1c, FASN, ACC1 mRNA (<0.05 or<0.01), while the relative expression level of CPT1A mRNA was significantly decreased or increased (<0.05 or<0.01). Conclusions: Hypoxic training may regulate lipid metabolism by HIF-1α - miR-122-5p - SREBP-1c in obese rat liver. Hypoxic training increased the expression of HIF-1α in the liver of obese rats, and down-regulated the expression of C/EBPα and miR-122-5p in turn, then inhibited the synthesis of fatty acids by decreasing the expression of SREBP-1c, FASN and ACC1, and promoted the oxidation of fatty acids by increasing the expression of CPT1A, to play a role in regulating lipid metabolism in the liver.
1002-9826(2018)03-0060-08
10.16470/j.csst.201803008
G804.7
A
2018-03-12;
2018-05-08
國家自然科學基金資助項目(31471139);山東省自然科學基金青年基金資助項目(ZR2014CQ026)。
荊文,男,講師,博士,主要研究方向為低氧訓練對脂代謝的調節機制,E-mail:jingwenjw@163.com。
馮連世,男,研究員,博士生導師,主要研究方向為高原訓練與低氧訓練的理論與方法、運動員控體重的理論與方法, E-mail:fengls98@126.com。

