磁共振擴散張量成像在乳腺癌診斷中的應用
付澤鴻,吳西子,徐紅芳,王珺燕
江漢大學附屬醫院(武漢市第六醫院)放射科,武漢430015
近年來,乳腺癌的發病率不斷增加,在中國較多大城市女性惡性腫瘤中居首位,其發病機制復雜,多與月經、肥胖、遺傳等有關[1],嚴重影響患者的生活質量,甚至導致患者死亡。隨著醫療水平和女性健康意識的提高,乳腺癌的早期檢出率不斷升高,其5年生存率約90%左右[2],因此乳腺癌患者的早期診斷,對確定手術方案和改善預后有重要的作用。擴散張量成像(diffusion tensor imaging,DTⅠ)是一種新型磁共振成像(magnetic resonance imaging,MRⅠ)方式,以擴散加權成像(diffusion weighted imaging,DWⅠ)為基礎,除了可以準確測定病變平均擴散能力外,還可以測定各向異性指數(fractional anisotropy,FA),提供量化數據,提高MRⅠ對良、惡性病變的診斷價值[3-4],且DTⅠ檢查無輻射和創傷,安全性高。目前中國關于DTⅠ診斷乳腺癌的相關報道尚少,因此本研究對116例經DTⅠ檢查的乳腺病變患者的相關資料進行回顧性分析,探討DTⅠ對乳腺癌的診斷價值,現報道如下。
1 資料與方法
1.1 一般資料
收集2015年1月至2017年6月武漢市第六醫院收治的116例乳腺病變患者的病歷資料。所有患者均經病理組織學檢查證實存在乳腺病變,均接受MRⅠ常規平掃、動態增強掃描和DTⅠ檢查,影像學資料完整;排除肝腎功能不全,既往有乳腺手術、放化療史,合并其他惡性腫瘤,影像圖片質量差難以評估及病歷資料不完整的患者。116例患者均為女性,年齡為18~70歲,平均為(45.83±4.16)歲;絕經前患者83例,絕經后患者33例;組織類型:乳腺良性病變62例(纖維腺瘤28例、纖維囊性病變14例、腺病17例、硬化性腺病3例),乳腺惡性病變54例(浸潤性導管癌37例、導管內原位癌17例)。
1.2 檢查方法
選擇德國西門子1.5 T MRⅠ掃描儀,4通道雙側乳腺矩陣線圈。頭先進,俯臥位,雙乳自然懸垂在矩陣線圈空洞內,經仔細檢查確認乳腺均在線圈內。先行MRⅠ常規掃描,包括雙側乳房、腺體,相關序列參數:①T2WⅠ序列,橫軸位快速自旋回波序列,脈沖序列重復時間(pulse sequence repetition time,TR)/回波時間(echo time,TE)5500 ms/58 ms,掃描野(scanner of field,FOV)320 mm×320 mm,矩陣314×320,層間隔/層厚=0 mm/6 mm。②動態增強掃描序列,選擇T1加權快速擾相位梯度回波序列,橫軸位圖像,TR/TE=4.2 ms/1.2 ms,FOV 320 mm×320 mm,矩陣446×340,層厚=0.9 mm。對比劑選擇二乙烯五胺乙酸釓(gadolinium diethylene triaminepenta acetate,GD-DTPA)0.1 mmol/kg,于手背部淺靜脈預留留置針注射。該序列包括6次重復掃描,對比劑注射前掃描1次,之后間隔0.5 min行對比劑推注,進行5次重復掃描。③DTⅠ序列,橫軸位平面回波序列,TR/TE=6900 ms/90 ms,FOV 380 mm×285 mm,矩陣145×190,層間隔/層厚=0 mm/5 mm,b值選擇0、1000 s/mm2。
1.3 圖像分析
MRⅠ相關數據上傳至Syngo工作站,由2名資深影像科醫師單獨閱片。依據T2WⅠ、增強掃描圖像明確病灶界限、中心層面,選擇病變部位和對側正常腺體為比較對象,感興趣區(region of interest,ROⅠ)勾畫必須避開脂肪、壞死和液化等區域,且RO(Ⅰ順著病灶邊緣內側勾畫)比病變范圍稍小,系統自動計算平均擴散程度(mean diffusivity,MD)、FA、本征值λ1。均測量3次,取均值。
1.4 統計學方法
采用SPSS 20.0統計軟件分析數據,計量資料以均數±標準差(±s)表示,病灶與自身健側腺體組織的DTⅠ相關參數比較采用配對t檢驗,良、惡性病灶間比較采用獨立樣本t檢驗,繪制ROC曲線,P<0.05為差異有統計學意義。
2 結果
2.1 乳腺癌的MRI表現
54例乳腺癌患者中,37例浸潤性導管癌患者行MRⅠ常規掃描,顯示:病灶內稍長T2信號腫塊影,形態不規則;動態增強掃描顯示:星芒狀或不規則異常強化,部分顯示放射狀毛刺,邊緣粗糙、不平整;腫瘤有浸潤性,腫塊內部不均勻或環形強化27例,均勻強化10例;增強后廓清型強化30例,平臺型強化7例。17例導管內原位癌患者行MRⅠ掃描,顯示:病灶內斑片狀強化14例,腫塊型強化3例;廓清型8例,平臺型6例,漸進型3例。
2.2 DTI參數的情況
2.2.1 乳腺癌組織與自身健側腺體組織 乳腺癌組織的MD、FA、λ1值均明顯低于健側腺體組織,差異均有統計學意義(P<0.01)。(表1)
表1 乳腺癌組織與自身健側腺體組織的MD、FA、λ 1比較(±s)
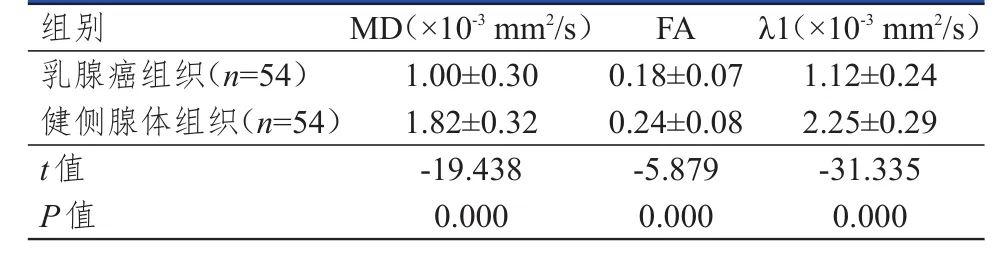
表1 乳腺癌組織與自身健側腺體組織的MD、FA、λ 1比較(±s)
組別乳腺癌組織(n=54)健側腺體組織(n=54)t值P值MD(×10-3mm2/s)1.00±0.30 1.82±0.32-19.438 0.000 FA 0.18±0.07 0.24±0.08-5.879 0.000 λ1(×10-3mm2/s)1.12±0.24 2.25±0.29-31.335 0.000
2.2.2 良性病變組織與自身健側腺體組織 乳腺良性病變組織的MD、λ1值均明顯低于健側腺體組織,差異均有統計學意義(P<0.01),而乳腺良性病變組織與健側腺體組織的FA值比較,差異無統計學意義(P>0.05)。(表2)
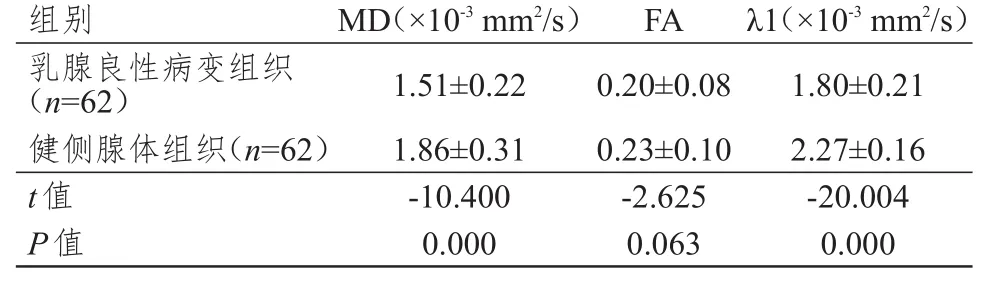
表2 乳腺良性-病變組織與自身健側腺體組織的MD、FA、λ1比較(x± s)
2.2.3 乳腺癌組織與乳腺良性病變組織 乳腺癌組織的MD、λ1值均明顯低于乳腺良性病變組織,差異均有統計學意義(P<0.01);而乳腺癌組織與乳腺良性病變組織的FA值比較,差異無統計學意義(P>0.05)。(表3)
2.3 ROC曲線分析
ROC曲線顯示,MD值對乳腺良、惡性病變鑒別的曲線下面積(area under curve,AUC)為0.945,FA值的AUC為0.640,λ1值的AUC為0.988。以MD值1.017×10-3mm2/s為臨界值,其診斷乳腺癌與乳腺良性病變的敏感度為83.50%,特異度為91.20%;以FA值0.190為臨界值,其診斷的敏感度為45.00%,特異度為80.00%;以λ1值1.250×10-3mm2/s為臨界值,其診斷的敏感度為100%,特異度為95.80%。(圖 1)
2.4 典型病例分析
患者女,35歲,病理確診為乳腺浸潤性導管癌,MRⅠ圖像可見右側乳腺內團塊影,MD值有所下降(圖2A);與對側腺體組織比較,患側FA值較低(圖2B、2D);增強掃描后強化明顯(圖2C)。
3 討論
MRⅠ動態增強掃描、DWⅠ成像在臨床應用較多[5-7],但常規DWⅠ成像僅反映體內水分子擴散能力,不能測定擴散的各向異性。DTⅠ是在DWⅠ基礎上發展而來,可測定水分子擴散方向、各向異性和量級等情況,不同乳腺組織的水分子擴散特點對乳腺病變性質的判斷有重要的價值,且DTⅠ在乳腺癌新輔助化療效果評估中也有所應用[8]。
DTⅠ主要包括MD、FA、本征值三大指標,其中MD值相當于DWⅠ的表觀擴散系數(apparent diffusion coefficient,ADC),主要反映水分子的整體擴散水平和阻力,與擴散范圍有密切的關系,與擴散方向無關。相關研究發現,b=1000 mm2/s時可提供最佳的信噪比,因此本研究中b值選擇1000 mm2/s[9]。Partridge等[10]研究表明,乳腺惡性病變的MD值低于良性病變,與本研究結果一致,提示MD值在判斷乳腺病變性質上有一定的作用。FA是組織內水分子擴散各向異性成分和整體擴散張量的比值,范圍為0~1,0、1分別表示最大各向同性、最大各向異性。Cakir等[11]研究發現,FA值與b值無關。本研究結果顯示,乳腺癌組織的FA值明顯低于自身健側腺體組織,而乳腺良性病變組織的FA值與自身健側腺體組織、乳腺癌組織比較,差異均無統計學意義(P>0.05),這與Baltzer等[12]的研究結果一致,認為FA值可有效鑒別惡性病變與正常腺體組織,而對乳腺良、惡性病變的鑒別價值不大。本征值包括λ1、λ2、λ3等,Eyal等[13]的研究發現,λ1對乳腺腫物良、惡性診斷鑒別的敏感度(95.6%)、特異度(97.7%)最高。因此本研究主要選擇λ1值進行觀察,結果顯示乳腺良、惡性病變組織的λ1值均明顯低于健側腺體組織,且乳腺癌組織的λ1值明顯低于良性病變組織,這與司麗芳等[14]的研究結果一致。申云霞等[15]的研究發現,ADC、FA值對鑒別乳腺癌與健側腺體組織有重要的作用,而良性病灶與健側腺體組織的FA值無明顯差異,認為FA值對判斷乳腺良性病變的價值不高,必須聯合ADC等參數共同判斷乳腺性質。本研究分析ROC曲線中DTⅠ不同參數鑒別診斷乳腺良、惡性病變的敏感度、特異度,結果顯示λ1值的診斷敏感度、特異度最高,分別為100%、95.80%,MD值次之,分別為83.50%、91.20%,而FA值最低,分別為45.00%、80.00%,這與司麗芳等[14]的研究結果相似。可見λ1與MD聯合診斷乳腺癌的價值較大。
綜上所述,DTⅠ的MD、λ1等參數檢測對乳腺癌診斷的敏感度、特異度較高,可作為鑒別乳腺病變性質的重要手段。但本研究也存在明顯不足:未細分病灶類型,缺少進一步分析;未涉及絕經前避孕藥物口服治療或絕經后激素替代治療對DTⅠ相關參數的影響,這些需以后通過大樣本病例、多中心研究進一步分析。
[1]張柏林,吳金其,鄭榮壽,等.女性乳腺癌發病危險因素的病例-對照研究[J].癌癥進展,2017,15(4):395-398.
[2]吳杰,劉翠蘭(綜述),敬宗林(審校).擴散成像技術在乳腺癌診斷中的研究進展[J].實用腫瘤學雜志,2016,30(6):563-567.
[3]安超(綜述),婁明武(審校).磁共振擴散張量成像在乳腺腫物中的研究[J].實用放射學雜志,2015,31(6):1029-1031;1036.
[4]馬智軍,蔣瑞生,馮強,等.擴散張量成像各向異性參數對乳腺惡性腫瘤的鑒別診斷價值[J].中華放射學雜志,2014,48(3):180-183.
[5]張海燕,汪秀玲.磁共振動態增強及擴散加權成像在乳腺癌中的應用[J].中國CT和MRⅠ雜志,2014,12(7):114-117.
[6]周紅,陳東.乳腺癌功能磁共振成像發展現狀[J].中國臨床醫學影像雜志,2015,26(1):47-49.
[7]董永興,孫鵬飛.乳腺癌診斷和療效評價的MRⅠ研究進展[J].中國CT和MRⅠ雜志,2014,12(2):117-120.
[8]劉亞婷,范光明,黃曌殊,等.擴散張量成像對浸潤性乳腺癌新輔助化療療效評估[J].貴州醫科大學學報,2016,41(7):840-843.
[9]Partridge SC,Murthy RS,Ziadloo A,et al.Diffusion tensor magnetic resonance imaging of the normal breast[J].Magn ResonⅠmaging,2010,28(3):320-328.
[10]Partridge SC,Ziadloo A,Murthy R,et al.Diffusion tensor MRⅠ:preliminary anisotropy measures and mapping of breast tumors[J].J Magn ResonⅠmaging,2010,31(2):339-347.
[11]Cakir O,Arslan A,Ⅰnan N,et al.Comparison of the diagnostic performances of diffusion parameters indiffusion weighted imaging and diffusion tensor imaging ofbreast lesions[J].Eur J Radiol,2013,82(12):e801-806.
[12]Baltzer PA,Sch?fer A,Dietzel M,et al.Diffusion tensor magnetic resonance imaging of the breast:a pilot study[J].Eur Radiol,2011,21(1):1-10.
[13]Eyal E,Shapiro-Feinberg M,Furman-Haran E,et al.Parametric diffusion tensor imaging of the breast[J].Ⅰnvest Radiol,2012,47(5):284-291.
[14]司麗芳,劉小娟,楊開顏,等.3.0T磁共振擴散張量成像對乳腺腫塊性病變的鑒別診斷價值[J].中華醫學雜志,2016,96(19):1510-1514.
[15]申云霞,王秀榮,婁明武,等.擴散張量成像在乳腺良惡性病變鑒別中的臨床研究[J].實用放射學雜志,2016,32(7):1145-1147.

