大黃酚對局灶性腦缺血再灌注小鼠腦組織p-CREB、BDNF和p-STAT3的影響
房亞蘭 黃語悠 趙詠梅* 李錦程 段云霞 高 利 羅玉敏
(1.北京市平谷區醫院全科醫療科,北京 101200;2. 首都醫科大學宣武醫院 北京市老年病醫療研究中心,北京 100053)
缺血性卒中嚴重威脅人類健康,目前已成為我國國民死亡的首要原因[1]。然而臨床上治療腦缺血的藥物非常有限,唯一有效的治療方法是在有限的時間窗內應用重組組織型纖溶酶原激活劑進行溶栓。中藥大黃在我國用于治療腦缺血損傷由來已久,大黃酚(chrysophanol, CHR)是自大黃中提取的一種活性成分[2],近年來的研究[2-4]表明,CHR能顯著減少腦缺血再灌注損傷,但其相關神經保護機制尚不完全清楚。
環磷酸腺苷反應元件結合蛋白(cyclic AMP response element binding protein,CREB)是細胞核內的一種轉錄因子,其磷酸化程度與細胞對缺氧導致死亡的耐受性相關[5-6]。研究[7]表明,腦缺血損傷抑制磷酸化CREB(phosphorylated CREB,p-CREB)產生。給予永久性大腦中動脈梗死(middle cerebral artery occlusion, MCAO)小鼠西洛他唑治療后,神經元內p-CREB蛋白表達增加,細胞凋亡減少,腦梗死體積顯著減小[5]。腦源性神經營養因子(brain derived neurotrophic factor,BDNF)是CREB的下游調控因子,作為大腦發育過程及成人期的主要神經營養因子,廣泛分布于大腦皮質、海馬和紋狀體,能促進神經功能恢復,在腦缺血損傷中發揮神經保護作用[8]。給予腦缺血再灌注大鼠三七皂甙R1治療可能通過上調BDNF基因在海馬的表達水平,增加抗凋亡因子表達,從而保護腦缺血再灌注大鼠的海馬神經元,減少腦梗死體積[9]。
p-CREB和BDNF在腦缺血動物模型和腦缺血患者中表達失調,與腦缺血損傷密切相關,被認為是未來治療腦缺血的重要靶點[10]。轉錄激活因子3(signal transducer and activator of transcription 3, STAT3)是一種廣泛存在于中樞神經系統的DNA結合蛋白,在信號轉導和轉錄過程中發揮重要作用。有文獻[11]報道,STAT3聯結BDNF后可發揮神經可塑性。磷酸化STAT3(phosphorylated STAT3,p-STAT3)是STAT3的激活形式,p-STAT3參與腦缺血損傷的細胞死亡、凋亡過程[12]。研究[13]表明,在腦缺血再灌注大鼠的缺血側海馬組織,p-STAT3顯著增加。因此,本研究采用 MCAO再灌注模型小鼠,觀察CHR對腦缺血小鼠再灌注后14 d CREB、BDNF和p-STAT3表達的影響,從而進一步探討CHR長期拮抗腦缺血再灌注損傷的機制。
1 材料與方法
1.1 主要儀器設備
麻醉機(Harvard Apparatus公司,美國)、小動物手術顯微鏡(Carl Zeiss公司,德國)、雙極電凝器(天業德威醫療設備有限公司)、反饋式溫度調節儀(CMA 150, Carnegie Medicin公司,瑞典)、熒光顯微鏡(Nikon公司,日本)。
1.2 試劑
CHR(中國食品藥品檢定研究院);Tween 80(Sigma公司,美國);恩氟烷(河北一品制藥有限公司); p-CREB抗體(北京中杉金橋公司);BDNF抗體(Abcam公司,美國);NeuN抗體(Millipore公司,美國);p-STAT3抗體(CST公司,美國);β-actin抗體(Santa cruz公司,美國)等。
1.3 實驗動物及分組
2月齡C57BL健康雄性小鼠,體質量(23.5±1)g,實驗動物許可證號:SCXK(京) 2012-0001(北京維通利華實驗動物公司),飼養于SPF級動物實驗室。按照數字表法隨機將18只小鼠分為3組(每組6只):假手術(Sham)組、MCAO組、CHR組。CHR溶于含1%(體積分數)Tween 80和1%(體積分數)DMSO的0.9%(質量分數)氯化鈉注射液中,從造模當天至再灌注后14 d,CHR組小鼠按0.1 mg/kg腹腔注射CHR,每天1次, Sham組和MCAO組小鼠腹腔注射同等體積的含1%(體積分數) Tween 80和1%(體積分數) DMSO的0.9%(質量分數)氯化鈉注射液。
1.4 動物模型制作
MCAO模型按改良ZeaLonga法制備。將恩氟烷混合于70%(體積分數)N2O和30%(體積分數)O2中,先用5%(體積分數)恩氟烷誘導麻醉,再用面罩吸入2%(體積分數)恩氟烷維持麻醉。于小鼠頸部沿正中線切口,分離右側頸總動脈、頸內動脈及頸外動脈,將頭端直徑0.38 mm的尼龍線栓由頸外動脈殘端插入頸內動脈,至頸外動脈和頸內動脈分叉約1 cm處。手術過程中使用反饋性控溫毯監測實驗小鼠肛溫,維持在(37.0±0.5) ℃。缺血45 min后,小心地將線栓拔出進行再灌注。術后小鼠飼養于SPF級動物實驗室,自由進食飲水。
1.5 免疫熒光雙標
于造模后14 d,各組小鼠經腹腔注射水合氯醛麻醉后,快速斷頭取腦,經4%(質量分數)多聚甲醛固定48 h后,于30%(質量分數)蔗糖脫水24 h,將腦組織行連續冰凍切片(厚度為20 μm),切片經PBS洗后,用含0.2%(體積分數)TritonX-100的PBS孵育10 min,再經PBS洗后,于室溫下用5 %(體積分數)山羊血清封閉30 min,滴加一抗(p-CREB與NeuN鼠多克隆抗體 1∶300,或BDNF與NeuN鼠多克隆抗體 1∶300),4 ℃孵育過夜。次日取出切片,經PBS洗后,滴加山羊抗鼠和山羊抗兔熒光二抗(1∶300),避光于室溫下孵育1 h。經PBS洗后,最后用含DAPI(4′,6-diamidino-2-phenylindole)的封片劑進行封片。于熒光顯微鏡下觀察腦皮質缺血半暗帶區[14]。每組選取5只小鼠同一位置的腦切片3張,在相同放大倍數、相同參數條件下,每張腦組織冰凍切片隨機選取4個視野照相,使用NIS Element軟件統計p-CREB和BDNF陽性細胞數目。
1.6 Western blotting
再灌注14 d后,各組小鼠快速斷頭取腦,立即于前囟0到-0.1切取1 mm厚的腦組織冠狀切片,將缺血側腦組織在含有蛋白酶抑制劑的裂解緩沖液中于冰上勻漿,經30 min冰浴后,4 ℃條件下12 000 g離心30 min取上清。用BCA法進行蛋白濃度測定。將上樣緩沖液加入樣品煮沸10 min,然后進行SDS-PAGE電泳,濕轉法轉膜90 min,于5%(質量分數)脫脂牛奶室溫下封閉1 h,加入一抗(p-STAT3 1∶1 000,β-actin 1:1 000),4 ℃孵育過夜,用TBST洗膜3次,室溫下于HRP標記的二抗中孵育1 h,TBST洗膜3次,用ECL化學發光液顯色,并用化學發光系統掃描,蛋白條帶用Image J圖像處理軟件進行定量分析。
1.7 統計學方法
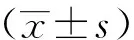
2 結果
2.1 CHR促進MCAO小鼠腦缺血半暗帶區p-CREB表達
免疫熒光染色結果顯示,Sham組小鼠腦組織內可見p-CREB紅色熒光染色,而MCAO組小鼠腦缺血半暗帶區p-CREB染色陽性細胞顯著減少,CHR組小鼠腦缺血半暗帶區p-CREB染色陽性細胞數目比MCAO組顯著增加(圖1 A),差異具有統計學意義(P<0.05,圖1 B)。免疫熒光雙標染色結果可見,在MCAO小鼠腦缺血半暗帶區內可見p-CREB陽性細胞及NeuN陽性細胞,其中p-CREB陽性細胞為紅色熒光,NeuN陽性細胞為綠色熒光。所有細胞的胞核為藍色熒光。圖像合并后,綠色與紅色熒光重合,表明p-CREB與神經元共定位,即腦缺血再灌注后p-CREB在缺血半暗帶區神經元內表達(圖1 A)。
2.2 CHR促進MCAO小鼠腦缺血半暗帶區BDNF表達
免疫熒光染色結果顯示,Sham組小鼠腦組織內可見BDNF紅色熒光染色,分布于大腦皮質、海馬及紋狀體,MCAO組小鼠腦缺血半暗帶區BDNF染色陽性細胞比Sham組明顯減少,CHR組小鼠腦缺血半暗帶區BDNF的表達比MCAO組明顯增加(圖2 A),差異具有統計學意義(P<0.05,圖2 B)。在MCAO小鼠腦缺血半暗帶區內可見BDNF陽性細胞為紅色熒光及NeuN陽性細胞為綠色熒光,細胞核為藍色熒光。圖像合并后,綠色與紅色熒光重合,表明BDNF與神經元共定位,即腦缺血再灌注后BDNF在缺血半暗帶區神經元內表達(圖2 A)。

圖1 Sham、MCAO及CHR各組小鼠再灌注14 d腦缺血半暗帶區p-CREB/NeuN免疫熒光雙標結果Fig.1 The double immunofluorescence labeling of p-CREB (red) / NeuN (green) in cerebralischemia penumbra of Sham, MCAO and CHR groups mice 14 d after reperfusion
A:representative double immunofluorescence labeling of p-CREB (red) / NeuN (green) on 14 d after ischemia/reperfusion. Bar=20μm.B: quantification of p-CREB-positive cells. (n=5, mean ± SD)*P<0.05vssham group,#P<0.05vsMCAO group;MCAO: middle cerebral artery occlusion;CHR:chrysophanol;p-CREB:phosphorylated cyclic AMP response element binding protein;DAPI: 4′,6-diamidino-2-phenylindole.

圖2 Sham、MCAO及CHR各組小鼠再灌注14 d腦缺血半暗帶區BDNF/NeuN免疫熒光雙標結果Fig.2 The double immunofluorescence labeling of BDNF (red) / NeuN (green) in cerebral ischemia penumbra of Sham, MCAO and CHR groups mice 14 d after reperfusion
A:representative double immunofluorescence labeling of BDNF (red) / NeuN (green) on 14 d after ischemia/reperfusion. Bar=20μm.B: quantification of BDNF-positive cells. (n=5, mean ± SD)*P<0.05vsSham group,#P<0.05vsMCAO group;BDNF:brain derived neurotrophic factor;MCAO: middle cerebral artery occlusion;CHR:chrysophanol;DAPI: 4′,6-diamidino-2-phenylindole.
2.3 CHR抑制MCAO小鼠缺血側腦組織p-STAT3蛋白表達
Western blotting結果顯示,與Sham組相比,MCAO組小鼠缺血側腦組織的p-STAT3蛋白表達水平顯著增加,差異具有統計學意義(P<0.05,圖3)。CHR組小鼠缺血側腦組織p-STAT3蛋白水平比MCAO組顯著減少,差異具有統計學意義(P<0.05,圖3)。
3 討論
炎性反應、氧化應激、興奮性氨基酸毒性等多種機制參與腦缺血/再灌注損傷過程。本課題組的研究[2]表明,腦缺血再灌注后14 d,CHR提高了MCAO小鼠生存率,改善神經功能評分,減少腦組織丟失,從而發揮長期的神經保護作用。這可能與CHR抑制內質網應激,進而抑制腦缺血半暗帶區內NF-κΒ活化,減少下游炎性反應因子表達有關[2-3]。然而對于缺血性腦損傷過程中,CHR發揮長期腦保護作用的機制尚不完全清楚。本研究采用免疫熒光染色方法檢測MCAO小鼠腦缺血半暗帶區p-CREB和BDNF蛋白表達水平,Western blotting檢測MCAO小鼠缺血側腦組織p-STAT3的蛋白水平,從而探討CHR拮抗腦缺血再灌注損傷的相關機制。

圖3 Sham、MCAO及CHR各組小鼠再灌注14 d缺血側腦組織p-STAT3的蛋白免疫印跡結果Fig.3 Western blotting results of p-STAT3 in ischemiabrain tissue of Sham, MCAO and CHR groupsmice 14 d after reperfusion
Western blotting results of p-STAT3. β-actin functions as loading control.*P<0.05vsSham group,#P<0.05vsMCAO group (n=5, mean±SD);MCAO: middle cerebral artery occlusion;CHR:chrysophanol;p-STAT3:phosphorylated signal transducer and activator of transcription 3.
研究[15]表明,p-CREB誘導激活與神經元存活相關的多種靶基因。為闡明CHR保護腦缺血損傷的機制,本研究觀察了CHR對MCAO小鼠腦缺血半暗帶區p-CREB表達的影響。免疫熒光染色結果顯示,腦缺血再灌注14 d,MCAO組小鼠缺血半暗帶區p-CREB蛋白水平較Sham組顯著降低,p-CREB介導一些神經營養因子和神經保護蛋白的轉錄,對修復神經細胞損傷有重要作用,有助于神經細胞存活[16],因此,本研究結果提示短暫性局灶性腦缺血再灌注損傷抑制p-CREB產生,導致神經細胞損傷。給予CHR治療的MCAO小鼠腦缺血半暗帶區p-CREB蛋白表達顯著增加,表明CHR促進p-CREB產生,結合課題組之前的研究[2]結果,給予CHR治療14 d能明顯改善MCAO小鼠神經功能缺損,減少細胞凋亡。提示CHR可能是通過促進p-CREB蛋白表達,減少神經細胞凋亡,從而減輕腦缺血損傷。
內源性神經保護劑BDNF是由p-CREB激活的神經營養因子之一[16],為進一步闡明CHR拮抗腦缺血損傷的機制,本研究觀察了CHR對MCAO小鼠腦缺血半暗帶區BDNF表達水平的影響。結果顯示,腦缺血再灌注14 d,MCAO組小鼠缺血半暗帶區BDNF蛋白水平較Sham組顯著降低,提示腦缺血再灌注損傷抑制內源性BDNF產生,促進神經元死亡,加重腦缺血再灌注損傷。p-CREB能促進BDNF等神經營養因子產生[17],增加BDNF水平或激活BDNF相關信號通路有助于恢復卒中導致的神經功能缺損[18],給予CHR治療的MCAO小鼠腦缺血半暗帶區BDNF蛋白表達顯著增加,提示CHR可能通過上調p-CREB表達,進而促進內源性BDNF產生,發揮長期腦保護作用。
有研究[19]顯示,腦缺血后BDNF與TNF-α在海馬小膠質細胞中共定位表達,BDNF能抑制TNF-α蛋白及mRNA的表達[20],表明BDNF參與調節炎性反應。結合本課題組之前的研究[2]結果,CHR能顯著抑制TNF-α等炎性反應因子表達,提示CHR可能通過促進BDNF產生,進而抑制炎性反應,發揮神經保護作用。
P-CREB能促進BDNF等神經營養因子產生,提高神經元存活率,改善突觸功能[17]。為闡明MCAO小鼠腦內p-CREB、BDNF在缺血半暗帶區神經元中表達水平的變化,本研究分別將p-CREB、BDNF與神經元標志物NeuN共染。免疫熒光雙標染色結果顯示,p-CREB、BDNF分別與NeuN共定位,表明p-CREB、BDNF在神經元內表達,提示p-CREB、BDNF影響腦缺血后神經元損傷。
STAT3介導許多細胞因子驅動的信號轉導。STAT3磷酸化后被激活,p-STAT3促進暫時性局灶性腦缺血后的神經元損傷[21]。在本研究中,筆者通過Western blotting檢測發現,腦缺血再灌注14 d,MCAO組小鼠缺血側腦組織p-STAT3蛋白比Sham組顯著增多。局灶性缺血后,p-STAT3可與DNA結合誘導多種基因表達,導致神經炎性反應、細胞凋亡和腦損傷[12]。因此本研究結果提示,腦缺血再灌注促進p-STAT3表達,進而促進細胞凋亡,因此,p-STAT3參與腦缺血再灌注損傷。文獻[22]報道,肢體遠端缺血后處理可調節反應性星形細胞可塑性并抑制STAT3磷酸化,以促進缺血性卒中后的神經功能恢復。本研究中給予CHR治療的MCAO小鼠缺血側腦組織p-STAT3蛋白顯著減少,表明CHR可能通過抑制缺血損傷后腦組織內p-STAT3表達,從而發揮長期神經保護作用。
綜上,本研究結果表明,給予CHR治療能促進腦缺血再灌注損傷過程半暗帶區p-CREB產生,上調BDNF表達,進而抑制炎性反應,并抑制缺血側腦組織p-STAT3蛋白表達,減少神經元死亡,發揮長期腦保護作用。
[1] Lin Y, Li Z, Liu C, et al. Towards precision medicine in ischemic stroke and transient ischemic attack [J]. Front Biosci (Landmark Ed), 2018, 23: 1338-1359.
[2] Zhao Y, Fang Y, Li J, et al. Neuroprotective effects of chrysophanol against inflammation in middle cerebral artery occlusion mice [J]. Neurosci Lett, 2016, 630: 16-22.
[3] Zhao Y, Fang Y, Zhao H, et al. Chrysophanol inhibits endoplasmic reticulum stress in cerebral ischemia and reperfusion mice [J]. Eur J Pharmacol, 2018, 818: 1-9.
[4] 房亞蘭, 黃語悠, 趙詠梅, 等. 大黃酚對局灶性腦缺血再灌注小鼠缺血半暗帶區環氧化酶2和基質金屬蛋白酶-9表達的影響[J]. 首都醫科大學學報, 2017, 38(1): 47-52.
[5] Shichinohe H, Tan C, Abumiya T, et al. Neuroprotective effects of cilostazol are mediated by multiple mechanisms in a mouse model of permanent focal ischemia [J]. Brain Res, 2015, 1602: 53-61.
[6] 魯楊, 張鴻, 馬英. CREB與腦缺血神經元損傷[J]. 解剖科學進展, 2010, 16(4): 374-376.
[7] Miyamoto N, Tanaka R, Shimosawa T, et al. Protein kinase A-dependent suppression of reactive oxygen species in transient focal ischemia in adrenomedullin-deficient mice [J]. J Cereb Blood Flow Metab, 2009, 29(11): 1769-1779.
[8] Dancause N, Nudo R J. Shaping plasticity to enhance recovery after injury [J]. Prog Brain Res, 2011, 192: 273-295.
[9] Zou S, Zhang M, Feng L, et al. Protective effects of notoginsenoside R1 on cerebral ischemia-reperfusion injury in rats [J]. Exp Ther Med, 2017, 14(6): 6012-6016.
[10] Qin L, Jing D, Parauda S, et al. An adaptive role for BDNF Val66Met polymorphism in motor recovery in chronic stroke [J]. J Neurosci, 2014, 34(7): 2493-2502.
[11] Tang Q P, Shen Q, Wu L X, et al. STAT3 signal that mediates the neural plasticity is involved in willed-movement training in focal ischemic rats [J]. J Zhejiang Univ Sci B, 2016, 17(7): 493-502.
[12] Hu G Q, Du X, Li Y J, et al. Inhibition of cerebral ischemia/reperfusion injury-induced apoptosis: nicotiflorin and JAK2/STAT3 pathway [J]. Neural Regen Res, 2017, 12(1): 96-102.
[13] 陳媛, 吳海金, 黃曉松, 等. 葛根素對腦缺血再灌注大鼠海馬組織P-STAT3、P53表達的影響[J]. 湖南中醫藥大學學報, 2018, 38(1): 36-39.
[14] Dong W, Qi Z, Liang J, et al. Reduction of zinc accumulation in mitochondria contributes to decreased cerebral ischemic injury by normobaric hyperoxia treatment in an experimental stroke model [J]. Exp Neurol, 2015, 272: 181-189.
[15] Lee J H, Park S Y, Lee W S, et al. Lack of antiapoptotic effects of antiplatelet drug, aspirin and clopidogrel, and antioxidant, MCI-186, against focal ischemic brain damage in rats [J]. Neurol Res, 2005, 27(5): 483-492.
[16] Chen A, Xiong L J, Tong Y, et al. The neuroprotective roles of BDNF in hypoxic ischemic brain injury [J]. Biomed Rep, 2013, 1(2): 167-176.
[17] Cortes-Mendoza J, Diaz de Leon-Guerrero S, Pedraza-Alva G, et al. Shaping synaptic plasticity: the role of activity-mediated epigenetic regulation on gene transcription [J]. Int J Dev Neurosci, 2013, 31(6): 359-369.
[18] Liu B, Li L L, Tan X D, et al. Gadd45b mediates axonal plasticity and subsequent functional recovery after experimental stroke in rats [J]. Mol Neurobiol, 2015, 52(3): 1245-1256.
[19] Mohamed R A, Agha A M, Abdel-Rahman A A, et al. Role of adenosine A2A receptor in cerebral ischemia reperfusion injury: signaling to phosphorylated extracellular signal-regulated protein kinase (pERK1/2) [J]. Neuroscience, 2016, 314: 145-159.
[20] Jiang Y, Wei N, Lu T, et al. Intranasal brain-derived neurotrophic factor protects brain from ischemic insult via modulating local inflammation in rats [J]. Neuroscience, 2011, 172: 398-405.
[21] Satriotomo I, Bowen K K, Vemuganti R. JAK2 and STAT3 activation contributes to neuronal damage following transient focal cerebral ischemia [J]. J Neurochem, 2006, 98(5): 1353-1368.
[22] Cheng X, Zhao H, Yan F, et al. Limb remote ischemic post-conditioning mitigates brain recovery in a mouse model of ischemic stroke by regulating reactive astrocytic plasticity [J]. Brain Res, 2018, 1686: 94-100.

