大豆分離蛋白與花青素非共價及共價作用對蛋白構象變化的影響
孫紅波,李 楊,王立敏,董濟萱,隋曉楠,齊寶坤,王中江,江連洲*
(東北農業大學食品學院,黑龍江 哈爾濱 150030)
大豆蛋白作為一種高營養高吸收率的全價植物蛋白,是我國居民日常膳食中優質蛋白質的重要來源之一[1-2],但天然蛋白質難以滿足食品加工時的不同種需求。為拓寬其市場應用,人們通過修飾大豆蛋白的結構,提高蛋白質的功能特性和生物活性。目前,蛋白質的改性技術主要集中在物理改性和化學改性,如何找到一種健康營養的天然改性技術一直是人們研究的重點[3]。事實上,生物小分子常與蛋白質發生相互作用,并影響著蛋白質的結構與功能特性。花青素作為一種多酚類小分子物質,是膳食中重要的營養成分,有助于預防心腦血管疾病和神經系統問題等疾病,具有較高的蛋白親合力,并能夠改善食品中的風味和質地[4-5]。
現今部分文獻研究表明蛋白質和多酚類物質之間可通過非共價結合/共價交聯發生相互作用,其中,對多酚-蛋白質非共價作用的研究主要集中在:大豆蛋白與槲皮素[6]、乳蛋白與天竺葵素[7]、牛奶蛋白與白藜蘆醇[8]、花青素與牛血紅蛋白[9]等。在共價相互作用中,多酚通常在堿性溶液中被氧化成醌,隨后與蛋白質中巰基或氨基基團結合發生不可逆的相互作用[10]。Jia Zhenbao等[11]分析了在堿性條件下,表沒食子兒茶素-3-沒食子酸經共價修飾乳清分離蛋白,引起了蛋白的構象和物化性質變化。Prodpran等[12]研究了幾種酚類化合物與肌原纖維蛋白之間在pH值大于10時產生共價交聯,復合物中所添加的酚類化合物可以增強成膜的機械性能。
目前,已有文獻對多酚類物質與蛋白質相互作用體系進行了部分研究,但未能對比解析復合體系中共價及非共價作用對蛋白結構的變化規律,并且針對于大豆分離蛋白和花青素復合體系的研究尚屬不足。因此,本實驗重點研究不同質量濃度的花青素(0.05、0.1、0.2 g/100 mL)與大豆分離蛋白(1 g/100 mL)之間通過非共價/共價作用形成的復合體系,明確對比非共價結合/共價交聯對大豆分離蛋白與花青素復合物之間的影響,詳細解析互作體系的結構變化,以期為改性大豆分離蛋白在食品加工中的合理應用提供參考。
1 材料與方法
1.1 材料與試劑
大豆分離蛋白 實驗室自制;葵花油 市購;花青素黑米提取物 山西太極唐代科技有限公司;大豆哈爾濱高科技有限公司;花青素-3-葡萄糖苷標品 大連美侖生物技術有限公司;鹽酸、氫氧化鈉、磷酸二氫鈉、磷酸氫二鈉(均為分析純) 北京新光化工試劑廠;正己烷、乙酸乙酯、甲醇(均為分析純) 天津北科化學品有限責任公司;其他化學試劑均為分析純。
1.2 儀器與設備
AL204型分析天平 梅勒特-托利多儀器(上海)有限公司;PHSJ-4A型實驗室pH計 中國上海雷磁公司;F-4500熒光分光光度計 日本Hitachi公司;TU-1800紫外-可見分光光度計 北京普析通用儀器有限責任公司;JJ-1增力電動攪拌器 江蘇金城國勝儀器廠;Allegra64R臺式高速冷凍離心機 美國貝克曼公司;IRTracer-100傅里葉紅外光譜 日本島津公司;E2695高效液相色譜 沃特世科技(上海)有限公司;十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳儀 東方電泳設備有限公司。
1.3 方法
1.3.1 大豆分離蛋白的制備
參考Wolf等[13]的制備方法,將新鮮大豆經破碎脫脂,與正己烷(1∶3)(g/mL)混合并離心脫油,所得脫脂豆粕以1∶10(g/mL)溶于去離子水中,用2 mol/L的NaOH溶液調節其pH值至8.5,經45 ℃攪拌2 h,將其懸浮液經9 500×g離心30 min,取其上清液用鹽酸(2 mol/L)調節溶液pH值至4.5,經6 000×g 離心20 min得到蛋白沉淀物,將上述蛋白沉淀物水洗3 次后,經6 500×g離心30 min,用2 mol/L的NaOH溶液調節至中性即可,將此蛋白溶液凍干并研磨,即可獲粉末狀的大豆分離蛋白。
1.3.2 花青素的純化與定量
根據Sui Xiaonan等[14]的方法對花青素進行純化。首先將黑米提取物溶解在蒸餾水中除雜,將溶液流經固相萃取柱使花青素被完全吸附,洗脫吸附柱以去除糖類和其他多酚類化合物(如酚酸和黃酮)等物質,將酸化的甲醇溶液洗脫吸附柱得粗花青素溶液。將上述溶液經旋轉蒸發器除去溶液中的甲醇,即可得到純化的花青素提取物。利用高效液相色譜法測定花青素的含量[15],將純化的花青素提取物經0.45 μm濾膜通過C18分析柱(250 mm×4.6 mm,5 μm)進行高效液相色譜系統分析,流量為1 mL/min,溫度為25 ℃,梯度洗脫程序參考Sadilova等[16]的方法,測定其花青素含量為25%(為方便計算,本實驗統一使用黑米中含量較多的矢車菊素-3-葡萄糖苷相對分子質量為花青素的相對分子質量近似處理)。
1.3.3 樣品的配制
參考Nagy等[17]的方法稍作修改,將大豆分離蛋白粉末溶于磷酸鹽緩沖液(10 μm,pH 7.4)中配制成質量濃度為1 g/100 mL的大豆分離蛋白溶液[18],將花青素(0.05、0.1、0.2 g/100 mL)按比例分別溶于此蛋白溶液中,室溫條件下隔氧混合攪拌2 h,由此可得大豆分離蛋白-花青素非共價復合物。參考Jia Zhenbao等[11]的方法稍作修改,將大豆分離蛋白粉末溶于磷酸鈉緩沖液(10 μm,pH 7.4)中配制成質量濃度為1 g/100 mL的大豆分離蛋白溶液,將花青素(0.05、0.1 、0.2 g/100 mL)按比例分別溶于此蛋白溶液中,用NaOH溶液(0.5 mol/L)調節pH值至9.0,室溫條件下混合攪拌24 h,終止反應調節pH值至7.4。由此可得大豆分離蛋白-花青素共價復合物。其中,未經處理的大豆分離蛋白溶液作為空白對照,各樣品處理條件及編號見表1。

表1 花青素與大豆分離蛋白復合物樣品Table1 SPI-anthocyanins complexes
1.3.4 濁度測定
濁度分析參考Martini等[19]的方法稍作修改,將待測樣品適當稀釋后(樣品蛋白質量濃度在5 mg/mL)倒入石英比色皿中,并利用紫外分光光度計在波長600 nm處對樣品進行測定,在25 ℃條件下測量濁度值,每個樣品平行測定3 次取平均值。
1.3.5 分子質量的測定
使用十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳測定樣品的分子質量,根據Laemmli等[20]的方法稍作修改。制備10%分離膠、5%濃縮膠,上樣質量濃度1 mg/mL,將樣品與上樣緩沖液在90 ℃條件下混合并加熱5 min,在冷卻后進行上樣,其上樣量為10 μL。電泳過程中維持80 V恒壓直至樣品跑至分離膠時改為120 V,電泳過程結束后用生物染色劑(考馬斯亮藍R-250)對凝膠進行染色隨后洗脫,采用市售彩虹Marker作為標準蛋白。
1.3.6 結合度的測定
確定復合物中花青素結合度及每毫克蛋白綁定花青素的含量。根據Rodríguez等[21]的方法稍作修改,首先制備花青素-3-葡萄糖苷的校準標準曲線,將所有樣品分別經截留分子質量為3 kDa的透析袋在4 ℃條件下進行透析12 h,取其透析液適當稀釋,以獲得其濃度值在制備的校準曲線范圍內,用高效液相色譜法在波長520 nm處測量樣品花青素吸光度并計算其含量,復合物中花青素結合度及花青素/蛋白百分比按公式(1)、(2)計算:

式中:R花青素為復合物中花青素綁定蛋白結合率/%;M總花青素為總花青素質量/mg;M透析為透析液外未被綁定的游離花青素質量/mg;R花青素/蛋白為每毫克大豆分離蛋白結合花青素的百分比/%;M蛋白為大豆分離蛋白質量/mg。
1.3.7 熒光光譜分析
將樣品適當稀釋,分別置于石英比色皿中,使用F-4500熒光光譜儀測定樣品的熒光光譜。其中,掃描發射波長在300~500 nm之間,激發波長為280 nm,激發和發射狹縫均為5 nm。
1.3.8 傅里葉變換紅外光譜分析
紅外光譜測試采用KBr壓片法,稱取樣品1 mg,加入溴化鉀100 mg,壓片后在室溫記錄紅外光譜。設定掃描波數譜段范圍450~4 000 cm-1,分辨率設定為4 cm-1,掃描64 次,譜圖利用Peakfit Version軟件進行處理。利用積分面積計算各二級結構組分的相對含量[22]。
1.4 數據統計及分析
實驗中每組數據平均重復3 次,利用Origin 8.5軟件進行數據處理與作圖。利用SPSS V17.0軟件進行ANOVA差異顯著性分析及相關性分析,其中P值小于0.05為顯著性差異。
2 結果與分析
2.1 濁度分析
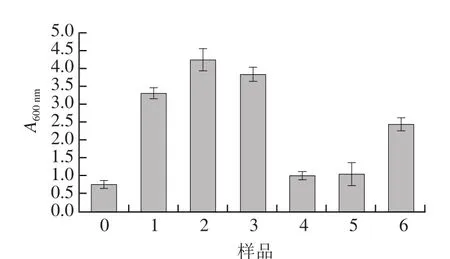
圖1 大豆分離蛋白-花青素復合物的濁度Fig.1 Turbidity of SPI-anthocyanins complexes
濁度可以直觀地反映溶液中蛋白質-花青素復合液中顆粒的分散狀態,同時可表達復合物的聚集狀態以及粒徑大小[23],由圖1可知,非共價結合/共價交聯作用對大豆分離蛋白-花青素復合物濁度的影響。隨花青素比例的增加,樣品1~6較空白樣品其濁度值都發生不同程度的增大,這可能是由于大豆分離蛋白經非共價結合/共價交聯機制與花青素發生相互作用,改變蛋白部分結構,使得粒徑發生不同程度的增大,蛋白質分子上含有固定連接多酚分子的位點數,隨著多酚濃度的增加,當兩者結合部位的數目趨于相等時,則可形成大量的復合物,濁度增大[24-25]。大豆分離蛋白-花青素復合物中樣品4~6(pH 9.0、24 h;20∶1、10∶1、5∶1,m/m)的濁度值低于樣品1~3(pH 7.4、2 h;20∶1、10∶1、5∶1,m/m),這一結果與Wang Xiaoyang等[26]實驗結論相同,由于在堿性條件下,花青素被氧化成醌類物質進而與蛋白質相互作用導致共價鍵的形成,從而改善復合物粒徑大小,降低溶液中與光線發生的漫反射。由此共價作用所形成的濁度值低于非共價作用所形成的濁度值。
2.2 結合度分析
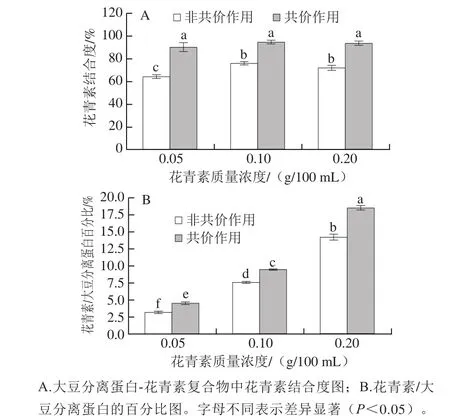
圖2 大豆分離蛋白-花青素復合物中結合分析圖Fig.2 Binding capacity of SPI-anthocyanins complexes
復合物經透析后可以獲得未與蛋白質相互作用的游離花青素,通過測定游離花青素的含量,進而計算出花青素結合程度與花青素/大豆分離蛋白的百分比。通過圖2得知,經共價交聯處理的樣品4~6(pH 9.0、24 h;20∶1、10∶1、5∶1,m/m)的結合度在90%~95%之間。相比之下,非共價結合處理的樣品1~3(pH 7.4、2 h;20∶1、10∶1、5∶1,m/m)結合度較小為64%~76%(圖2A)。非共價鍵主要包括范德華力、氫鍵、疏水作用力等,其鍵能弱于共價鍵,并且非共價作用是一種可逆的相互作用[17],這可能導致復合物的非共價結合程度低于共價交聯程度。但無論共價/非共價作用,每毫克蛋白質所綁定的花青素含量都隨花青素質量濃度的增加而上升(圖2B),這一結果與Rodríguez等[21]的實驗現象相吻合。值得注意的是樣品4(pH 9.0、24 h;20∶1,m/m)中的花青素/大豆分離蛋白百分比比樣品1(pH 7.4,2 h;20∶1,m/m)高出40.17%,樣品5(pH 9.0,24 h;10∶1,m/m)比樣品2(pH 7.4、2 h;10∶1,m/m)高出30.84%,結果表明隨著花青素質量濃度的增加,共價鍵在所有復合物中具有比非共價鍵更強的親和性,更有效地形成大豆分離蛋白-花青素復合物。此外,花青素與蛋白的結合能力與其相互作用模式等其他性質有關[17]。
2.3 十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳結果
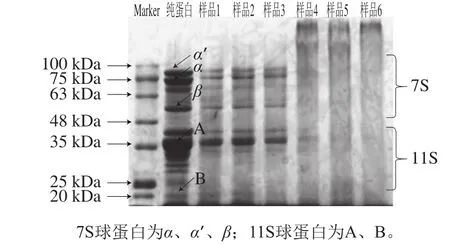
圖3 大豆分離蛋白-花青素復合物的電泳圖譜圖Fig.3 SDS-PAGE prof i les of SPI-anthocyanins complexes
大豆分離蛋白受離心力場作用,根據沉降系數的差異分為4 種不同的蛋白質沉淀物2S、7S、11S和15S[27],其中7S(β-伴大豆球蛋白)和11S(大豆球蛋白)是大豆分離蛋白中的主要蛋白質,根據蛋白亞基分子質量的不同在十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳圖中產生不同條帶分布,由此表達蛋白亞基的遷移能力[28]。如圖3所示,與未經處理的蛋白相比,復合物中蛋白條帶寬度都有所下降,并且在樣品4~6(pH 9.0、24 h;20∶1、10∶1、5∶1,m/m)中分離膠上端出現了新的條帶,平均分子質量約為180 kDa,此外分離膠頂部有黑色條帶印記,這種現象說明有新的衍生物生成[29]。這可能是由于7S與11S蛋白被花青素經共價交聯被部分綁定,從而形成較大分子質量的蛋白質復合物。這與Jia Zhenbao等[11]實驗結論相同。樣品1~3(pH 7.4、2 h;20∶1、10∶1、5∶1,m/m)中沒有新的條帶出現,僅降低了7S、11S蛋白含量,這意味著在pH 7.4、2 h處理條件下未生成共價交聯反應,未改變蛋白質的四級結構。
2.4 熒光光譜分析
熒光光譜可有效反映蛋白質三級結構構象變化[30],常用于了解蛋白質與小分子物質復合的結合特性。由圖4可知,花青素加入后,蛋白最大吸收峰的熒光強度值均低于未處理的空白蛋白熒光強度,并且熒光強度隨花青素質量濃度的增加而逐漸降低,這說明花青素與大豆分離蛋白發生了相互作用。樣品1~6的λmax均發生紅移,表明復合物中大豆分離蛋白發生解折疊,并且蛋白經花青素結合后其主要發色基團Trp暴露于較為親水環境中,由此導致蛋白質的三級結構發生不同程度的變化[31-32]。復合樣品4~6(pH 9.0、24 h;20∶1、10∶1、5∶1,m/m)的熒光猝滅效果較樣品1~3(pH 7.4、2 h;20∶1、10∶1、5∶1,m/m)明顯,其結果表明共價交聯作用強度大于非共價結合作用,這可能是花青素與蛋白經不可逆的共價作用大大降低了色氨酸含量,色氨酸含有自由氨基(—NH2),氨基與多酚類物質上的C發生共價交聯生成C—N共價鍵。并且蛋白可能由于與花青素緊密結合使得部分發色基團被掩蓋,降低蛋白熒光強度[11]。
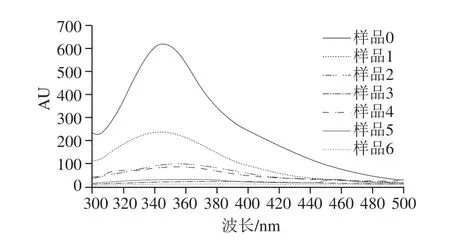
圖4 大豆分離蛋白-花青素復合物熒光光譜圖Fig.4 Emission fl uorescence spectra of SPI-anthocyanins complexes
2.5 紅外光譜分析
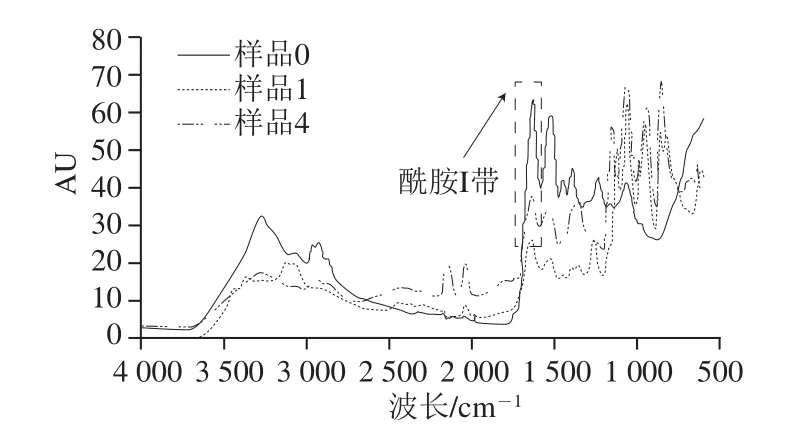
圖5 大豆分離蛋白-花青素復合物傅里葉紅外光譜圖Fig.5 FT-IR spectra of SPI-anthocyanins complexes
傅里葉紅外光譜是一種用來分析蛋白質結構表征的光譜技術[33]。如圖5所示,蛋白質酰胺I帶吸收峰的變化反映了蛋白二級結構的變化(1 700~1 600 cm-1)。根據己有研究表明,蛋白質二級結構與各子峰間的對應關系為:波數1 646~1 664 cm-1處對應的結構為α-螺旋;波數1 615~1 637 cm-1和1 682~1 700 cm-1處對應的結構為β-折疊;波數1 664~1 681 cm-1處對應的結構為β-轉角;波數1 637~1 645 cm-1處對應的結構為無規則卷曲[34]。
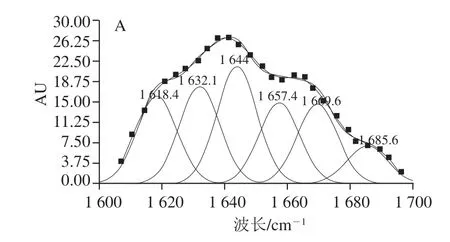
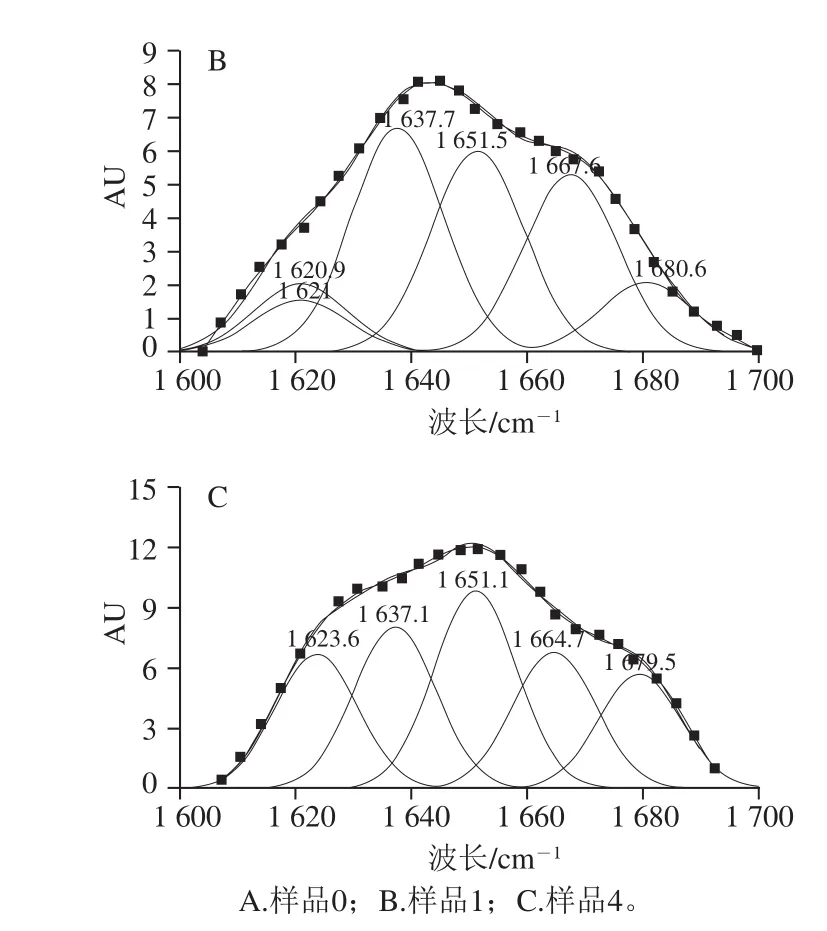
圖6 大豆分離蛋白-花青素復合物中蛋白酰胺I帶的擬合圖譜Fig.6 Second-derivative FTIR spectra in the amide I region and Gaussian curve fi tting for soybean protein isolate in soybean protein isolates-anthocyanins complexes
采用Gauss面積法擬合,將復合樣品中大豆分離蛋白的酰胺I帶紅外譜圖進行二階導數,可得大豆分離蛋白-花青素復合物中蛋白酰胺I帶的擬合圖譜,見圖6;可計算得出蛋白質二級結構的種類與含量[35],計算結果見表2。
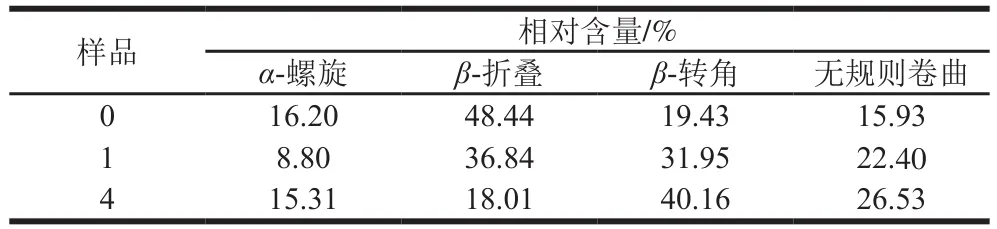
表2 大豆分離蛋白-花青素復合物中蛋白的二級結構相對含量Table2 Secondary structure contents of proteins in SPI-anthocyanins complexes
由圖5、6可知,復合物中的蛋白紅外光譜吸收強度有明顯變化,花青素的加入導致酰胺I帶吸收峰的強度降低,與空白蛋白,樣品1(pH 7.4、2 h;20∶1,m/m)、4(pH 9.0、24 h;20∶1,m/m)的酰胺I帶分別從1 624.78 cm-1藍移至1 630.97 cm-1和1 634.74 cm-1,波長向短波長方向移動,振動能量增高。這表明添加花青素后蛋白質的二級結構發生了不同程度的改變。復合物之間的相互作用可能會導致蛋白質構象發生變化[36]。表2中,樣品1(pH 7.4、2 h;20∶1,m/m)與樣品4(pH 9.0、24 h;20∶1,m/m)的β-折疊相對含量分別降低到36.84%和18.01%,β-轉角相對含量分別增加到31.95%和40.16%,無規則卷曲相對含量分別增加到22.40%和26.53%。這表明α-螺旋和β-折疊結構逐漸向β-轉角和無規則卷曲轉變,Hasni等[37]認為蛋白質的構象可被多酚改變,主要是由于α-螺旋、β-折疊與β-轉角、無規則卷曲之間的含量轉換,此外,在堿性條件下大豆分離蛋白-花青素復合物中β-轉角及無規則卷曲結構相對含量明顯提升,這進一步表明對于復合物中的蛋白質,共價交聯作用較非共價結合作用具有較強的解折疊能力,使得部分蛋白結構展開。
3 結 論
本實驗采用十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳分析與結合度測定方法探究了大豆分離蛋白-花青素復合體系中分子質量分布及花青素對蛋白的綁定狀態,利用濁度測定手段分析了復合體系中顆粒的分散狀態,再通過熒光光譜及紅外光譜測定方法從微觀上解析了復合體系中蛋白結構變化。由此研究得出以下結論:
結合度測定、凝膠電泳分析等實驗表明,在電泳圖譜中樣品4~6(20∶1、10∶1、5∶1,m/m)在pH 9.0、24 h處理條件下有大分子衍生物生成,由此說明在此條件下形成共價交聯;每毫克蛋白質所綁定的花青素含量都隨花青素質量濃度的增加而增大,且共價鍵在所有復合物中具有比非共價鍵更強的親和特性。
隨花青素的加入,大豆分離蛋白經非共價結合/共價交聯機制與花青素發生相互作用,蛋白部分結構發生改變,復合體系中粒徑發生不同程度的增大。在pH 7.4、2 h和pH 9.0、24 h處理條件下,樣品濁度值均高于空白蛋白樣品,且樣品4~6(20∶1、10∶1、5∶1,m/m)的濁度值低于樣品1~3(20∶1、10∶1、5∶1,m/m),這可能是共價聚合可改善復合物粒徑大小從而降低復合物光漫反射。
熒光光譜圖中表明隨著花青素含量的增大,復合物溶液的熒光強度明顯降低。蛋白質與花青素之間的相互作用不斷增強,使得發色基團被不斷猝滅,其中不可逆的共價作用猝滅能力強于非共價作用;在pH 7.4、2 h和pH 9.0、24 h 處理條件下,低花青素比例(20∶1,m/m)大豆分離蛋白-花青素復合物的紅外吸收光譜強度與空白蛋白樣相比均發生明顯變化,這表明復合物中蛋白質二級結構發生改變,且樣品4在pH 9.0、24 h處理條件下β-轉角及無規則卷曲結構相對含量高于樣品1(pH 7.4、2 h),由此推測共價交聯機制中蛋白多肽鏈的解折疊能力較強。
以上結果為大豆分離蛋白-花青素復合體系中的非共價/共價作用對其結構的影響提供了部分參考,為多酚類物質與植物蛋白復合產品等食品加工過程的應用提供了一定的理論依據。
[1] GARCIA-DIAZ D F, JOHNSON M H, DE MEJIA E G. Anthocyanins from fermented berry beverages inhibit inf l ammation-related adiposity response in vitro[J]. Journal of Medicinal Food, 2015, 18(4)∶ 489-496.DOI∶10.1089/jmf.2014.0039.
[2] 張濤, 魏安池, 劉若瑜. 大豆蛋白改性技術研究進展[J]. 糧油食品科技, 2011, 19(5)∶ 26-29. DOI∶10.16210/j.cnki.1007-7561.2011.05.020.
[3] 畢爽, 張巧智, 丁儉, 等. 紅外光譜研究超聲促聚集作用對大豆蛋白-磷脂結構與功能的影響[J]. 食品科學, 2017, 38(11)∶ 18-24.DOI∶10.7506/spkx1002-6630-201711004.
[4] MULAUDZI R B, NDHLALA A R, KULKARNI M G, et al.Pharmacological properties and protein binding capacity of phenolic extracts of some Venda medicinal plants used against cough and fever[J]. Journal of Ethnopharmacology, 2012, 143(1)∶ 185-193.DOI∶10.1016/j.jep.2012.06.022.
[5] KONCZAK I, ZHANG W. Anthocyanins—more than nature’s colours[J]. BioMed Research International, 2004, 2004(5)∶ 239-240.DOI∶10.1155/S1110724304407013.
[6] WANG Y, WANG X. Binding, stability, and antioxidant activity of quercetin with soy protein isolate particles[J]. Food Chemistry, 2015,188∶ 24-29. DOI∶10.1016/j.foodchem.2015.04.127.
[7] ARROYO-MAYA I J, CAMPOS-TERáN J, HERNáNDEZARANA A, et al. Characterization of flavonoid-protein interactions using fluorescence spectroscopy∶ binding of pelargonidin to dairy proteins[J]. Food Chemistry, 2016, 213∶ 431-439. DOI∶10.1016/j.foodchem.2016.06.105.
[8] GORJI E G, ROCCHI E, SCHLEINING G, et al. Characterization of resveratrol-milk protein interaction[J]. Journal of Food Engineering,2015, 167(b)∶ 217-225. DOI∶10.1016/j.jfoodeng.2015.05.032.
[9] 姚惠芳, 景浩. 篤斯越橘花青素與牛血清白蛋白的相互作用[J]. 食品科學, 2013, 34(23)∶ 6-10. DOI∶10.7506/spkx1002-6630-201323002.
[10] OZDAL T, CAPANOGLU E, ALTAY F. A review on protein-phenolic interactions and associated changes[J]. Food Research International,2013, 51(2)∶ 954-970. DOI∶10.1016/j.foodres.2013.02.009.
[11] JIA Z B, ZHENG M, TAO F, et al. Effect of covalent modification by (-)-epigallocatechin-3-gallate on physicochemical and functional properties of whey protein isolate[J]. LWT-Food Science and Technology, 2016, 66∶ 305-310. DOI∶10.1016/j.lwt.2015.10.054.
[12] PRODPRAN T, BENJAKUL S, PHATCHARAT S. Effect of phenolic compounds on protein cross-linking and properties of film from fish myofibrillar protein[J]. International Journal of Biological Macromolecules, 2012, 51(5)∶ 774-782. DOI∶10.1016/j.ijbiomac.2012.07.010.
[13] WOLF W J. Soybean proteins. Their functional, chemical, and physical properties[J]. Journal of Agricultural and Food Chemistry,1970, 18(6)∶ 969-976. DOI∶10.1021/jf60172a025.
[14] SUI X N, ZHOU W. Monte Carlo modelling of non-isothermal degradation of two cyanidin-based anthocyanins in aqueous system at high temperatures and its impact on antioxidant capacities[J]. Food Chemistry, 2014, 148∶ 342-350. DOI∶10.1016/j.foodchem.2013.10.060.
[15] SUI X, DONG X, ZHOU W. Combined effect of pH and high temperature on the stability and antioxidant capacity of two anthocyanins in aqueous solution[J]. Food Chemistry, 2014, 163∶ 163-170. DOI∶10.1016/j.foodchem.2014.04.075.
[16] SADILOVA E, STINTZING F C, CARLE R. Thermal degradation of acylated and nonacylated anthocyanins[J]. Journal of Food Science,2006, 71(8)∶ C504-C512. DOI∶10.1111/j.1750-3841.2006.00148.x.
[17] NAGY K, COURTET-COMPONDU M C, WILLIAMSON G, et al.Non-covalent binding of proteins to polyphenols correlates with their amino acid sequence[J]. Food Chemistry, 2012, 132(3)∶ 1333-1339.DOI∶10.1016/j.foodchem.2011.11.113.
[18] 劉勤勤, 朱科學, 郭曉娜, 等. 茶多酚與大豆分離蛋白的相互作用[J].食品科學, 2015, 36(17)∶ 43-47. DOI∶10.7506/spkx1002-6630-201517009.
[19] MARTINI S, POTTER R, WALSH M. Optimizing the use of power ultrasound to decrease turbidity in whey protein suspensions[J]. Food Research International, 2010, 43(10)∶ 2444-2451. DOI∶10.1016/j.foodres.2010.09.018.
[20] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227∶ 680-685.DOI∶10.1038/227680a0.
[21] RODRíGUEZ S D, VON STASZEWSKI M, PILOSOF A M R.Green tea polyphenols-whey proteins nanoparticles∶ bulk, interfacial and foaming behavior[J]. Food Hydrocolloids, 2015, 50∶ 108-115.DOI∶10.1016/j.foodhyd.2015.04.015.
[22] SUREWICZ W K, MANTSCH H H. New insight into protein secondary structure from resolution-enhanced infrared spectra[J].Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology, 1988, 952∶ 115-130. DOI∶10.1016/0167-4838(88)90107-0.
[23] 李云. 大豆蛋白聚集及共混凝膠性質研究[D]. 無錫∶ 江南大學,2007.
[24] 綦菁華, 蔡同一, 于同泉, 等. 蛋白質和酚類的濃度及其比率對其聚合物濁度的影響[J]. 食品科學, 2008, 29(11)∶ 114-117.
[25] SIEBERT K J, TROUKHANOVA N V, LYNN P Y. Nature of polyphenol-protein interactions[J]. Journal of Agricultural and Food Chemistry, 1996, 44(1): 80-85. DOI:10.1021/jf9502459.
[26] WANG X Y, ZHANG J, LEI F, et al. Covalent complexation and functional evaluation of (-)-epigallocatechin gallate and α-lactalbumin[J]. Food Chemistry, 2014, 150∶ 341-347. DOI∶10.1016/j.foodchem.2013.09.127.
[27] NISHINARI K, FANG Y, GUO S, et al. Soy proteins∶ a review on composition, aggregation and emulsif i cation[J]. Food Hydrocolloids,2014, 39∶ 301-318. DOI∶10.1016/j.foodhyd.2014.01.013.
[28] 鄭敏. 表沒食子兒茶素沒食子酸酯(EGCG)對乳清分離蛋白的改性作用研究[D]. 北京∶ 中國計量學院, 2014.
[29] RAWEL H M, CZAJKA D, ROHN S, et al. Interactions of different phenolic acids and flavonoids with soy proteins[J]. International Journal of Biological Macromolecules, 2002, 30(3)∶ 137-150.DOI∶10.1016/S0141-8130(02)00016-8.
[30] LIU W, ZHANG Z Q, LIU C M, et al. The effect of dynamic highpressure microf l uidization on the activity, stability and conformation of trypsin[J]. Food Chemistry, 2010, 123(3)∶ 616-621. DOI∶10.1016/j.foodchem.2010.04.079.
[31] KRISTO E, HAZIZAJ A, CORREDIG M. Structural changes imposed on whey proteins by UV irradiation in a continuous UV light reactor[J]. Journal of Agricultural and Food Chemistry, 2012, 60(24)∶6204-6209. DOI∶10.1021/jf300278k.
[32] LAKOWICZ J R, MASTERS B R. Principles of fluorescence spectroscopy[J]. Naturwissenschaften, 1991, 78(10): 456-457.
[33] JACKSON M, MANTSCH H H. The use and misuse of FTIR spectroscopy in the determination of protein structure[J]. Critical Reviews in Biochemistry and Molecular Biology, 1995, 30(2): 95-120.DOI:10.3109/10409239509085140.
[34] SCHMIDT V, GIACOMELLI C, SOLDI V. Thermal stability of films formed by soy protein isolate-sodium dodecyl sulfate[J].Polymer Degradation and Stability, 2005, 87(1): 25-31. DOI:10.1016/j.polymdegradstab.2004.07.003.
[35] MAUERER A, LEE G. Changes in the amide I FT-IR bands of poly-L-lysine on spray-drying from alpha-helix, beta-sheet or random coil conformations[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2006, 62(2): 131-142. DOI:10.1016/j.ejpb.2005.08.005.
[36] WU X, WU H, LIU M, et al. Analysis of binding interaction between (-)-epigallocatechin (EGC) and beta-lactoglobulin by multi-spectroscopic method[J]. Spectrochim Acta A Molecular &Biomolecular Spectroscopy, 2011, 82(1): 164-168. DOI:10.1016/j.saa.2011.07.028.
[37] HASNI I, BOURASSA P, HAMDANI S, et al. Interaction of milk α- and β-caseins with tea polyphenols[J]. Food Chemistry, 2011,126(2): 630-639. DOI:10.1016/j.foodchem.2010.11.087.

