乳源免疫調節肽通過泛素-蛋白酶體途徑抑制卵巢癌耐藥性及其機制研究
阮 昕,汪慎燚,徐 恰,席 浩,薛紹禮,2,秦宜德
卵巢癌是婦科三大常見的惡性腫瘤之一,化療目前是一種重要的治療手段,但化療耐藥嚴重影響了患者的治愈率,主要的化療藥物包括順鉑(cis-dichlorodiammine platinum,DDP)和紫杉醇,提高化療敏感性,對卵巢癌的治療有重要意義。乳源免疫調節肽(PGPIPN)來源于牛乳β-酪蛋白的63-68氨基酸殘基上的六肽[1],也是一種免疫調節肽。課題組前期通過體內實驗顯示PGPIPN具有刺激機體外周血細胞增殖、明顯促進抗體生成、能顯著促進腹腔巨噬細胞吞噬活性、刺激淋巴細胞轉化等[2-4],并且能夠抑制卵巢癌細胞SKOV3的侵襲和轉移,促進細胞凋亡[5-6]。雖然PGPIPN無毒副作用和不良反應,但抗癌效果不及傳統的化療藥物,基于前期研究[7],因此采用PGPIPN和DDP聯合用藥。泛素-蛋白酶體系統是一種破壞陳舊或損傷蛋白的重要機制,并調節多種細胞生物學過程,在調節細胞內各項信號通路中起著重要作用。該實驗主要研究PGPIPN是否通過泛素-蛋白酶體途徑降低卵巢癌細胞對DDP 的耐藥性。
1 材料與方法
1.1細胞株人卵巢癌SKOV3、SKOV3-DDP細胞株購自中國醫學科學院北京腫瘤研究所。
1.2人卵巢癌組織人卵巢癌組織在獲取知情同意后取自安徽醫科大學婦產科手術室,符合倫理學要求。
1.3主要材料PGPIPN純度為99.288%(中國合肥國肽生物科技有限公司);DDP(江蘇諾欣藥業公司);McCoy’s 5A Medium(美國Sigma公司);MTT、BCA蛋白測定試劑盒、Agarose(江蘇碧云天生物技術有限公司);TRIzol(美國Gibco公司);胎牛血清(浙江天杭生物科技有限公司);胰酶(合肥Biosharp生物科技公司); DL1000 DNA Marker、Premix×Taq酶(日本TaKaRa公司);逆轉錄試劑盒(美國Thermo Fisher公司);PVDF膜(美國Bio-Rad公司);β-actin(北京中杉金橋生物技術有限公司);SIAH兔抗(武漢愛博泰克生物技術有限公司);PSMA1兔抗(美國Abcam公司);PBS、β-catenin兔抗(武漢博士德生物工程有限公司)。
1.4方法
1.4.1細胞培養 人卵巢癌細胞SKOV3、SKOV3-DDP用McCoy’s 5A Medium培養基,加入含10%胎牛血清、100 U/ml 青霉素、100 U/ml 鏈霉素,置于37 ℃、5% CO2培養箱中培養,SKOV3-DDP細胞給予一定濃度DDP持續刺激,保持其耐藥性。
1.4.2原代培養 原代卵巢癌組織來自于安徽醫科大學第一附屬醫院婦產科,為28例漿液性卵巢腺癌(Ⅲ、Ⅳ級)的患者,且這些患者在手術前未接受輔助治療,如化療或放療前。患者在接受癌組織切除術后,盡快用預冷的10%血清DMEM培養基將組織塊運送至細胞房,用預冷無菌PBS緩慢沖洗癌組織塊上的血細胞。無菌操作下將組織塊用無菌眼科剪剪成1 mm ×1 mm×1 mm左右后轉移至無菌試管中,加入癌組織3倍體積的1.5%的胰蛋白酶,消化40~50 min后,800 r/min離心5 min,棄上清液。將消化結束后的組織塊用含3 μg/ml生長因子、0.1 ng/ml β-雌二醇和20%胎牛血清的DMEM培養基吹打混勻后接種于培養瓶中放于37 ℃、5% CO2培養箱培養。48 h后將未貼壁的組織用PBS沖洗去除,貼壁的細胞繼續培養至匯合率為70%~80%,傳代后進行下一步實驗。
1.4.3MTT檢測48 h時DDP和聯合用藥對卵巢癌細胞增殖的影響 取對數生長的細胞配置成細胞懸液接種于96孔板中,培育過夜后,加入不同濃度的DDP。48 h后每孔加入20 μl MTT,繼續孵育4 h后,酶標儀上測定各孔490 nm波長的吸光度(optical delnsity,OD)值, 每組5個復孔,以空白對照組計算用藥組的生長抑制率,增殖抑制率的計算公式為:增殖抑制率(%)=(1-OD實驗組/OD空白對照組)×100%。MTT實驗法,檢測48 h時,PGPIPN聯合DDP對卵巢癌細胞增殖的抑制率。取對數生長的細胞配置成細胞懸液接種于96孔板中,培育過夜后,細胞株分為6組加藥:空白對照、1.68×10-1μmol/L PGPIPN、DDP(IC50)、DDP(IC50)+1.68×10-3μmol/L PGPIPN、DDP(IC50)+1.68×10-1μmol/L PGPIPN、DDP(IC50)+16.8 μmol/L PGPIPN。48 h后每孔加入20 μl MTT,繼續孵育4 h后,酶標儀上測定各孔490 nm波長的吸光度值,每組復孔5個,以正常對照組計算用藥組的生長抑制率,計算公式為:抑制率(%)=(1-OD實驗組/OD空白對照組)×100%。
1.4.4RT-PCR檢測SIAH、PSMA1、β-catenin的mRNA的表達情況
1.4.4.1 RNA提取 培養卵巢癌細胞,分為6組加藥:空白對照、1.68×10-1μmol/L PGPIPN、DDP(IC50)、DDP(IC50)+1.68×10-3μmol/L PGPIPN、DDP(IC50)+1.68×10-1μmol/L PGPIPN、DDP(IC50)+16.8 μmol/L PGPIPN。培養48 h提取總RNA,再用DEPC水溶解后放置于-80 ℃保存。
1.4.4.2 引物設計 所有引物由上海生工生物技術有限公司合成,見表1。
1.4.4.3 PCR過程 使用Thermo試劑盒進行逆轉錄。PCR產物經1.5%瓊脂糖凝膠電泳分離,并用凝膠成像系統分析,以目的條帶的灰度與內參β-actin的灰度之比表示目的基因的表達水平。
1.4.5Western blot法檢測SIAH、PSMA1、β-catenin蛋白的表達情況 培養卵巢癌細胞,分為6組加藥:空白對照、1.68×10-1μmol/L PGPIPN、DDP(IC50)、DDP(IC50)+1.68×10-3μmol/L PGPIPN、DDP(IC50)+1.68×10-1μmol/L PGPIPN、DDP(IC50)+16.8 μmol/L PGPIPN。48 h以后收集細胞總蛋白,BCA法測定蛋白濃度,經12% SDS-PAGE凝膠電泳、轉膜、封閉,分別加入一抗β-actin(1 ∶10 000)、PSMA1(1 ∶5 000)、SIAH(1 ∶1 000)、β-catenin(1 ∶200)過夜,TBST洗3次,加入對應的二抗,孵育2 h,洗膜,顯影,并進行灰度值分析。
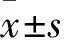
2 結果
2.1PGPIPN聯合DDP對卵巢癌細胞增殖的影響 使用0~100 μmol/L DDP作用于人卵巢癌細胞SKOV3、SKOV3-DDP以及原代卵巢癌細胞48 h,隨著DDP濃度增加,對細胞的抑制作用也增加,測出SKOV3、SKOV3-DDP以及原代卵巢癌細胞的平均IC50值為(10.022±2.574)、(20.967±3.600)、(23.743±14.043)μmol/L。使用IC50濃度DDP,聯合低、中、高濃度PGPIPN作用于卵巢癌細胞48 h,計算細胞增殖抑制率,結果顯示,與DDP組相比,聯合用藥組的細胞抑制率高于單獨DDP組,且肽濃度越高,抑制率越明顯,單獨PGPIPN組效果不明顯,PGPIPN能降低卵巢癌細胞耐藥性,差異有統計學意義(FSKOV3=28.419,FSKOV3-DDP=29.336,F原代細胞=16.274,P<0.05)。見圖1。

圖1 PGPIPN聯合DDP對SKOV3、SKOV3-DDP和原代細胞增殖的影響
1:1.68×10-1μmol/L PGPIPN;2:DDP(IC50);3:DDP(IC50)+1.68×10-3μmol/L PGPIPN;4:DDP(IC50)+1.68×10-1μmol/L PGPIPN;5:DDP(IC50)+16.8 μmol/L PGPIPN;與DDP組比較:*P<0.05,**P<0.01
2.2RT-PCR檢測泛素-蛋白酶體途徑基因表達RT-PCR檢測PGPIPN聯合DDP作用于卵巢癌細胞時,β-catenin、SIAH、PSMA1的mRNA表達情況,結果顯示,與對照組相比,用藥組的SIAH、PSMA1基因表達量增加(P<0.05,P<0.01),隨著PGPIPN濃度增加而增加,β-catenin基因的表達量降低(P<0.05,P<0.01),隨著PGPIPN濃度增加而降低。見圖2。
2.3Westernblot法檢測泛素-蛋白酶體途徑蛋白表達Western blot法檢測PGPIPN聯合DDP作用于卵巢癌細胞時,SIAH、PSMA1、β-catenin蛋白表達情況,結果顯示,與對照組相比,用藥組的SIAH、PSMA1蛋白表達量增加(P<0.05,P<0.01),隨著PGPIPN濃度增加而增加,β-catenin蛋白的表達量降低(P<0.05,P<0.01),隨著PGPIPN濃度增加而降低。見圖3。
3 討論
乳源生物活性肽是乳蛋白經消化酶的作用后釋放的一種肽,機體可以直接吸收,在免疫、代謝等諸多方面對生物體有調節作用[8-9]。

圖2 PGPIPN聯合DDP作用于卵巢癌細胞的SIAH、PSMA1和β-catenin的RT-PCR結果
A:SKOV3;B:SKOV3-DDP;C:原代卵巢癌細胞;M:Marker;1:空白對照;2:1.68×10-1μmol/L PGPIPN;3:DDP(IC50);4:DDP(IC50)+1.68×10-3μmol/L PGPIPN;5:DDP(IC50)+1.68×10-1μmol/L PGPIPN;6:DDP(IC50)+16.8 μmol/L PGPIPN; 與空白對照組比較:*P<0.05,**P<0.01;與DDP組比較:#P<0.05,##P<0.01

圖3 Western blot檢測PGPIPN聯合DDP作用于卵巢癌細胞的SIAH、PSMA1和β-catenin的表達
A:SKOV3;B:SKOV3-DDP;C:原代卵巢癌細胞;1:空白對照;2:1.68×10-1μmol/L PGPIPN;3:DDP(IC50);4:DDP(IC50))+1.68×10-3μmol/L PGPIPN;5:DDP(IC50))+1.68×10-1μmol/L PGPIPN;6:DDP(IC50))+16.8 μmol/L PGPIPN;與空白對照組比較:*P<0.05,**P<0.01;與DDP組比較:#P<0.05,##P<0.01
本實驗室研究的PGPIPN富含脯氨酸能抵抗胃蛋白酶和胰蛋白酶的作用,同時由于含有脂肪側鏈的氨基酸殘基,則在一定程度上能抵抗微生物的作用。在前期研究[7]中發現PGPIPN可以提高卵巢癌細胞對DDP的敏感性,其主要的機制主要是阻斷腫瘤細胞的一些信號傳導途徑誘導其凋亡,抑制由順鉑等引起的卵巢癌細胞抗凋亡蛋白過表達,誘導腫瘤細胞凋亡。實驗結果顯示,不同濃度PGPIPN聯合相同濃度DDP作用與卵巢癌細胞,單獨PGPIPN組效果不明顯,聯合用藥組的細胞抑制率高于單獨DDP組,說明PGPIPN能提高DDP對卵巢癌細胞的作用,增強卵巢癌細胞對順鉑的敏感性。
前期研究[10]顯示,PGPIPN的靶點是EEF1D(eukaryotic translation elongation factor 1 delta),是真核生物翻譯延伸因子eEF1B復合物的一個亞基,eEF1B復合物是eEF1A的轉換因子(exchange factor,GEF),可激活eEF1A上的核苷轉換,從而完成eEF1A的活力循環, EEF1D在病毒感染、細胞周期、腫瘤發生中都發揮了作用。有研究[11]顯示,EEF1D能抑制SIAH的E3泛素連接酶活性。SIAH蛋白是E3連接酶,可識別并結合底物蛋白使其由26S蛋白酶體途徑降解,Siah家族含有兩個明確的結構域:N端的RING指結構域和C端底物結合結構域,RING指結構域為E3泛素連接酶活性所需,能夠結合泛素結合酶E2,將泛素鏈連接到底物蛋白上,使底物蛋白通過蛋白酶體途徑降解。
蛋白酶體是催化泛素與蛋白底物耦聯體降解的關鍵酶,包括20S蛋白酶體和26S蛋白酶體,其中20S上的C2亞基(PSMA1)為α環中最大的亞基,結構保守,可使20S蛋白酶體活性明顯增強,蛋白降解加速。SIAH是p53依賴性的細胞生長抑制基因,SIAH的底物蛋白種類很多,在多種組織、多種信號通路、多種生命活動周期中發揮著重要作用,通過降解某些原癌基因及抗凋亡因子達到抑制腫瘤的作用,經泛素-蛋白酶體系統可降解多種蛋白,包括β-catenin。
β-catenin是一種多功能胞質蛋白,在各類卵巢癌中均有表達,是癌細胞早起增殖的重要分子,在正常成熟細胞中主要與E鈣調蛋白分子形成β-catenin/ E-鈣調蛋白復合體,均勻地分布在細胞膜上,調節細胞間的黏附,只有很少量的游離β-catenin存在于細胞內。β-catenin不僅是介導細胞之間黏附的重要蛋白,介導胞間黏附,促進腫瘤浸潤和轉移,也是wnt信號傳導途徑的重要組成部分。β-catenin是SIAH的底物蛋白之一,SIAH可與SCF(Skp-Cullin-F box)組成泛素連接酶復合體,Skp蛋白是此復合物的中心成員,可以同時結合Cullin家族蛋白Cull及F-box蛋白, SIAH不能結合此復合物,但是可以結合SIP(Siah-interacting protein)蛋白,SIP能結合Skp1,從而將SIAH帶到此復合物上,介導β-catenin的降解[12]。PCR和Western blot結果顯示,與單獨DDP組相比,聯合用藥組隨著PGPIPN濃度增加,SIAH和蛋白酶體表達量有不同程度的增加,而β-catenin的表達量降低,說明SIAH-蛋白酶體-β-catenin的信號通路可能參與了PGPIPN對卵巢癌細胞的作用過程,PGPIPN作用于EEF1D,從而解除了EEF1D對SIAH的E3泛素連接酶活性的抑制,蛋白酶體活動增強,加劇β-catenin的降解,從而逆轉卵巢癌細胞耐藥性,增加對順鉑的敏感性,但具體相關機制還需要進一步的研究。
[1] Fiat A M, Migliore-Samour D, Jollès P, et al. Biologically active peptides from milk proteins with emphasis on two examples concerning antithrombotic and immunomodulating activities[J]. J Dairy Sci, 1993, 76(1):301-10.
[2] 周 艷, 秦宜德, 董華勝, 等. Β-CM-7對MCF- 7、SKOV3和SK-N-SH腫瘤細胞增殖和凋亡的影響[J]. 安徽醫科大學學報, 2008, 43(1):5-9.
[3] 顧 芳, 秦宜德, 董華勝, 等. 乳源免疫調節肽對小鼠抗氧化和抗疲勞作用研究[J]. 營養學報, 2006, 28(4):326-8.
[4] 李素萍, 秦宜德, 董瓊珠, 等. 飼喂乳源免疫調節肽對大鼠生長和免疫的影響[J]. 安徽醫科大學學報, 2005, 40(6):499-501.
[5] 魏 彩, 秦宜德, 鄭 欣, 等. 乳源免疫調節肽體外抑制人卵巢癌細胞侵襲和轉移[J]. 中國藥理學通報, 2013, 29(1):42-8.
[6] 鄭 欣, 何曉光, 張文曉, 等. 免疫調節肽對卵巢癌SKOV3細胞凋亡及相關基因表達的影響[J]. 安徽醫科大學學報, 2012, 47(7):758-62.
[7] 周 娟, 劉 琛, 顧 芳, 趙夢靜, 等. 乳源免疫調節肽提高DDP對卵巢癌細胞的影響[J]. 安徽醫科大學學報, 2016, 51(10):1440-44.
[8] Toerres-Llanez, Mde J, Vallejo-Cordoba B, González-Córdova A F. Bioactive peptides derived from milk proteins[J]. Arch Latinoam Nutr, 2005, 55(2):111-7.
[9] Baldi A, Ioannis P, Chiara P, et al. Biological effects of milk proteins and their peptide with emphasis on those related to the gastrointestinal ecosystem[J]. J Dairy Res, 2005, 72:66-72.
[10] 李小勤, 篩選和鑒定抗卵巢癌活性六肽的靶點蛋白[D]. 合肥:安徽醫科大學,2014.
[11] Wu H, Shi Y, Lin Y, et al. Eukaryotic translation elongation factor 1 delta inhibits the ubiquitin ligase activity of SIAH-1[J]. Mol Cell Biochem, 2011, 357(1-2):209-15.
[12] Matsuzawa S, Li C, Ni C Z, et al. Structural analysis of Siah1 and its interactions with Siah-interacting protein (SIP)[J]. J Biol Chem, 2003, 278(3):1837-40.

