芍藥苷對(duì)高糖刺激的小鼠骨髓來源的巨噬細(xì)胞TLR4信號(hào)通路的影響
楊雯雯,段分分,邵云俠,王 坤, 吳永貴
隨著糖尿病發(fā)病率的上升,糖尿病腎病已成為全球終末期腎病的主要原因之一。從實(shí)驗(yàn)和臨床研究中獲得的證據(jù)表明,腎臟炎癥在糖尿病期間腎臟損傷的進(jìn)展中起關(guān)鍵作用[1]。Toll樣受體4(Toll-like receptor 4,TLR4)在糖尿病腎病中的作用機(jī)制已相當(dāng)明確,Lin et al[2]發(fā)現(xiàn)在糖尿病腎病患者的腎活檢中TLR4表達(dá)升高,與之相關(guān)的腎組織中巨噬細(xì)胞的浸潤程度也隨之增加。白芍總苷(total glucosides of paeony, TGP)是我國重要傳統(tǒng)中藥白芍根的主要成分。前期研究[3-4]表明TGP可以抑制STZ誘導(dǎo)的糖尿病腎組織巨噬細(xì)胞激活,其機(jī)制部分與抑制腎組織中巨噬細(xì)胞的TLR4及STAT3信號(hào)通路有關(guān)。TLR4可以通過髓樣分化因子 88(myeloid differentiation primary response gene 88,MyD88)依賴途徑和MyD88非依賴途徑激活下游信號(hào)通路,參與核因子-κB(nuclear factor κB,NF-κB)的活化[5]。而芍藥苷(paeoniflorin, PF)作為TGP的主要有效成分,一直深受廣泛關(guān)注。該研究旨在探討PF是否通過TLR4信號(hào)通路抑制巨噬細(xì)胞的激活,為糖尿病腎病提供新的防治思路。
1 材料與方法
1.1材料6~8周齡雄性SPF級(jí)C57BL/6J小鼠和TLR4-/-小鼠(南京大學(xué)模式動(dòng)物研究所);PF(南京廣潤公司);CCK-8檢測試劑盒(南京諾唯贊公司);兔抗TLR4、TIR結(jié)構(gòu)域銜接蛋白(TIR-domain-containing adapter-inducing interferon-β,Trif)、MyD88、誘生型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)、白細(xì)胞介素1β(interleukin-1β,IL-1β)、單核細(xì)胞趨化因子-1(monocyte chemoattractant protein 1,MCP-1)抗體(美國Abcam公司);兔抗磷酸化白介素-1受體相關(guān)激酶(phospho-IL-1 receptor-associated kinase-1,p-IRAK1)、磷酸化干擾素調(diào)節(jié)因子3(phospho-interferon regulatory factor 3,p-IRF3)、NF-κBp65、NF-κBp-p65抗體(美國Cell Signaling Technology公司);小鼠抗β-actin抗體、山羊抗兔IgG抗體、山羊抗小鼠IgG抗體(武漢三鷹公司);TNF-α、IL-1β和MCP-1 ELISA檢測試劑盒(美國R&D Systems公司);LeicaTCS SP5共聚焦掃描顯微鏡(德國Leica公司)。
1.2研究方法
1.2.1提取骨髓來源的巨噬細(xì)胞(bone marrow-derived macrophages,BMDMs)及鑒定 處死小鼠后,分離股骨和脛骨,在超凈工作臺(tái)中剪斷骨的兩端,用含有2%胎牛血清的無菌PBS溶液沖洗骨髓腔細(xì)胞,離心后棄去上清液,用配制好的DMEM培養(yǎng)基輕輕吹打重懸細(xì)胞,于37 ℃、5%CO2細(xì)胞培養(yǎng)箱中培養(yǎng);7 d后收集細(xì)胞,用巨噬細(xì)胞表面抗原F4/80和CD11b抗體標(biāo)記細(xì)胞,鑒定巨噬細(xì)胞的純度和成熟度。
1.2.2優(yōu)化實(shí)驗(yàn)條件 使用不用濃度的葡萄糖刺激BMDMs,同時(shí)不同濃度的甘露醇補(bǔ)充入各刺激組,以排除高糖產(chǎn)生的滲透壓對(duì)實(shí)驗(yàn)的影響[5]。然后收集細(xì)胞,提取總蛋白,選取TLR4和iNOS蛋白表達(dá)最高時(shí)的糖濃度,作為實(shí)驗(yàn)的刺激濃度;在確定刺激濃度后,選取不同刺激時(shí)間收集BMDMs,以確定高糖刺激的最佳時(shí)間。最后采用不同濃度的PF干預(yù)高糖刺激的BMDMs,選擇抑制蛋白表達(dá)上調(diào)的最適PF濃度。將BMDMs分為7組:正常糖對(duì)照組(LG組)、正常糖對(duì)照+PF組(LG+PF組)、高糖刺激組(HG組)、高糖刺激+PF組(HG+PF組)、TLR4-/-對(duì)照組(TLR4-/-組)、TLR4-/-對(duì)照+高糖刺激組(TLR4-/-+HG組)、TLR4-/-對(duì)照+高糖刺激+PF組(TLR4-/-+HG+PF組)。
1.2.3PF干預(yù)及高糖刺激對(duì)巨噬細(xì)胞活力的影響 將BMDMs制成細(xì)胞懸液接種于96孔板中,設(shè)無細(xì)胞組、無藥物對(duì)照組、空白對(duì)照組、不同濃度PF的高糖刺激組,24 h后每孔加入CCK-8溶液,用酶標(biāo)儀進(jìn)行光密度(optical density,OD)值測定,算出細(xì)胞活力。
1.2.4PF干預(yù)對(duì)高糖刺激的巨噬細(xì)胞遷徙能力的影響 將BMDMs接種于Transwell小室中,按照實(shí)驗(yàn)分組,每組分別加入高糖刺激和PF干預(yù),后在各組的Transwell下室中分別加入重組小鼠MCP-1培養(yǎng)后棄取上清液,Transwell上室乙醇固定20 min后,切去底部薄膜,結(jié)晶紫染色,輕輕鋪在載玻片上,顯微鏡下拍照后用PBS漂洗2次,薄膜置于33%冰醋酸中,回收結(jié)晶紫染色液,測定各組OD值后比較分析。
1.2.5實(shí)時(shí)熒光定量PCR法測定各分組細(xì)胞中的TNF-α、IL-1β、MCP-1及iNOS的mRNA的轉(zhuǎn)錄表達(dá) 提取每組BMDMs的總RNA后,立即檢測其純度,并反轉(zhuǎn)錄成cDNA。引物序列見表1。SYBR Green PCR 試劑盒被用來進(jìn)行 PCR,基因的相對(duì)GAPDH表達(dá)采用 2-ΔΔCt法分析。

表1 各引物序列
1.2.6Western blot法檢測各組巨噬細(xì)胞的蛋白表達(dá) 提取各組細(xì)胞的總蛋白后,測定濃度。加樣后經(jīng)電泳,轉(zhuǎn)膜,脫脂牛奶室溫封閉后,TBST洗膜3次,將膜放入一抗TLR4(1 ∶500)、MyD88(1 ∶100)、Trif(1 ∶1 000)、p-IRAK1(1 ∶200)、p-IRF3(1 ∶1 000)、IRF3(1 ∶1 000)、NF-κBp65(1 ∶1 000)、NF-κBp-p65(1 ∶1 000)、iNOS(1 ∶1 000)、β-actin(1 ∶35 000) 中4 ℃過夜,TBST洗膜3次,二抗室溫下孵育45 min后,再次洗膜3次,最后用ECL發(fā)光試劑盒進(jìn)行顯影,Image J軟件對(duì)條帶進(jìn)行分析。
1.2.7ELISA法檢測各組巨噬細(xì)胞的培養(yǎng)上清液中細(xì)胞因子的分泌量 實(shí)驗(yàn)結(jié)束后收集各組培養(yǎng)上清液,離心,用ELISA試劑盒檢測各組BMDMs培養(yǎng)上清液中TNF-α、IL-1β 和MCP-1的含量。
1.2.8激光共聚焦顯微鏡分析各組巨噬細(xì)胞TLR4和iNOS的協(xié)同表達(dá) 細(xì)胞接種于Petri皿中,固定10 min后,PBS漂洗3次, 每次5 min, 5%驢血清封閉0.5 h,PBS再次漂洗3次,加入抗TLR4和抗iNOS抗體,4 ℃條件下孵育過夜,PBS漂洗3次,加入相應(yīng)的熒光二抗,室溫下避光孵育2 h。再次PBS漂洗,DAPI染核10 min,PBS漂洗后進(jìn)行封片,最后用激光共聚焦顯微鏡拍照。
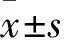
2 結(jié)果
2.1BMDMs純度及成熟度的鑒定流式細(xì)胞術(shù)鑒定結(jié)果顯示FITC及CD11b雙標(biāo)的BMDMs達(dá)93.5%。見圖1。

圖1 檢測BMDMs純度及成熟度
2.2實(shí)驗(yàn)條件的優(yōu)化Western blot檢測顯示,高糖可導(dǎo)致TLR4表達(dá)上調(diào),巨噬細(xì)胞活化;同時(shí)甘露醇作為高糖的滲透壓對(duì)照,對(duì)TLR4的表達(dá)及巨噬細(xì)胞的活化沒有影響。高糖濃度在30 mmol/L時(shí),TLR4表達(dá)增加最明顯(0.55±0.01,F=379.480,P<0.01),iNOS表達(dá)也增加最明顯(0.37±0.01,F=283.612,P<0.01);高糖刺激的BMDMs在1 h TLR4開始過量表達(dá),6 h開始巨噬細(xì)胞活化,產(chǎn)生iNOS, 與初始0 h比較:TLR4(1.1±0.002)和iNOS(0.82±0.02)均在24 h達(dá)到峰值(FTLR4=420.112,FiNOS=126.858,P<0.01);PF可以抑制TLR4表達(dá)及BMDMs的激活,并且抑制的程度與其劑量有關(guān),在PF濃度為10-5mol/L時(shí),TLR4(0.50±0.03)和iNOS(0.27±0.01)的表達(dá)抑制最為明顯(FTLR4=291.643,FiNOS=1818,P<0.01)。見圖2~4。
2.3PF干預(yù)及高糖刺激對(duì)巨噬細(xì)胞活力的影響高糖刺激對(duì)BMDMs活性無影響,PF濃度為10-3mol/L時(shí)對(duì)高糖刺激的BMDMs活性有影響(95.30±1.56,F(xiàn)=1.083,P<0.01)。見圖5。
2.4PF干預(yù)對(duì)高糖刺激巨噬細(xì)胞遷徙能力的影響高糖刺激可以增加MCP-1對(duì)巨噬細(xì)胞的趨化,導(dǎo)致巨噬細(xì)胞遷徙,而PF干預(yù)和TLR4基因敲除均可抑制高糖的刺激作用,各組間差異有統(tǒng)計(jì)學(xué)意義(F=49.39,P<0.01)。見圖6。

圖2 Western blot檢測高糖刺激BMDMs的TLR4及iNOS蛋白表達(dá)變化與正常糖濃度組(高糖5 mmol/L)比較:*P<0.05,**P<0.01

圖3 Western blot檢測高糖刺激BMDMs不同時(shí)間點(diǎn)TLR4及iNOS的蛋白表達(dá)變化與0 h比較:*P<0.05,**P<0.01

圖4 Western blot檢測不同濃度PF干預(yù)高糖刺激BMDMs對(duì)TLR4及iNOS的蛋白表達(dá)變化
A: LG組;B: HG組;C: HG+10-8mol/L組;D: HG+10-7mol/L組;E: HG+10-6mol/L組;F: HG+10-5mol/L組;G: HG+10-4mol/L組;與LG組比較:**P<0.01;與HG組比較:##P<0.01

圖5 PF對(duì)高糖刺激的BMDMs活性的影響
A: LG組;B: HG組;C: HG+10-8mol/L組;D: HG+10-7mol/L組;E: HG+10-6mol/L組;F: HG+10-5mol/L組;G: HG+10-4mol/L組;H: HG+10-3mol/L組;與HG組比較:*P<0.05
2.5實(shí)時(shí)熒光定量PCR檢測各組巨噬細(xì)胞的iNOS、TNF-α、IL-1β和MCP-1mRNA的表達(dá)與LG組比較,LG+PF組iNOS、TNF-α、IL-1β和MCP-1的mRNA的表達(dá)差異無統(tǒng)計(jì)學(xué)意義,HG組的mRNA轉(zhuǎn)錄表達(dá)明顯增加(P<0.01),正常糖濃度下敲除TLR4組的mRNA表達(dá)明顯減少(P<0.05,P<0.01);與HG組比較,PF組和TLR4-/-+HG組mRNA表達(dá)明顯下降(P<0.01);與TLR4-/-+HG組比較,敲除TLR4之后,PF仍然可以進(jìn)一步抑制高糖導(dǎo)致的mRNA轉(zhuǎn)錄表達(dá)的增加(P<0.01),各指標(biāo)組間差異有統(tǒng)計(jì)學(xué)意義(FiNOS=297.8、FTNF-α=162.8、FIL-1β=170.9、FMCP-1=102.2,P<0.01)。見圖7。
2.6Westernblot檢測各組巨噬細(xì)胞的iNOS、TLR4、MyD88、p-IRAK-1、Trif、p-IRF3、NF-κBp65和NF-κBp-p65蛋白表達(dá)與LG組比較,LG+PF組iNOS、TLR4、MyD88、p-IRAK-1、Trif、p-IRF3、NF-κBp65和NF-κBp-p65的蛋白表達(dá)差異無統(tǒng)計(jì)學(xué)意義,HG組各蛋白表達(dá)明顯上調(diào)(P<0.01),在正常糖濃度下,TLR4-/-組各蛋白的表達(dá)明顯減少;與HG組比較,PF干預(yù)組和TLR4-/-+HG組的蛋白相對(duì)表達(dá)量受到抑制(P<0.01);與TLR4-/-+HG組比較,TLR4-/-+HG+PF組在敲除TLR4基礎(chǔ)上,PF仍可以進(jìn)一步抑制高糖導(dǎo)致的各蛋白表達(dá)增加(P<0.01)。各指標(biāo)每組間差異有統(tǒng)計(jì)學(xué)意義(FTLR4=227.3、FiNOS=112.99、FMyD88=55.89、Fp-IRAK-1=16.75、FTrif=32.75、Fp-IRF3=42.11、FNF-κBp65=37.92、FNF-κBp-p65=343.9,P<0.01)。見圖8。
2.7ELISA檢測各組巨噬細(xì)胞分泌的TNF-α、IL-1β和MCP-1水平與LG組比較,LG+PF組細(xì)胞培養(yǎng)基上清中所含TNF-α、IL-1β 和MCP-1水平差異無統(tǒng)計(jì)學(xué)意義,HG組明顯增高(P<0.01),TLR4-/-明顯減少(P<0.05,P<0.01);與HG組比較,HG+PF組和HG+TLR4-/-組明顯減少(P<0.01);與HG+TLR4-/-組比較,敲除TLR4基因后,PF仍可進(jìn)一步抑制高糖刺激導(dǎo)致的培養(yǎng)基中TNF-α、IL-1β 及MCP-1分泌增加(P<0.01)。每種指標(biāo)各組間差異具有統(tǒng)計(jì)學(xué)意義(FTNF-α=29.76、FIL-1β=60.96、FMCP-1=41.65,P<0.01)。見圖9。

圖6 PF干預(yù)對(duì)高糖刺激巨噬細(xì)胞遷徙能力的影響 ×400
A: LG組;B: LG+PF組;C: HG組;D: HG+PF組;E: TLR4-/-組;F: TLR4-/-+HG組;G: TLR4-/-+HG+PF組;與LG組比較:**P<0.01;與HG組比較:##P<0.01;與TLR4-/-+HG組比較:ΔΔP<0.01

圖7 實(shí)時(shí)定量PCR檢測高糖刺激對(duì)各組巨噬細(xì)胞iNOS、TNF-α、IL-1β和MCP-1的mRNA表達(dá)
1: LG組;2: LG+PF組;3: HG組;4: HG+PF組;5: TLR4-/-組;6: TLR4-/-+HG組;7: TLR4-/-+HG+PF組;與LG組比較:**P<0.01;與HG組比較:##P<0.01;與TLR4-/-+HG組比較:ΔΔP<0.01

圖8 Western blot檢測各組巨噬細(xì)胞的蛋白表達(dá)
A:TLR4、iNOS、MyD88、p-IRAK1、Trif、p-IRF3蛋白相對(duì)表達(dá)量,B:NF-κBp65和NF-κBp-p65的蛋白相對(duì)表達(dá);1:LG組;2: LG+PF組;3: HG組;4: HG+PF組;5: TLR4-/-組;6: TLR4-/-+HG組;7: TLR4-/-+HG+PF組;與LG組比較:**P<0.01;與HG組比較:##P<0.01;與TLR4-/-+HG組比較:ΔΔP<0.01

圖9 ELISA法檢測各組巨噬細(xì)胞培養(yǎng)基中分泌的TNF-α、IL-1β 和MCP-1表達(dá)
1: LG組;2: LG+PF組;3: HG組;4: HG+PF組;5: TLR4-/-組;6: TLR4-/-+HG組;7: TLR4-/-+HG+PF組;與LG組比較:*P<0.05,**P<0.01;與HG組比較:##P<0.01;與TLR4-/-+HG組比較:ΔΔP<0.01
2.8共聚焦顯微鏡分析各組巨噬細(xì)胞TLR4和iNOS的熒光表達(dá)與LG組細(xì)胞比較,LG+PF組綠色及紅色熒光表達(dá)無差別,TLR4-/-組紅、綠熒光基本無表達(dá),HG組熒光表達(dá)增強(qiáng);與HG組比較,HG+PF組、HG+TLR4-/-組、HG+TLR4-/-+PF組熒光表達(dá)降低,提示高糖可同時(shí)激活TLR4和iNOS在巨噬細(xì)胞胞質(zhì)內(nèi)表達(dá),PF干預(yù)及TLR4基因敲除可抑制高糖的誘導(dǎo)作用。見圖10。
3 討論
糖尿病腎病與全身炎癥和局部的腎臟炎癥都有關(guān),在糖尿病腎病的早期階段血清或外周血細(xì)胞中可檢測到炎性細(xì)胞因子(如TNF-α、IL-1及MCP-1)和免疫介質(zhì)水平的升高,其中一些因子隨疾病進(jìn)展而增加[6]。本實(shí)驗(yàn)的刺激因素是高血糖,同時(shí)高血糖也是糖尿病腎病發(fā)生的先決條件,巨噬細(xì)胞是糖尿病腎臟中發(fā)現(xiàn)的最普遍的浸潤性白細(xì)胞,有研究[7-9]表明,高糖可以刺激巨噬細(xì)胞遷移,本實(shí)驗(yàn)使用MCP-1作為初始趨化因子,在高糖的刺激下,各組實(shí)驗(yàn)細(xì)胞均發(fā)生了趨化遷移,但與正常糖濃度對(duì)照組比較,高糖刺激組巨噬細(xì)胞遷移明顯增加,其增加的程度可被PF干預(yù)及TLR4信號(hào)通路敲除抑制。

圖10 共聚焦顯微鏡下各組巨噬細(xì)胞TLR4和iNOS的協(xié)同表達(dá) ×400
Toll樣受體能識(shí)別危險(xiǎn)相關(guān)分子模式的受體并促進(jìn)先天性免疫反應(yīng),可通過兩種途徑激活下游信號(hào)分子:MyD88依賴途徑和MyD88非依賴途徑。這兩種途徑均可參與由TLR4激活的通路從而產(chǎn)生炎癥因子[10-11]。在未刺激的細(xì)胞中,NF-κB游離存在于胞質(zhì)中;一旦受到刺激,NF-κB便移位于細(xì)胞核中并促進(jìn)多種炎癥因子,如TNFα、IL-1β及MCP-1的釋放[12]。在本實(shí)驗(yàn)中,高糖作為刺激因素,模擬了糖尿病的微環(huán)境,結(jié)果提示,在高糖刺激下,TLR4與高糖結(jié)合,作為內(nèi)源性配體,激活下游的依賴MyD88信號(hào)途徑和非依賴MyD88信號(hào)途徑,使TLR4、MyD88、p-IRAK-1、Trif、p-IRF3、NF-κBp65及NF-κBp-p65表達(dá)均上調(diào),與此同時(shí)啟動(dòng)巨噬細(xì)胞的活化;表現(xiàn)為巨噬細(xì)胞活化產(chǎn)物iNOS,TNF-α、IL-1β及MCP-1的mRNA表達(dá)明顯上升,同時(shí)細(xì)胞的培養(yǎng)上清液中TNF-α、IL-1β及MCP-1水平也顯著升高。通過激光共聚焦顯微鏡中也可以看出高糖可以增加TLR4及iNOS的熒光強(qiáng)度,敲除TLR4基因后可以同時(shí)使iNOS熒光強(qiáng)度減弱,這提示TLR4及其下游的兩種信號(hào)通路可調(diào)節(jié)巨噬細(xì)胞激活。
PF作為TGP的主要生物活性成分,近幾年在臨床越來越多地被用來治療類風(fēng)濕性關(guān)節(jié)炎、系統(tǒng)性紅斑狼瘡和系膜增生性腎炎等疾病[13-15],PF的藥理作用可能與抗炎、抗氧化和免疫調(diào)節(jié)有關(guān),但是PF對(duì)腎臟保護(hù)作用的具體信號(hào)通路機(jī)制仍然是不明確的。本實(shí)驗(yàn)室前期的研究[4]證實(shí)了TGP可抑制腎小球和腎小管-間質(zhì)巨噬細(xì)胞TLR4的表達(dá),在本實(shí)驗(yàn)中,可以觀察到PF對(duì)體外高糖刺激的BMDMs激活起到抑制作用,可減少炎癥因子TNF-α、IL-1β、MCP-1及巨噬細(xì)胞表面活化標(biāo)志物iNOS的產(chǎn)生;這些證實(shí)了PF具有抗炎作用;同時(shí)觀察到PF對(duì)正常糖濃度下的BMDMs及TLR4信號(hào)通路無影響,但是對(duì)高糖刺激下的BMDMs的TLR4及其下游信號(hào)通路有抑制作用,由此可以推測,PF是通過抑制高糖刺激下TLR4信號(hào)通路的上調(diào)而調(diào)節(jié)巨噬細(xì)胞活化的。另外,還可以觀察到,在敲除TLR4基因后,繼續(xù)給予PF干預(yù),仍然可以進(jìn)一步抑制BMDMs的激活,TNF-α、IL-1β、MCP-1及iNOS的產(chǎn)生也進(jìn)一步減少,MyD88、p-IRAK-1、Trif、p-IRF3、NF-κBp65和NF-κBp-p65表達(dá)減弱,由此可以推測PF對(duì)巨噬細(xì)胞激活的抑制作用可能還與其他的信號(hào)通路有關(guān),其具體的機(jī)制有待進(jìn)一步研究。
綜上所述,高糖刺激可以導(dǎo)致巨噬細(xì)胞的TLR4信號(hào)通路激活,同時(shí)啟動(dòng)巨噬細(xì)胞活化,PF可以通過抑制巨噬細(xì)胞TLR4信號(hào)通路的上調(diào)從而調(diào)節(jié)巨噬細(xì)胞的活化,但是PF的抑制作用是否同時(shí)與其他信號(hào)通路有關(guān)還需深入研究。
[1] Tesch G H. Diabetic nephropathy is this an immune disorder?[J].Clin Sci(Lond),2017,131(16):2183-99.
[2] Lin M, Yiu W H, Wu H J, et al. Toll-like receptor 4 promotes tubular inflammation in diabetic nephropathy[J]. J Am Soc Nephrol, 2012, 23(1):86-102.
[3] Wang K, Wu Y G, Su J, et al. Total glucosides of paeony regulates JAK2/STAT3 activation and macrophage proliferation in diabetic rat kidneys[J]. Am J Chi Med, 2012, 40(3):521-36.
[4] 趙 莉, 蘇雙全,夏 林. 白芍總苷對(duì)糖尿病大鼠腎組織TLR2、TLR4/NF-κB信號(hào)通路調(diào)節(jié)的影響[J]. 安徽醫(yī)科大學(xué)學(xué)報(bào),2012, 47(5): 518-22.
[5] Cheng C I, Chen P H, Lin Y C. High glucose activates Raw2647 macrophages through RhoA kinase-mediated signaling pathway[J]. Cell Signal, 2015, 27(2):283-92.
[6] Perlman A S, Chevalier J M, Wilkinson P, et al. Serum inflammatory and immune mediators are elevated in early stage diabetic nephropathy[J]. Ann Clin Lab Sci, 2015, 45(3):256-63.
[7] Cheng C I, Chen P H, Lin Y C. High glucose activates Raw2647 macrophages through RhoA kinase-mediated signaling pathway[J]. Cell Signal, 2015, 27(2):283-92.
[8] Sato W, Kosugi T, Zhang L, et al. The pivotal role of VEGF on glomerular macrophage infiltration in advanced diabetic nephropathy[J]. Lab Invest, 2008, 88(9):949-61.
[9] Xu X, Qi X, Shao Y, et al. Blockade of TGF-β-activated kinase 1 prevents advanced glycation end products-induced inflammatory response in macrophages[J]. Cytokine,2016,78: 62-8.
[10] Akira S. Toll-like receptor signalling[J]. Nat Rev Immunol, 2004, 4(7):499-511.
[11] Medzhitov R. Toll-like receptors and innate immunity[J].Nat Rev Immunol, 2001, 1(2): 135-45.
[12] Mendes K L,Lelis D F.Nuclear sirtuins and inflammatory signaling pathways[J]. Cytokine Growth Factor Rev, 2017, 38: 98-105.
[13] Li P P, Liu D D, Liu Y J, et al. BAFF/BAFF-R involved in antibodies production of rats with collagen-induced arthritisviaPI3K-Akt-mTOR signaling and the regulation of paeoniflorin[J]. J Ethnopharmacol, 2012, 141(1):290-300.
[14] Wang Y N, Zhang Y, Wang Y, et al. The beneficial effect of total glucosides of paeony on psoriatic arthritis links to circulating Tregs and Th1 cell function[J]. Phytother Res, 2014, 28(3):372-81.
[15] Yun B R, Weon J B, Lee J, et al. Simultaneous determination of 11 bioactive compounds in Jaeumganghwa-tang by high performance liquid chromatographydiode array detection[J]. Pharmacogn Mag, 2014, 10(Suppl 2):S256-63.

