miR-7在口腔鱗狀細胞癌中的表達及潛在臨床意義
裴 浩,黃瑩瑩,李海朋,芮 航,夏冬景
微小RNA(microRNA)是一類長度在18-22nt左右的單鏈非編碼核苷酸序列,其主要功能之一是參與調控編碼mRNA的翻譯及降解[1]。研究報道,在多種腫瘤組織中存在miRNA的表達異常,近年來關于其直接參與調控腫瘤發生發展的研究也得到充分認定[2]。既往研究[3-4]表明,在口腔鱗狀細胞癌(oral squamous cell carcinoma,OSCC)中也存在大量miRNAs的表達異常,多種miRNAs被證實直接參與調控OSCC的發生發展過程。miR-7作為常見的miRNAs之一,已被證實參與調控胃腸道腫瘤及乳腺癌的發生發展過程[5-6],然后在OSCC中的角色及具體機制仍不明確。現通過分析miR-7在OSCC中的表達及與上皮間質轉化的關系,以期明確miR-7在OSCC中的角色及潛在臨床意義。
1 材料與方法
1.1病例資料收集2015年8月~2016年12月來河南南陽醫學高等專科學校第一附屬醫院口腔科就診并確診為OSCC患者53例作為癌癥組,均為原發病灶,尚未接受任何其他治療措施。獲取健康口腔黏膜組織標本27例作為對照組。所有標本獲取前均獲得患者知情同意,并通過醫院倫理委員會批準。SCC9細胞株來自中國科學院上海細胞所,由河南南陽醫學高等專科學校第一附屬醫院中心實驗室惠贈。
1.2實驗方法
1.2.1實時熒光定量PCR(qRT-PCR) 利用TRIzol(美國Roche公司)對組織或細胞中的總RNA進行抽提。利用逆轉錄試劑盒(大連寶生物工程有限公司)對提取的RNA進行逆轉錄獲取cDNA。然后利用PCR試劑盒(大連寶生物工程有限公司)對cDNA進行PCR擴增,引物序列詳見表1。反應條件為:93 ℃ 2 min, 93 ℃ 1 min,55 ℃ 2 min,共40個循環。每個樣本設置3個復孔,U6作為miR-7的內參基因,GAPDH作為Fibronectin 和E-cadherin的內參基因,計算每個樣本的2-ΔΔCt值。

表1 引物序列
1.2.2Western blot 離心收集培養中的SCC9細胞,利用RIPA 裂解液(上海碧云天生物技術有限公司)裂解細胞獲取細胞總蛋白,并及時保存于-80 ℃冰箱。利用BCA試劑盒(上海碧云天生物技術有限公司)測定樣品蛋白濃度。蛋白電泳前調整蛋白量保持一致。利用10%凝膠電泳進行蛋白分離,采用PVDF膜(Millipore公司)進行轉膜。5%脫脂奶粉室溫封閉,分別加入1 ∶1 000稀釋的Rabbit anti human GAPDH(美國Cell Signaling Technology公司)、Rabbit anti human Fibronectin(美國Cell Signaling Technology公司)和Rabbit anti human E-cadherin(英國Abcam公司),4 ℃搖床過夜,PBST洗膜3~5次,分別加入1 ∶3 000的Goat anti rabbit-HRP(美國Cell Signaling Technology公司)室溫孵育2 h,PBST洗滌3~5次,ECL曝光,并利用Image J計數各組的灰度值。
1.2.3細胞質粒轉染實驗 收集培養中的SCC9細胞,用50 μl Opti-MEM稀釋0.8 μg含miR-7(miR-7過表達組)或對照Vector的質粒DNA(陰性對照組) (Invitrogen, Carlsbad, CA),同時設等體積不含任何質粒DNA的Opti-MEM稀釋液作為對照(空白對照組),輕輕吹吸3~5次混勻,室溫靜置5 min。輕輕顛倒混勻轉染試劑,用50 μl Opti-MEM 稀釋2.0 μl Lipofectamine TM2000 (Invitrogen, Carlsbad, CA),輕輕吹吸3~5次混勻,室溫靜置5 min。混合轉染試劑和質粒DNA稀釋液,輕輕吹吸 3~5次混勻,室溫靜置20 min。轉染復合物以每孔100 μl的劑量加入到24孔細胞板中,前后輕搖細胞板混合均勻。將細胞板置于500 μg/ ml G418 培養基中,37 ℃、5% CO2培養箱中培養,當細胞達到90%以上匯合率時將細胞轉移至培養瓶中繼續培養。根據細胞生長狀況及時進行換液,直到穩定表達轉染質粒的細胞達到一定數量后收集樣品進行后續實驗。
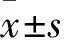
2 結果
2.1miR-7在OSCC腫瘤組織及健康組織中的表達熒光定量PCR結果顯示:相較于健康組織,miR-7在OSCC腫瘤組織中的表達水平顯著降低(t=21.91,P<0.000 1),見圖1。

圖1 miR-7在OSCC腫瘤組織及健康組織中的表達
2.2miR-7與OSCC臨床病理特征的關系miR-7在OSCC腫瘤組織中的表達與性別、年齡、腫瘤大小、腫瘤部位等因素無關,而與轉移情況有關,具體表現為:miR-7在轉移性OSCC患者中的表達顯著低于非轉移性患者(P<0.01)。見表2。
2.3miR-7與OSCC上皮間質轉化的相關性以上結果表明miR-7的表達與OSCC有無轉移高度有關。為了明確miR-7是否與OSCC上皮間質轉化過程有關,本研究檢測了53例OSCC腫瘤組織及27例正常健康組織中miR-7及上皮標志基因E-cadherin和間質標志基因Fibronectin的表達情況。Pearson相關分析顯示,在OSCC組織中,miR-7與E-cadherin的表達呈顯著正相關(r=0.752 0,P<0.001);而與Fibronectin的表達呈顯著負相關(r=-0.793 2,P<0.001),而在正常組織中的表達無明顯相關性,見圖2。

表2 miR-7與OSCC臨床病理特征的關系

圖2 miR-7與上皮間質轉化的相關性
A:27例正常健康組織中miR-7和E-cadherin表達的相關性分析;B:27例正常健康組織中miR-7和Fibronectin表達的相關性分析;C:53例OSCC腫瘤組織中miR-7和E-cadherin表達的相關性分析;D:53例OSCC腫瘤組織中miR-7和Fibronectin表達的相關性分析
2.4miR-7對SCC9細胞E-cadherin和Fibronectin基因表達的影響通過質粒轉染構建過表達miR-7的SCC9細胞。結果顯示,相比于對照組細胞,轉染后的SCC9細胞miR-7相對表達量顯著增強,E-cadherin的mRNA水平顯著升高(t=3.42),Fibronectin的mRNA水平顯著下降(t=2.13),見圖3。

圖3 過表達miR-7 對OSCC上皮間質轉化過程的影響
A:空白對照組,陰性對照組及miR-7過表達組SCC9細胞中miR-7的表達;B:空白對照組及miR-7過表達組SCC9細胞中E-cadherin和Fibronectin的mRNA表達水平;1:空白對照組;2:陰性對照組;3:miR-7過表達組;與空白對照組比較:**P<0.01
2.5miR-7對SCC9細胞E-cadherin和Fibronectin蛋白表達的影響Western blot結果顯示,相比于空白對照組細胞,過表達miR-7的SCC9細胞的E-cadherin蛋白表達水平顯著升高(t=1.41),而Fibronectin蛋白表達水平顯著降低(t=0.84),見圖4。以上結果進一步證實miR-7在OSCC上皮間質轉化過程中的調控作用。

圖4 miR-7 對SCC9細胞E-cadherin
A:空白對照組及miR-7過表達組SCC9細胞中E-cadherin和Fibronectin的蛋白表達水平;B:灰度值統計圖,數據來源于3次獨立實驗;1:空白對照組;2:miR-7過表達組;與空白對照組比較:**P<0.01,***P<0.001
3 討論
OSCC是威脅人類健康的常見頭頸部腫瘤之一,因其具有侵襲性及轉移性特征導致其總體生存率較差[7]。通過對OSCC組織標本進行miRNA微矩陣芯片分析發現,有大量的miRNA較正常組織存在差異化表達,既存在高表達miRNA又有低表達miRNA[8-9]。因其差異化表達的特異性及靈敏性,近來來基于其作為診斷及治療OSCC的生物學指標技術的研究也得到一定的發展[10]。同時,深入研究顯示,miRNA雖不能編碼蛋白質,但其可直接參與調控腫瘤相關蛋白質的合成及降解,因此在腫瘤的治療及預防中也發揮重要的作用[11]。本研究顯示miR-7在OSCC中存在明顯低表達,且相比于非轉移性患者,其在轉移性OSCC患者中的表達顯著降低,提示其可能參與OSCC的惡化轉化進程。近年來研究[12]顯示,上皮間質轉化在OSCC腫瘤細胞侵襲及遠處轉移過程中發揮重要作用。在上皮間質轉化過程中,腫瘤細胞間緊密連接被破壞,細胞極性消失,細胞骨架重塑;進而上皮標志物蛋白E-cadherin表達下降,細胞緊密連接蛋白相關蛋白claudin 1表達下降;同時腫瘤細胞開始表達間質標志物Vimentin、Fibronectin和α-SMA等[13]。因此腫瘤細胞獲得了向鄰近正常組織侵襲的能力,同時也通過血液和淋巴途徑向遠處轉移。發生上皮間質轉化的患者腫瘤組織常與其侵襲及轉移性有顯著相關性[14]。本研究顯示miR-7在轉移性OSCC中的表達較非轉移性顯著降低,而其表達與E-cadherin的表達呈顯著正相關,而與Fibronectin的表達呈顯著負相關,也間接印證了OSCC中Fibronectin表達增加,而E-cadherin表達下降與腫瘤轉移的相關性[9]。同時發現,miR-7與上皮間質轉化的相關性,因此認為正常生理水平的miR-7對維持口腔上皮細胞正常形態,阻止其向腫瘤轉化具有重要意義。同時提示提高體內miR-7水平可在一定程度上抑制OSCC的上皮間質轉化,進而降低腫瘤的侵襲及轉移率,增加患者的生存率。未來,miR-7能否作為臨床上可靠的診斷及治療OSCC的指標仍需進一步研究,同時miR-7如何調控OSCC進展的分子機制仍需進一步探索。
綜上,本研究表明在OSCC中存在miR-7的明顯低表達,且與OSCC上皮間質轉化過程高度相關,提示miR-7在OSCC發生發展過程中起重要作用,可作為診斷及治療OSCC的潛在生物學指標。
[1] Tran N, Hutvagner G. Biogenesis and the regulation of the maturation of miRNAs[J]. Essays Biochem, 2013, 54:17-28.
[2] Schwarzenbach H. The clinical relevance of circulating, exosomal miRNAs as biomarkers for cancer[J]. Expert Rev Mol Diagn, 2015, 15(9):1159-69.
[3] Radhika T, Jeddy N, Nithya S, et al. Salivary biomarkers in oral squamous cell carcinoma- An insight[J]. J Oral Biol Craniofac Res, 2016, 6 (Suppl 1):S51-4.
[4] Manikandan M, Deva Magendhra Rao A K, Arunkumar G, et al. Oral squamous cell carcinoma: microRNA expression profiling and integrative analyses for elucidation of tumourigenesis mechanism[J]. Mol Cancer, 2016, 15:28.
[5] Shi Y, Luo X, Li P, et al. miR-7-5p suppresses cell proliferation and induces apoptosis of breast cancer cells mainly by targeting REGγ[J]. Cancer Lett, 2015, 358(1):27-36.
[6] Xie J, Chen M, Zhou J, et al. miR-7 inhibits the invasion and metastasis of gastric cancer cells by suppressing epidermal growth factor receptor expression[J]. Oncol Rep, 2014, 31(4):1715-22.
[7] Jemal A, Bray F, Center M M, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(1):69-90.
[8] Yan Y, Wang X, Ven? M T, et al. Circulating miRNAs as biomarkers for oral squamous cell carcinoma recurrence in operated patients[J]. Oncotarget, 2017, 8(5):8206-14.
[9] Troiano G, Boldrup L, Ardito F, et al. Circulating miRNAs from blood, plasma or serum as promising clinical biomarkers in oral squamous cell carcinoma: A systematic review of current findings[J]. Oral Oncol, 2016, 63(6):30-7.
[10] Zhou Y, Kolokythas A, Schwartz J L, et al. microRNA from brush biopsy to characterize oral squamous cell carcinoma epithelium[J]. Cancer Med, 2017, 6(1):67-78.
[11] Wang H. Predicting cancer-related MiRNAs using expression profiles in tumor tissue[J]. Curr Pharm Biotechnol, 2014, 15(5):438-44.
[12] Natarajan J, Chandrashekar C, Radhakrishnan R, et al. Critical biomarkers of epithelial-mesenchymal transition in the head and neck cancers[J]. J Cancer Res Ther, 2014, 10(5):512-8.
[13] Puisieux A, Brabletz T, Caramel J. Oncogenic roles of EMT-inducing transcription factors[J]. Nat Cell Biol, 2014, 16(3):488-94.
[14] G?ppel J, M?ckelmann N, Münscher A, et al. Expression of epithelial-mesenchymal transition regulating transcription factors in head and neck squamous cell carcinoma[J]. Anticancer Res, 2017, 37(10):5435-40.

