BTG1在胃癌中的表達及其臨床意義
曾憲清,吳勤祥,張曉勇,李好朝
胃癌是常見的消化道惡性腫瘤之一,以其高發(fā)病率和高死亡率為主要特征,是造成人類死亡的腫瘤類型之一[1]。胃癌的發(fā)病與地域環(huán)境及飲食生活因素有關(guān),同時還伴有基因及蛋白層面的變化[2-3]。B細胞異位基因1(B cell translocation gene 1, BTG1)蛋白是BTG/Tob蛋白家族成員之一,其主要功能是參與調(diào)控細胞周期的進展[4]。最近研究[5-6]表明,BTG/Tob作為抑癌基因p53的下游基因參與調(diào)控腫瘤細胞的惡性轉(zhuǎn)化過程,且在多種腫瘤細胞中存在低表達現(xiàn)象, 表明BTG/Tob蛋白家族成員在腫瘤的發(fā)生發(fā)展中起重要調(diào)控作用。然而, BTG1在胃癌中的角色仍不明確。現(xiàn)將通過研究BTG1在胃癌中的表達變化,分析其與胃癌臨床病理特征及發(fā)生發(fā)展預(yù)后之間的關(guān)系,明確BTG1在胃癌中的角色,探索其在胃癌診斷及治療方面的臨床價值。
1 材料與方法
1.1病例資料收集2016年1月~2017年5月期間來本院普外科就診并確診為胃癌且行胃癌切除術(shù)治療的46例患者。通過胃癌切除獲得的胃癌組織標本及正常癌旁組織標本及時冷凍,以備后續(xù)實驗。46例胃癌患者的臨床病理性資料見表1。同期收集在行胃活組織檢測過程中的正常健康胃黏膜組織標本31例,所有標本獲取前均獲得患者知情同意,并通過醫(yī)院倫理委員會批準。
1.2實驗方法
1.2.1實時熒光定量PCR 利用TRIzol試劑盒(美國Roche公司)對組織或細胞中的總RNA進行抽提。利用逆轉(zhuǎn)錄試劑盒(大連寶生物工程有限公司)對提取的RNA進行逆轉(zhuǎn)錄獲取cDNA。然后利用PCR試劑盒(大連寶生物工程有限公司)對cDNA進行PCR擴增。反應(yīng)條件為:93 ℃ 2 min, 93 ℃ 1 min,55 ℃ 2 min,共40個循環(huán)。每個樣本設(shè)計3個復(fù)孔,計算每個樣本的2-ΔΔCt值,并計算BTG1相對于內(nèi)參GAPDH的表達水平。引物序列如下,GAPDH上游:5′-GATTCCACCCATGGCAAATTC-3′,下游:5′-AGCATCGCCCCACTTGATT-3′;BTG1 上游:5′-GCCTATTGTCTATATTGTTATT-3′, 下游: 5′-GCTTCTTGAACGGCACAATA-3′;E-cadherin上游:5′-ACTGGGTCCTTAAGCTCG-3′,下游:5′-TTG GGTCTTGCACTAAGA-3′;Fibronectin 上游:5′-CACC ATCAGCCCGCAGCTAT-3′,下游:5′-ATTCTCAGCT ACGGCACATGTT-3′。
1.2.2免疫組織化學 獲取的新鮮組織及時進行石蠟包埋,將包埋好的石蠟組織制作石蠟切片,利用二甲苯和不同濃度的乙醇進行脫離修復(fù)后,5% BSA封片20 min,去除多余液體,滴加1 ∶1 000抗BTG1的一抗(碧云天生物科技有限公司),4 ℃過夜,PBS洗滌3次,滴加二抗, 37 ℃孵育30 min,PBS洗滌后滴加SABC 37 ℃孵育30 min,PBS洗滌3次后滴加DAB顯色液,室溫5 min,中性樹脂封片,然后鏡檢。隨機選取5個不同的鏡下視野,計數(shù)每個視野下的陽性細胞數(shù),求取5個視野下陽性細胞數(shù)的平均值進行組間比較。
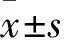
2 結(jié)果
2.1BTG1與胃癌臨床病理特征之間的關(guān)系通過分析46例胃癌患者的臨床病理特征,結(jié)果顯示BTG1的表達與患者性別、年齡、腫瘤大小和組織學分型等無明顯關(guān)系;但與TNM分型有關(guān),發(fā)生遠處轉(zhuǎn)移(Ⅳ期)的胃癌組織BTG1較未發(fā)生轉(zhuǎn)移(Ⅰ期)的胃癌組織表達水平下降,差異有統(tǒng)計學意義(P<0.01),見表1。
2.2BTG1mRNA在胃癌組織及正常組織中的表達水平通過分析胃癌組織、正常癌旁組織及正常健康胃黏膜組織中BTG1mRNA水平,結(jié)果顯示:BTG1在胃癌組織中的表達水平顯著低于正常癌旁組織和正常健康胃黏膜組織,差異有統(tǒng)計學意義(P<0.01,F(xiàn)=8.82),見圖1。
2.3BTG1蛋白在胃癌組織及正常組織中的表達水平通過免疫組織化學技術(shù)進一步分析腫瘤組織和正常組織中的BTG1蛋白表達水平,發(fā)現(xiàn)胃癌組織中的BTG1表達陽性的細胞比例較正常癌旁組織和健康胃黏膜組織顯著降低,見圖2。
2.4BTG1與上皮間質(zhì)轉(zhuǎn)化之間的關(guān)系通過分析胃癌組織標本BTG1及上皮標志E-cadherin和間質(zhì)標志Fibronectin的表達,結(jié)果顯示,BTG1與E-cadherin的表達呈顯著正相關(guān);而與Fibronectin的表達呈顯著負相關(guān),見圖3。

表1 BTG1的表達與胃癌臨床病理特征的關(guān)系

圖1 BTG1 mRNA在胃癌組織及正常組織中的表達

圖2 胃癌組織及正常組織中BTG1蛋白表免疫組織化學染色 DAB×200

圖3 胃癌組織中BTG1與上皮間質(zhì)轉(zhuǎn)化之間的關(guān)系
2.5BTG1表達與胃癌患者術(shù)后生存率的關(guān)系在46例胃癌患者中,相對低表達的23例患者BTG1水平為(0.41±0.16),相對高表達的23例患者的BTG1水平為(0.66±0.14),二者之間BTG1表達水平差異有統(tǒng)計學意義(P<0.05),見圖4。 Kaplan-Meier生存分析結(jié)果顯示,相對低表達組的23例患者的術(shù)后5年總體生存率較相對高表達組23例患者呈現(xiàn)顯著下降趨勢,差異有統(tǒng)計學意義(P<0.05),見圖4。利用單變量分析和多變量分析進一步研究BTG1的表達和臨床病理特征對胃癌患者術(shù)后5年總體生存率的影響。單變量Cox回歸分析結(jié)果顯示胃癌患者性別、年齡、腫瘤大小、組織分型對總體生存率無明顯影響,而BTG1的表達和TNM分期對總體生存率有顯著影響;多變量Cox回歸分析表明BTG1的表達可作為潛在的胃癌生物學指標,見表2。

圖4 BTG1表達與胃癌患者生存率的關(guān)系
3 討論
胃癌主要起源于胃黏膜淺表層的胃腺,因此也常被稱為胃腺癌,占據(jù)所有胃癌類型中的90%以上[7]。胃癌是一類多因素疾病,既存在環(huán)境因素影響,也受到基因?qū)用娴挠绊慬8]。研究[9-10]表明,在胃癌形成過程中多伴隨基因及蛋白表達方面的改變,例如PTEN蛋白和PI3K/Akt等被證明參與胃癌的形成過程。因此,深入研究其分子調(diào)控機制,有助于促進胃癌診斷及治療新手段的開發(fā)。本研究顯示,BTG1蛋白在胃癌組織中存在異常低表達,且與胃癌的惡性轉(zhuǎn)化及術(shù)后總體生存率有關(guān),進一步認識了胃癌發(fā)生發(fā)展分子機制。

表2 胃癌患者5年總體生存率的單變量和多變量分析
TNM分期中Ⅰ+Ⅱ與Ⅲ+Ⅳ比較:**P<0.01;BTG1水平中低表達組與高表達組比較:***P<0.001
BTG1可作為抑癌因子參與調(diào)控腫瘤細胞的增殖與凋亡過程。通過外源性激發(fā)BTG1的活化可促進人乳腺癌細胞MCF7發(fā)生細胞凋亡[11]。同時在前列腺癌乳腺癌中,存在BTG1的缺失和低表達現(xiàn)象[12-13]。缺失BTG1可促進腫瘤的產(chǎn)生和發(fā)展過程,預(yù)示其潛在的抗腫瘤作用。本研究結(jié)果顯示在胃癌中存在BTG1的異常低表達,且胃癌標本BTG1的表達水平越低其上皮間質(zhì)轉(zhuǎn)化過程越明顯,提示其可能參與胃癌的惡化進展過程。同時分析患者術(shù)后5年總體生存率發(fā)現(xiàn),BTG1的低表達預(yù)示著更差的生存率,進一步表明BTG1在胃癌的發(fā)生發(fā)展過程中的關(guān)鍵作用。
[1] Karimi P, Islami F, Anandasabapathy S, et al. Gastric cancer: descriptive epidemiology, risk factors, screening, and prevention[J]. Cancer Epidemiol Biomarkers Prev, 2014, 23(5):700-13.
[2] Yoon H, Kim N. Diagnosis and management of high risk group for gastric cancer[J]. Gut Liver, 2015, 9(1):5-17.
[3] Yoon J H, Choi W S, Kim O, et al. Gastrokine 1 inhibits gastric cancer cell migration and invasion by downregulating RhoA expression[J]. Gastric Cancer, 2017, 20(2):274-85.
[4] Mao B, Zhang Z, Wang G. BTG2: a rising star of tumor suppressors[J]. Int J Oncol, 2015, 46(2):459-64.
[5] Doidge R, Mittal S, Aslam A, et al. The anti-proliferative activity of BTG/TOB proteins is mediatedviathe Caf1a (CNOT7) and Caf1b (CNOT8) deadenylase subunits of the Ccr4-not complex[J]. PLoS One, 2012, 7(12):e51331.
[6] Boiko A D, Porteous S, Razorenova O V, et al. A systematic search for downstream mediators of tumor suppressor function of p53 reveals a major role of BTG2 in suppression of Ras-induced transformation[J]. Genes Dev, 2006, 20(2):236-52.
[7] Hamashima C. Current issues and future perspectives of gastric cancer screening[J]. World J Gastroenterol, 2014, 20(38):13767-74.
[8] Yoon H, Kim N. Diagnosis and management of high risk group for gastric cancer[J]. Gut Liver, 2015, 9(1):5-17.
[9] Niccolai E, Taddei A, Prisco D, et al. Gastric cancer and the epoch of immunotherapy approaches [J]. World J Gastroenterol, 2015, 21(19):5778-93.
[10] Sasaki T, Kuniyasu H. Significance of AKT in gastric cancer[J]. Int J Oncol, 2014, 45(6):2187-92.
[11] Xu W T, Yang Z, Lu N H. Roles of PTEN (phosphatase and tensin homolog) in gastric cancer development and progression[J]. Asian Pac J Cancer Prev, 2014, 15(1):17-24.
[12] Zhu R, Zou S T, Wan J M, et al. BTG1 inhibits breast cancer cell growth through induction of cell cycle arrest and apoptosis[J]. Oncol Rep, 2013, 30(5):2137-44.
[13] Lu K, Liu C, Tao T, et al. MicroRNA-19a regulates proliferation and apoptosis of castration-resistant prostate cancer cells by targeting BTG1[J]. FEBS Lett, 2015, 589(13):1485-90.

