克羅恩病患者Hcy、sTM及PC水平改變的臨床觀察
劉 偉,王 晶,丁少楨,胡 翠,劉曉昌,梅 俏,許建明
克羅恩病(Crohn’s disease,CD)是一種累及消化道全層的節(jié)段性的非特異性肉芽腫性炎癥性疾病,目前病因及發(fā)病機(jī)制尚不完全明確,研究[1]顯示CD患者腸黏膜具有微血管閉塞的病理表現(xiàn),可能與存在微血管功能不全的病理生理機(jī)制有關(guān),CD患者胃腸道病變中具有微血管受累的特征,同時(shí)研究[2]表明CD患者具有高凝狀態(tài)改變,易并發(fā)血栓栓塞風(fēng)險(xiǎn),血栓栓塞癥的發(fā)病率介于1%~6.7%[3]。CD高凝狀態(tài)在于炎癥對凝血系統(tǒng)的影響使止血平衡機(jī)制破壞,血液的凝固系統(tǒng)被激活,導(dǎo)致了血栓栓塞性疾病。研究[4]表明,同型半胱氨酸(homocysteine,Hcy)能夠抑制血管內(nèi)皮細(xì)胞介導(dǎo)的幾種不同的抗凝血機(jī)制,包括抑制內(nèi)皮細(xì)胞表面血栓調(diào)節(jié)蛋白的表達(dá)和活性,能夠激活炎癥反應(yīng)的重要調(diào)節(jié)因子,損傷血管內(nèi)皮細(xì)胞,進(jìn)一步影響凝血纖溶的動態(tài)平衡,導(dǎo)致血液的高凝狀態(tài)。血栓調(diào)節(jié)蛋白(soluble thrombomodulin,sTM)與蛋白C(protein C,PC)是抗凝途徑之一的蛋白C途徑的重要組成。該研究通過檢測CD患者中血漿Hcy、sTM和PC水平,并進(jìn)行臨床關(guān)聯(lián)分析,探討CD患者中Hcy和蛋白C途徑相關(guān)因素的改變,為臨床預(yù)防CD患者血栓前狀態(tài)提供實(shí)驗(yàn)依據(jù)。
1 材料與方法
1.1病例資料2015年8月~2016年5月在安徽醫(yī)科大學(xué)第一附屬醫(yī)院消化內(nèi)科住院的74例CD患者,男42例,女32例,年齡13~59(36.50±11.96)歲,按臨床癥狀、內(nèi)鏡表現(xiàn)、放射學(xué)及組織學(xué)特征進(jìn)行診斷,診斷標(biāo)準(zhǔn)參考2012年我國炎癥性腸病共識意見[5]。對照組為30例健康體檢者,男17例,女13例,年齡13~60(38.06±11.24)歲。排除肝硬化、妊娠、既往血栓史、糖尿病、腎功能不全、癌癥及近3個(gè)月服用避孕藥、抗凝藥、皮質(zhì)激素者。兩組年齡、性別差異均無統(tǒng)計(jì)學(xué)意義。
1.2檢測方法抽取清晨靜脈血,離心(3 000 r/min、10 min),取血漿,-80 ℃保存。Hcy、sTM及PC水平采用ELISA法檢測,檢測方法按試劑盒說明書進(jìn)行。
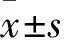
2 結(jié)果
2.1CD患者血漿中Hcy、sTM及PC水平與對照組比較,CD患者血漿中Hcy、sTM水平升高,差異有統(tǒng)計(jì)學(xué)意義(F=19.72、18.60,P<0.05),PC水平接近于正常對照組,差異無統(tǒng)計(jì)學(xué)意義(F=0.16,P=0.89)。Hcy顯著升高提示CD患者具有血栓前狀態(tài)的高危因素,sTM顯著升高提示CD患者血漿中蛋白C途徑處于失衡狀態(tài)。見表1。
2.2CD患者中Hcy、sTM及PC水平的改變與臨床特征的關(guān)聯(lián)分析按CD不同病變的疾病行為分為狹窄型組34例,穿透型組12例,非狹窄非穿透組28例,結(jié)果顯示,非狹窄非穿透型組PC水平高于狹窄型組(9.55±2.76vs7.20±2.83,F(xiàn)=8.9,P<0.05),Hcy和sTM水平比較差異無統(tǒng)計(jì)學(xué)意義。按CD不同病變范圍分為回腸末端組36例,回腸組10例,回結(jié)腸組20例,上消化道組8例,3組CD患者中Hcy、sTM及PC水平比較差異均無統(tǒng)計(jì)學(xué)意義。按CD患者發(fā)病年齡分為≤16歲組6例,17~40歲組41例,年齡>40歲組27例,3組CD患者中Hcy、sTM及PC水平比較差異無統(tǒng)計(jì)學(xué)意義。見表2。

表1 CD患者中sTM、Hcy、PC水平的改變
與對照組比較:*P<0.05

表2 CD不同臨床特征中Hcy、sTM及PC水平的改變
與狹窄型組比較:*P<0.05
2.3CD患者中Hcy與sTM、PC水平的相關(guān)分析CD患者中sTM與PC水平呈正相關(guān)性(r=0.401,P<0.05),可能與sTM作為PC抗凝系統(tǒng)的關(guān)鍵環(huán)節(jié),參與機(jī)體炎癥和抗凝機(jī)制的調(diào)節(jié)有關(guān)。見圖1。Hcy與sTM水平及Hcy與PC水平有相關(guān)趨勢(r=0.165,P=0.160;r=0.051,P=0.668),差異無統(tǒng)計(jì)學(xué)意義,可能與樣本量較小有關(guān)。
3 討論
CD患者血栓栓塞的事件發(fā)生率和死亡率近年來逐漸增加,CD患者血栓事件的發(fā)生部位可以為消化道,同時(shí)可以發(fā)生在消化道以外的其他器官。CD患者存在微血管功能不全及微血栓形成的改變,提示CD發(fā)病機(jī)制可能與微血栓形成有關(guān)。研究[6]表明,CD患者血栓形成和體內(nèi)高凝狀態(tài)有關(guān)。研究[7]表明,CD患者的高凝狀態(tài),可能與體內(nèi)Hcy、sTM、PC等水平變化引起的凝血、止血和抗凝系統(tǒng)失調(diào)的病理過程相關(guān)。

圖1 CD患者sTM與PC水平相關(guān)性
Hcy是蛋氨酸代謝的重要中間產(chǎn)物,炎癥性腸病患者血漿及腸黏膜組織Hcy水平明顯增高,可能與IBD患者腸黏膜高通透性有關(guān)[8],Hcy能夠產(chǎn)生超氧化物以及過氧化物引起血管內(nèi)皮細(xì)胞受損,由血管內(nèi)皮細(xì)胞介導(dǎo)的幾種不同的抗凝血機(jī)制受到抑制,包括抑制內(nèi)皮細(xì)胞表面血栓調(diào)節(jié)蛋白的表達(dá)和活性,凝血因子功能改變,有利于微血栓的形成,因此,高Hcy血癥是血栓形成的獨(dú)立危險(xiǎn)因素[9-10]。PC是體內(nèi)的主要抗凝系統(tǒng)之一蛋白C途徑[11]的重要組成部分,機(jī)體內(nèi)PC、sTM、蛋白S(protein S,PS)和內(nèi)皮細(xì)胞蛋白C受體(endothelial cell protein C receptor,EPCR)組成PC抗凝途徑,生理狀態(tài)下,PC是維生素K依賴性的雙鏈糖蛋白,由肝臟合成,以無活性的酶原形式存在[12],sTM與凝血酶結(jié)合后,將PC激活為活化PC(activated protein C,aPC),aPC在一定條件作用下,抑制凝血因子Ⅷ和Ⅴ的活化,阻止血栓形成。sTM為血栓調(diào)節(jié)蛋白,是一種重要的抗凝輔助因子,可作為血栓形成的評估指標(biāo)[13],是血管內(nèi)皮細(xì)胞受損的特異性標(biāo)志,在內(nèi)皮細(xì)胞損傷性的血管疾病中,均可檢測到sTM升高[14],血管內(nèi)皮細(xì)胞是止血和炎癥通路相互作用的中心環(huán)節(jié),在腸道微循環(huán)功能紊亂中起重要作用。微血栓形成可造成血管內(nèi)皮細(xì)胞受損,內(nèi)皮細(xì)胞受損后出現(xiàn)微血管功能紊亂,加重微血栓形成[15]。同時(shí)血管內(nèi)皮細(xì)胞自身具有抗血栓功能,血管內(nèi)皮細(xì)胞受損后,抗凝作用轉(zhuǎn)變?yōu)榇倌饔谩?/p>
本研究顯示,CD患者的Hcy、sTM水平顯著升高,同時(shí)PC水平有一定程度的升高。Hcy通過損傷血管內(nèi)皮細(xì)胞功能,抑制內(nèi)皮細(xì)胞表面血栓調(diào)節(jié)蛋白的表達(dá)與活性;sTM水平顯著升高,提示CD患者體內(nèi)PC抗凝途徑處于失衡狀態(tài)。因此,CD患者中sTM、Hcy水平升高及阻止血栓形成的PC水平失衡,提示CD患者存在血栓前狀態(tài)病理性特征。CD患者中sTM、Hcy及PC水平與臨床特征進(jìn)行關(guān)聯(lián)分析,除了PC水平在非狹窄非穿透型組高于狹窄型組外,均未顯示明顯的統(tǒng)計(jì)學(xué)意義,考慮可能與樣本量較小有關(guān),需要有大樣本的臨床觀察進(jìn)一步明確。sTM與PC水平呈正相關(guān),Hcy與sTM水平及Hcy與PC水平有相關(guān)趨勢,提示CD患者具有血栓前狀態(tài)的病理生理特征。因此,評估CD患者Hcy、sTM以及PC水平,有利于評估CD患者是否存在血栓前狀態(tài)并進(jìn)行藥物防治,預(yù)防CD患者的血栓栓塞并發(fā)癥的發(fā)生,同時(shí)發(fā)揮抗炎作用,有利于改善CD患者腸道炎癥。
[1] Papay P, Miehsler W, Tilg H, et al. Clinical presentation of venous thromboembolism in inflammatory bowel disease[J]. J Crohns Colitis, 2013, 7(9):723-9.
[2] Owczarek D, Cibor D, Saapa K, et al. Anti-inflammatory and anticoagulant properties of the protein C system in inflammatory bowel disease[J]. Pol Arch Med Wewn,2012, 122(5):209-16.
[3] Zezos P, Kouklalis G, Saibil F. Inflammatory bowel disease and thromboembolism[J]. World J Gastroenterol, 2014, 20(38):13863-78.
[4] Selhub J. Homocysteine metabolism[J]. Annu Rev Nutr, 1999, 19(7):217-46.
[5] 胡品津, 錢家鳴, 吳開春, 等. 我國炎癥性腸病診斷與治療的共識意見 (2012 年· 廣州)[J]. 內(nèi)科理論與實(shí)踐, 2013, 8(1):61-75.
[6] Maqro F, Soares J, Fernandes D. Venous thrombosis and prothrombotic factors in inflammatory bowel disease[J]. World J Gastroenterol, 2014, 20(17):4857-72.
[7] Dolapcioqlu C,Soylu A, Kendir T, et al. Coagulation parameters in inflammatory bowel disease[J]. Int J Clin Exp Med, 2014, 7(5):1442-8.
[8] 劉曉昌,梅 俏,黃 健,等.同型半胱氨酸對潰瘍性結(jié)腸炎患者腸黏膜通透性的影響[J]. 中華內(nèi)科雜志, 2014, 53(4):308-9.
[9] Yang F, Qi X, Gao Z, et al. Homocysteine injures vascular endothelial cells by inhibiting mitochondrial activity[J]. Exp Ther Med,2016 12(4):2247-52.
[10] Meng S, Ciment S, Jan M, et al. Homocysteine induces inflammatory transcriptional signaling in monocytes[J]. Front Biosci(Landmark ED), 2013 1(18):685-95.
[11] Danese S, Vetrano S, Zhang L, et al. The protein C pathway in tissue inflammation and injury:pathogenic role and therapeutic implications[J]. Blood, 2011,115(6):1121-30.
[12] Griffin J, Zlokovic B, Mosnier L, Protein C anticoagulant and cytoprotective pathways[J]. Int J Hematol, 2012, 95(4):333-45.
[13] Bollen L, Vande C, Ballet V, et al. Thromboembolism as an important complication of inflammatory bowel disease[J]. Eur J Gastroenterol Hepatol, 2016 28(1):1-7.
[14] Strijbos M, Rao C, Schmitz P, et al. Correlation between circulating endothelial cell counts and plasma thrombomodulin levels as markers for endothelial damage[J]. Thromb Haemost, 2008, 100(4):642-7.
[15] Yau J, Teoh H, Verma S. Endothelial cell control of thrombosis[J]. BMC Cardiovasc Disord, 2015 15 (130):1186-97.

