吡格列酮對新生大鼠成骨細胞p38和ERK1/2信號通路的影響
劉永立,程富禮,景小博,王來喜
0 引言
骨質疏松癥是常見的人代謝骨疾病,其特征在于進行性和年齡依賴性骨丟失和骨折風險增加。近年來,因藥物引起的骨質疏松癥得到廣泛關注。噻唑烷二酮類(TZDs,曲格列酮、羅格列酮和吡格列酮)是PPARγ的人工合成配體,是用于治療糖尿病的胰島素敏化化合物。已有研究表明,TZDs在骨代謝過程中發揮重要作用。臨床研究表明,曲格列酮治療能夠降低2型糖尿病患者的骨轉換率[1]。A糖尿病結局進行試驗(ADOPT)表明,羅格列酮增加了2型糖尿病絕經后婦女骨折的風險[2]。另外,已有研究表明了TZDs對骨生物標志物的影響。Gray等[3]發現,吡格列酮治療能夠降低堿性磷酸酶(ALP)的活性。Berberoglu等[4]發現,羅格列酮治療降低了ALP和骨鈣素的生成。這些研究表明,TZDs對骨骼存在不利作用,存在引起骨質疏松的風險。然而,吡格列酮對骨代謝的影響及相關機制尚不完全清楚。本研究通過體外分離培養新生大鼠顱骨成骨細胞,探究吡格列酮對成骨細胞增殖、凋亡和分化的影響,并初步探討其可能的機制,以期對TZDs的臨床用藥提供一定參考。
1 材料與方法
1.1 材料 新生24 h內SD大鼠幼仔(北京生命科學研究所,許可證號:SYXK2015-0003),均為SPF級動物,雌雄及體重不限。吡格列酮購自上海邁瑞爾化學技術有限公司(純度99%,CAS號:112529-15-4);3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物(MTT)、4-(2-羥乙基)-1-哌嗪乙磺酸(HEPES)、蛋白酶抑制劑混合物購自美國Calbiochem公司;ALP比色測定試劑盒購自賽奧生物科技有限公司;DMEM培養基、胎牛血清(FBS)、青霉素/鏈霉素購自美國GIBCO公司;抗Bcl-2、Bax、磷酸化(p-)p38、p-細胞外信號調節激酶(ERK)1/2、p-C-Jun N-末端激酶(JNK)、BMP-2、Runx2、OSX抗體購自美國Cell Signaling Technology公司;反轉錄試劑盒購自日本Takara公司;引物購自上海生工。
1.2 大鼠顱骨成骨細胞的分離、培養 取出生24 h內的SD大鼠8只,處死后置于75%酒精中,消毒3~5 min后,于無菌條件下取出顱骨,除骨膜及結締組織后,PBS清洗3次。將顱骨剪成1 mm2左右的碎塊,用0.25%胰蛋白酶2 ml,37 ℃預消化10 min,用血清培養液10 ml終止消化后,1 000 r/min離心5 min,棄上清。將沉淀物于0.1%Ⅱ型膠原酶10 ml,37 ℃消化100 min后終止消化。收集消化液,1 000 r/min離心5 min,棄上清,取細胞沉淀,PBS漂洗后,重復離心過程。于離心管中加入含10%胎牛血清、100 U/ml青霉素、100 mg/L鏈霉素的DMEM培養液2 ml,將沉淀細胞吹打均勻,并于200目濾網過濾去除碎骨片,制成細胞懸濁液。將細胞懸濁液接種至細胞培養瓶中靜置10 min后,吸收上清液并置于另一培養瓶中,最后將細胞懸濁液接種于培養皿中,于37 ℃、5% CO2、飽和濕度培養,隔日換液。待顯微鏡下觀察可見成骨細胞80%以上融合時,用0.25%胰蛋白酶消化30 s后,進行細胞傳代培養。
1.3 成骨細胞分化及鑒定 第3代成骨細胞培養至出現80%融合時,將細胞以5×103個/cm2接種在40 mm培養皿中,并在成骨分化培養基(含10%胎牛血清、10 mmol/L HEPES、50 μg/ml L-抗壞血酸和5 mmol/L β-甘油磷酸酯的DMEM培養基)中培養21 d,每周更換2次培養基。隨后用PBS洗滌細胞2次,用4%福爾馬林固定15 min,并用水洗滌,然后將細胞與茜素紅孵育2 min進行染色。PBS洗滌3次后,用蒸餾水洗滌數次。于鏡下觀察細胞。
1.4 成骨細胞增殖、凋亡測定 細胞增殖測定:第3代成骨細胞培養至出現80%融合時,將細胞以5×103個/孔接種在96孔培養板中孵育過夜。加入含0、10、20、40 μmol/L吡格列酮的DMEM培養基培養48 h后,每孔加入20 μl MTT,孵育4 h后,棄去上清液,于每孔中加入100 μl二甲基亞砜,振蕩混合3 min后,使用酶標儀于490 nm下測量吸光度(OD490)。
細胞凋亡測定:應用Hoechst 33258染色檢測細胞凋亡。第3代細胞培養至出現80%融合時,將細胞以4×104個/cm2接種至12孔板中,孵育過夜。根據參考文獻[5],于培養基中加入含0、10、20、40 μmol/L吡格列酮的DMEM培養基培養48 h后,PBS洗滌細胞以除去非貼壁細胞,貼壁細胞置于4%多聚甲醛中固定10 min。PBS洗滌后,細胞與0.2 mmol/L Hoechst 33258在黑暗中孵育5 min。于熒光顯微鏡下觀察凋亡成骨細胞數。
1.5 ALP活性檢測 第3代成骨細胞培養至出現80%融合時,將細胞以5×103個/cm2接種在40 mm培養皿中,加入含0、10、20、40 μmol/L吡格列酮的DMEM培養基培養48 h,更換為成骨分化培養基培養,每周更換2次培養基。各組細胞培養的第14天,棄培養液,用PBS洗滌細胞2次后,收集細胞,1 000 r/min離心30 min。取上清液,使用ALP活性測定試劑盒檢測ALP活性,所有操作均嚴格按照說明書進行。在酶標儀上于420 nm處讀取吸光值(OD420)。
1.6 鈣化結節染色鑒定 應用茜素紅染色進行鈣化結節測定。“1.6”項下各組細胞培養的第21天,棄培養液,用PBS洗滌細胞2次后,用4%福爾馬林固定15 min。用水洗滌后,將細胞與0.1%茜素紅(pH 8.9)于37 ℃下孵育2 min。PBS洗滌3次后,用蒸餾水洗滌數次后,拍照記錄鈣化結節情況。
1.7 實時熒光定量PCR(qRT-PCR) 應用qRT-PCR進行成骨分化相關基因的mRNA表達檢測。將細胞數調節至1×106/ml,TRIzol試劑(Invitrogen,美國)從細胞提取總RNA,Reverse Transcription Kit(Takara,日本)將RNA逆轉錄為cDNA,SYBR Green(Takara)進行實時PCR分析。以β-Actin作為內參。利用ABI7500系統(Applied Biosystems)進行qRT-PCR反應。用2-ΔΔCt法計算mRNA相對表達的倍數變化。qRT-PCR反應條件:95 ℃ 30 s,95 ℃15 s,72 ℃ 15 s,共40個循環。引物設計及合成由上海生工完成,引物序列如下:BMP-2,forward 5′-GGTGGAATGACTGGATTG-3′,reverse 5′-GCATCGAGATAGCACTG-3′;Runx2,forward 5′-GGAATTCCATATGGACACTT-3′,reverse 5′-CCGCTCGAGGTTATAGTCCT-3′;OSX,forward 5′-TGTCCGTCGTGGATCTGAC-3′,reverse 5′-CCTGCTTCACCACCTTCTTG-3′;β-actin,forward 5′-CTCCTGGCAAGAATGGAGAT-3′,reverse 5′-AATCCACGA
GCACCCTGA-3′。
1.8 蛋白免疫印跡(Western blot,WB) 使用WB進行蛋白表達檢測,補充有PMSF(Riche)的RIPA蛋白提取試劑(Beyotime)裂解細胞,從細胞中提取蛋白質。在4 ℃下12 000 r/min離心10 min,通過10%十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(SDS-PAGE)分離上清液,將分離的蛋白質轉移到硝酸纖維素膜(Sigma)上。將膜在PBS和5%脫脂乳中封閉1 h,并用抗Bcl-2、Bax、p-p38、p-ERK1/2、p-JNK、BMP-2、Runx2、OSX的一抗于4 ℃孵育過夜。將膜用HRP綴合的二抗(Cell Signaling Technology)在室溫下孵育1 h。使用Quantity One軟件(Life Technologies)評估相對蛋白表達水平。
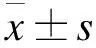
2 結果
2.1 成骨細胞形態觀察及鑒定 倒置顯微鏡下觀察發現,大鼠成骨細胞原代培養的第2天,成骨細胞呈圓形,單細胞離散分布(圖1A)。在培養的第4天,細胞數量增加,細胞形態多樣,呈多角形、三角形、梭形等(圖1B)。細胞培養的第14天,細胞迅速增殖,細胞呈梭形或立方形,排列緊密,可多層生長,細胞整合達90%,可進行傳代培養(圖1C)。第3代成骨細胞培養21 d后,細胞重疊生長,茜素紅染色顯示,胞漿內可見棕黑色或黑色鈣結節沉積(圖1D)。提示本研究所培養新生大鼠顱骨成骨細胞具有細胞分化能力。
2.2 吡格列酮對成骨細胞增殖的影響 第3代成骨細胞經0、10、20、40 μmol/L吡格列酮處理48 h后,細胞活性(OD490)分別為0.82±0.03、0.58±0.06、0.38±0.04、0.25±0.03,隨著吡格列酮濃度的增加,各組細胞活性逐漸降低,差異有統計學意義(F=282.629,P<0.01)。見圖2。
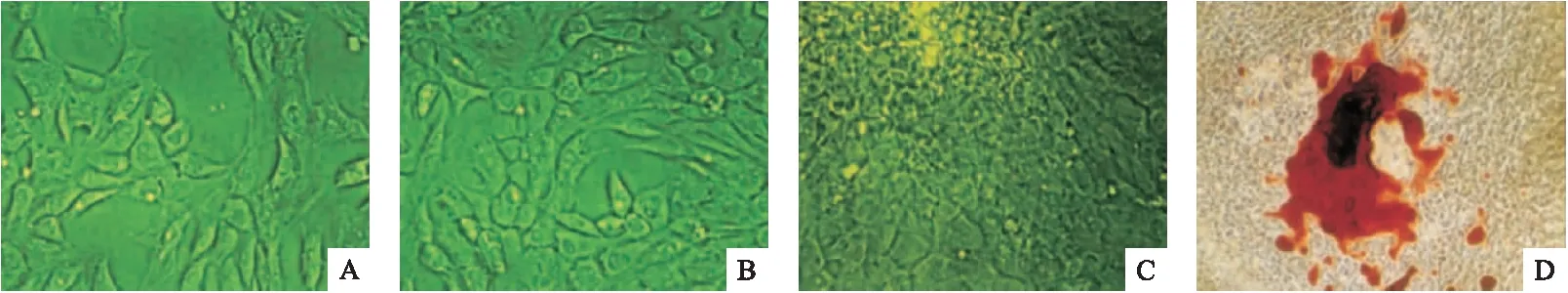
圖1 成骨細胞形態觀察及鑒定
注:*與空白對照組比較,P<0.05;#與10 μmol/L組比較,P<0.05;△與20 μmol/L組比較,P<0.05
2.3 吡格列酮對成骨細胞凋亡的影響 第3代成骨細胞經0、10、20、40 μmol/L吡格列酮處理48 h后,熒光顯微鏡下觀察成骨細胞Hoechst 33258染色陽性細胞數。與空白對照組相比,經10、20 μmol/L吡格列酮處理組熒光陽性成骨細胞數量顯著降低,差異有統計學意義(P<0.05)。與空白對照組及吡格列酮10 μmol/L組、20 μmol/L組相比,吡格列酮40 μmol/L組熒光陽性成骨細胞數量顯著增加,差異有統計學意義(P<0.05)。提示低濃度(10、20 μmol/L)吡格列酮抑制成骨細胞凋亡,而高濃度(40 μmol/L)吡格列酮促進成骨細胞凋亡。見圖3。
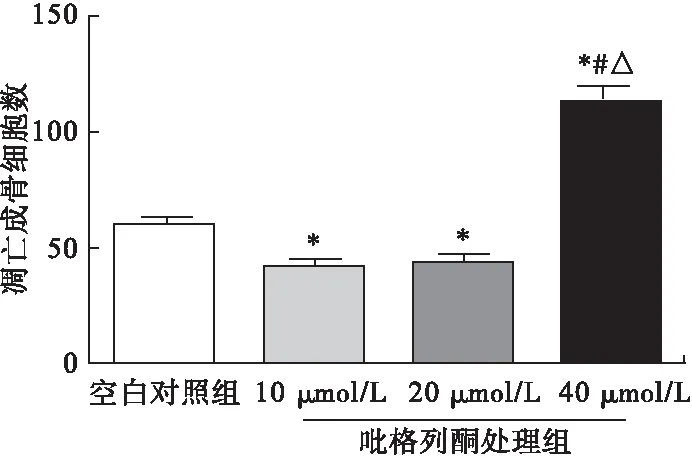
圖3 吡格列酮對成骨細胞凋亡的影響(n=8)
2.4 吡格列酮對成骨細胞Bax、Bcl-2蛋白表達的影響 與空白對照組相比,第3代成骨細胞經10、20 μmol/L吡格列酮處理48 h后,細胞內Bax蛋白表達水平顯著降低(P<0.05),而Bcl-2蛋白表達水平顯著增加(P<0.05)。當吡格列酮濃度為40 μmol/L時,與空白對照組相比,成骨細胞內Bax蛋白表達水平顯著增加(P<0.05),而Bcl-2蛋白表達水平顯著降低(P<0.05)。見圖4。
圖4 吡格列酮對成骨細胞Bax、Bcl-2蛋白表達的影響(n=8)
注:*與空白對照組比較,P<0.05;#與10 μmol/L組比較,P<0.05;△與20 μmol/L組比較,P<0.05
2.5 吡格列酮對成骨細胞分化的影響
2.5.1 吡格列酮對ALP活性的影響 第3代成骨細胞經0、10、20、40 μmol/L吡格列酮處理48 h后,ALP活性(OD420)分別為1.07±0.15、0.89±0.04、0.75±0.03、0.53±0.03,隨著吡格列酮濃度的增加,各組細胞ALP活性逐漸降低,差異有統計學意義(F=64.247,P<0.01)。見圖5。
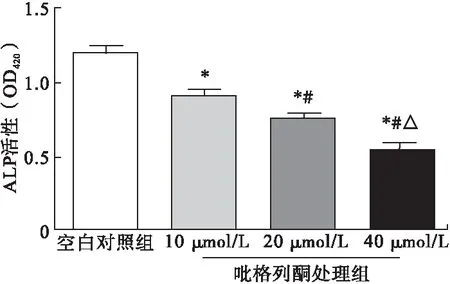
圖5 吡格列酮對成骨細胞ALP活性的影響(n=8)
注:*與空白對照組比較,P<0.05;#與10 μmol/L組比較,P<0.05;△與20 μmol/L組比較,P<0.05
2.5.2 吡格列酮對成骨細胞鈣化結節形成的影響 與空白對照組相比,吡格列酮處理組的鈣化結節數均明顯降低(圖6A)。以鈣化結節在培養皿中所占面積的百分比進行量化,發現隨著吡格列酮濃度的增加,鈣化結節數量逐漸增加,且差異均有統計學意義(F=672.644,P<0.01)。見圖6B。
2.5.3 吡格列酮對成骨細胞BMP-2、Runx2、OSX mRNA表達的影響 經0、10、20、40 μmol/L吡格列酮處理的成骨細胞于成骨分化培養基中培養48 h后,應用qRT-PCR檢測吡格列酮對成骨細胞分化相關基因表達的影響。與空白對照組相比,經10、20、40 μmol/L吡格列酮處理后,細胞內BMP-2、Runx2、OSX mRNA表達水平均以劑量依賴形式顯著降低(P<0.05)。見圖7。
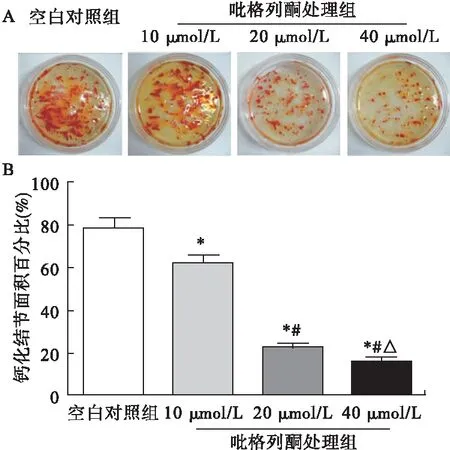
圖6 吡格列酮對成骨細胞鈣化結節形成的影響(n=8)
注:A.茜素紅染色觀察到鈣化結節,B.鈣化結節在培養皿中所占面積百分比。*與空白對照組比較,P<0.05;#與10 μmol/L組比較,P<0.05;△與20 μmol/L組比較,P<0.05
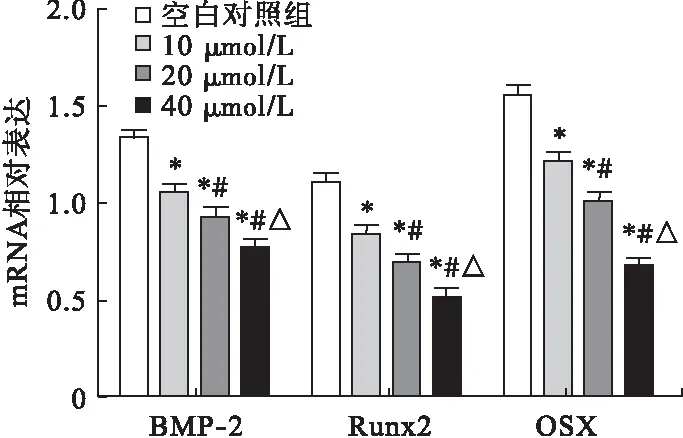
圖7 吡格列酮對成骨細胞BMP-2、Runx2、OSX mRNA表達的影響(n=8)
注:*與空白對照組比較,P<0.05;#與10 μmol/L組比較,P<0.05;△與20 μmol/L組比較,P<0.05
2.5.4 吡格列酮對成骨細胞BMP-2、Runx2、OSX蛋白表達的影響 與空白對照組相比,經10、20、40 μmol/L吡格列酮處理后,細胞內BMP-2、Runx2、OSX蛋白表達水平均以劑量依賴形式顯著降低,差異均有統計學意義(P<0.05)。見圖8。
2.6 吡格列酮對成骨細胞MAPK信號通路的影響 經0、10、20、40 μmol/L吡格列酮處理的成骨細胞于成骨分化培養基中培養48 h后,應用免疫印跡分析,檢測吡格列酮對成骨細胞MAPK信號通路的影響,結果發現,與空白對照組比較,經10、20、40 μmol/L吡格列酮處理后,細胞內p-p38 MAPK蛋白表達水平均顯著增加(P<0.05),而p-ERK1/2蛋白表達水平顯著降低(P<0.05),且均存在劑量依賴性。各組細胞內p-JNK蛋白表達水平差異無統計學意義(P<0.05)。見圖9。
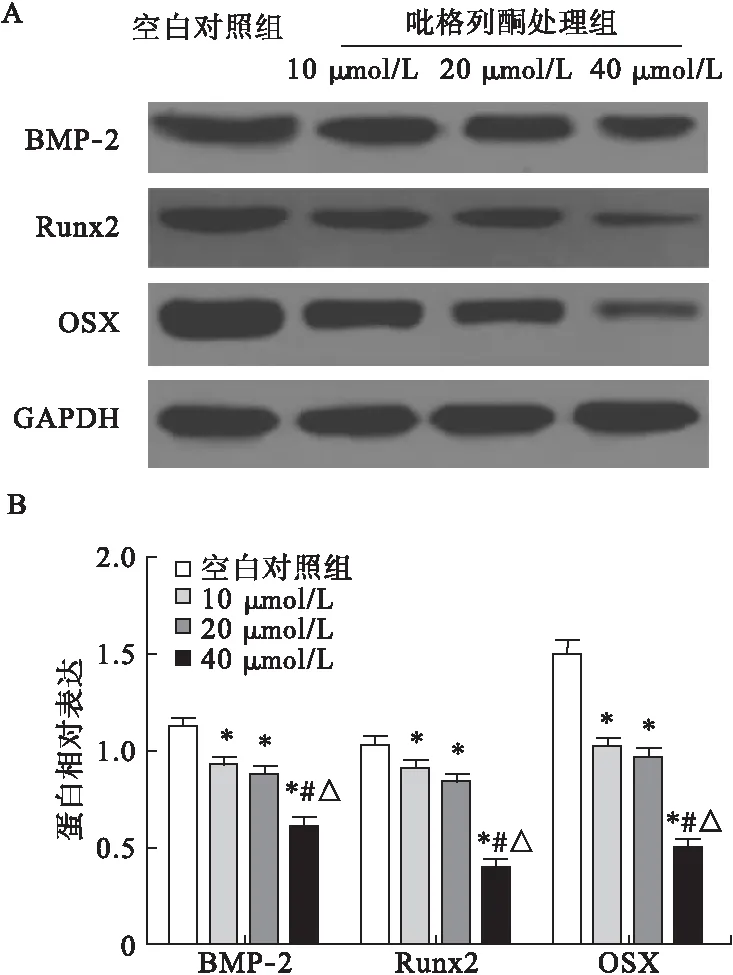
圖8 吡格列酮對成骨細胞BMP-2、Runx2、OSX蛋白
注:*與空白對照組比較,P<0.05;#與10 μmol/L組比較,P<0.05;△與20 μmol/L組比較,P<0.05
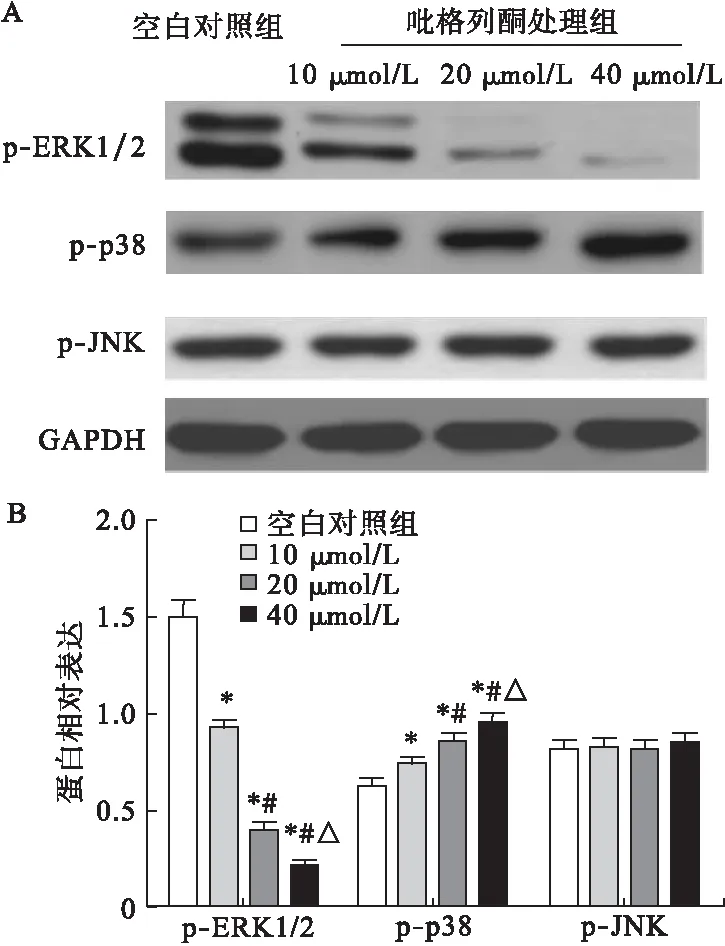
圖9 吡格列酮對成骨細胞MAPK信號通路的影響(n=8)
注:*與空白對照組比較,P<0.05;#與10 μmol/L組比較,P<0.05;△與20 μmol/L組比較,P<0.05
3 討論
本研究采用新生24 h內SD大鼠顱骨組織來源的成骨細胞進行培養,倒置顯微鏡下觀察到成骨細胞生長狀態良好,形態與過往學者報道一致。通過茜紅素染色可使鈣化結節呈現棕黑色或黑色沉積,證實所培養成骨細胞具有分化為鈣結節的能力。
研究表明,TZDs對骨代謝過程存在不利作用,能夠抑制骨骼間充質干細胞向成骨細胞分化,抑制骨形成,誘導成骨細胞凋亡,使成骨細胞正常功能受損,導致骨量減少,并增加骨折風險[6-7]。研究證實,吡格列酮能夠抑制成骨細胞增殖、分裂和DNA合成,且低濃度吡格列酮(≤20 μmol/L)能夠抑制成骨細胞凋亡,而較高濃度吡格列酮(30~40 μmol/L)則促進成骨細胞凋亡[5]。與此一致,本研究發現,與空白對照組相比,經10、20、40 μmol/L吡格列酮處理后,成骨細胞活性下降。另外,與空白對照組相比,吡格列酮濃度為10、20 μmol/L時,成骨細胞凋亡被抑制,而當吡格列酮濃度為40 μmol/L時,能夠促進成骨細胞凋亡。Bcl-2家族蛋白是調節線粒體損傷的關鍵分子,Bax是Bcl-2家族中重要的促凋亡蛋白,在細胞凋亡調控中起重要作用。研究證實,Bax表達的增加、Bcl-2表達水平的降低能夠導致細胞凋亡[8-9]。研究發現,羅格列酮能夠劑量依賴性促進Bax表達增加,從而導致成骨細胞死亡[10]。本研究發現,當吡格列酮濃度為10、20 μmol/L時,成骨細胞內Bax蛋白表達水平降低,而Bcl-2蛋白表達水平顯著增加。當吡格列酮濃度為40 μmol/L時,成骨細胞內Bax蛋白表達水平增加,而Bcl-2蛋白表達水平顯著降低。提示吡格列酮可通過調節Bcl-2和Bax蛋白表達水平,調控成骨細胞凋亡,且這種調控作用存在劑量依賴性,其機制可能在于成骨細胞自身調節機制可以對抗低濃度吡格列酮誘導的凋亡作用,而隨著吡格列酮含量的增加,Bcl-2/Bax平衡超過自身調節范圍,無法對抗藥物刺激引起的細胞凋亡。
成骨細胞增殖抑制、凋亡增加及分化程度降低,是造成骨質疏松癥的重要原因。TZDs對成骨細胞分化影響的研究較少,且吡格列酮對成骨細胞分化的影響及相關機制尚未報道。本研究進一步分析吡格列酮對大鼠成骨細胞分化功能的影響,并探討潛在機制。
ALP是成骨細胞在分化早期所分泌的酶蛋白,是骨形成的標志性蛋白,特異性較高,可作為鑒定成骨細胞的生化和組織學標志[11]。ALP變化反映了骨轉換過程中骨形成程度,其活性與成骨細胞的分化程度呈正相關。有證據表明,ALP活性的微小降低直接影響成骨細胞礦化形成過程。另外,成骨細胞分化的標志性表型是礦化結節的形成。本研究發現,經不同濃度吡格列酮處理后,各組成骨細胞ALP活性降低,且吡格列酮可抑制成骨細胞礦化結節的形成,提示吡格列酮可抑制大鼠成骨細胞的分化,且隨著其濃度的增加,抑制作用逐漸增強。BMP-2是促進骨形成、誘導成骨細胞分化的重要細胞外信號分子之一,是最強的成骨因子之一。BMP-2調節因子Runx2是間質細胞分化成前成骨細胞所必需的[12]。Runx2下游的OSX是成骨細胞特異性的成骨細胞分化和骨形成所必需的轉錄因子[13]。本研究發現,經吡格列酮處理后,成骨細胞內BMP-2、Runx2、OSX mRNA和蛋白表達以劑量依賴的形式降低,由此推測,吡格列酮通過調控成骨細胞內BMP-2/Runx2/OSX信號通路,參與調控大鼠成骨細胞分化功能。
絲裂原活化蛋白激酶(MAPKs)是能夠被不同細胞外刺激激活的絲氨酸-蘇氨酸蛋白激酶,是信號轉導過程中的主要信號分子,參與多種重要的細胞生理病理過程[14-15]。已在哺乳動物細胞中鑒定了MAPKs的3條并行信號通路:p38、細胞外信號調節激酶(ERK)和C-Jun N-末端激酶(JNK),在細胞增殖、分化、凋亡等過程中都發揮重要作用。研究表明,包括成骨細胞在內的多種細胞類型中,ERK參與細胞的增殖、分化和存活,而p38和JNK參與細胞周期控制、細胞凋亡和炎癥反應[16]。Tang等[17]發現,BMP-2在成骨細胞中的表達受p38和ERK信號通路調控。ERK1/2組成型活性形式的激活能夠誘導成骨細胞的分化[18-19]。p38的磷酸化能誘導smad1活化,從而調控BMP-2/smads信號通路,導致成骨細胞ALP表達和活化[20],且BMP-2在成骨細胞中的表達受MAPK調控[21-23]。另外,在成骨細胞中,JNK和p-38 MAPK能夠誘導細胞凋亡,而ERK能夠抑制凋亡過程[24]。這些研究表明,MAPK信號通路參與成骨細胞特異性基因表達和功能調控。已有研究報道,吡格列酮通過調控MAPK信號通路,調節細胞炎癥反應[25]。體外研究表明,曲格列酮通過激活MAPK信號通路增加成骨細胞的凋亡[26]。然而,吡格列酮在成骨細胞中對MAPK信號通路的影響尚不明確。本研究發現,經吡格列酮處理后,成骨細胞內p-p38蛋白表達水平增加,而p-ERK1/2蛋白表達水平降低,且均呈劑量依賴性。而p-JUN1/2蛋白表達水平無明顯變化。推測吡格列酮能夠通過活化p38信號通路和抑制ERK1/2信號途徑參與成骨細胞凋亡和分化過程。成骨細胞代謝過程十分復雜,作為細胞內信號轉導的主要信號分子,MAPK信號通路在吡格列酮影響成骨細胞增殖、分化及凋亡過程中的作用還需深入探究,以期為臨床用藥提供一定參考依據。
綜上所述,吡格列酮以劑量依賴的方式調節大鼠成骨細胞增殖、凋亡和分化,p38和ERK1/2信號途徑在這一過程中起重要調控作用。
參考文獻:
[1] Okazaki R,Miura M,Toriumi M,et al.Short-term treatment with troglitazone decreases bone turnover in patients with type 2 diabetes mellitus[J].Endocr J,1999,46(6):795-801.
[2] Pfützner A,Forst T.A diabetes outcome and progression trial-die ADOPT studie[J].Der Diabetologe,2007,3(4):261-269.
[3] Grey A,Bolland M,Gamble G,et al.The peroxisome proliferator-activated receptor-gamma agonist rosiglitazone decreases bone formation and bone mineral density in healthy postmenopausal women:a randomized,controlled trial[J].J Clin Endocrinol Metab,2007,92(4):1305-1310.
[4] Berberoglu Z,Gursoy A,Bayraktar N,et al.Rosiglitazone decreases serum bone-specific alkaline phosphatase activity in postmenopausal diabetic women[J].J Clin Endocrinol Metab,2007,92(9):3523-3530.
[5] 李俊巖,董進,牛曉紅,等.吡格列酮對成骨細胞Bax、Bcl-2蛋白表達的影響[J].中華內分泌代謝雜志,2011,27(2):118-121.
[6] 李麗華.吡格列酮對大鼠骨髓間充質干細胞向成骨細胞分化后轉脂分化的影響[D].華中科技大學,2009.
[7] 侯艷麗,季虹,榮海欽.噻唑烷二酮類藥物對骨代謝的影響[J].中華骨質疏松和骨礦鹽疾病雜志,2009,2(3):189-193.
[8] Kokawa K,Shikone T,Otani T,et al.Apoptosis and the expression of Bax and Bcl-2 in squamous cell carcinoma and adenocarcinoma of the uterine cervix[J].Cancer,1999,85(8):1799-1809.
[9] Zhang T,Tian F,Wang J,et al.Atherosclerosis-associated endothelial cell apoptosis by MiR-429-mediated down regulation of Bcl-2[J].Cell Physiol Biochem,2015,37(4):1421-1430.
[10]Hsiao FY,Mullins CD.The association between thiazolidinediones and hospitalisation for fracture in type 2 diabetic patients:a Taiwanese population-based nested case-control study[J].Diabetologia,2010,53(3):489-496.
[11]Suzuki A,Takayama T,Suzuki N,et al.Daily low-intensity pulsed ultrasound-mediated osteogenic differentiation in rat osteoblasts[J].Acta Biochim Biophys Sin (Shanghai),2009,41(2):108-115.
[12]Guo CH,Yue ZP,Bai ZK,et al.Runx2 acts downstream of C/EBPβ to regulate the differentiation of uterine stromal cells in mice[J].Cell Tissue Res,2016,366(2):393-401.
[13]Wang L,Mishina Y,Liu F.Osterix-Cre transgene causes craniofacial bone development defect[J].Calcif Tissue Int,2015,96(2):129-137.
[14]高黎,趙志英.MAPK信號轉導通路及其意義[J].世界最新醫學信息文摘(連續型電子期刊),2015,15(53):25-27.
[15]安秋霞,蒙艷麗,呂丹丹,等.絲裂原活化蛋白激酶信號通路的研究進展[J].黑龍江中醫藥,2016,45(5):65-66.
[16]Hu Y,Chan E,Wang SX,et al.Activation of p38 mitogen-activated protein kinase is required for osteoblast differentiation[J].Endocrinology,2003,144(5):2068-2074.
[17]Tang CH,Yang RS,Chien MY,et al.Enhancement of bone morphogenetic protein-2 expression and bone formation by coumarin derivatives via p38 and ERK-dependent pathway in osteoblasts[J].Eur J Pharmacol,2008,579(1-3):40-49.
[18]Ge C,Xiao G,Jiang D,et al.Critical role of the extracellular signal-regulated kinase-MAPK pathway in osteoblast differentiation and skeletal development[J].J Cell Biol,2007,176(5):709-718.
[19]廖清船,徐康康,許靜,等.p38MAPK與ERK1/2的協同效應及對成骨細胞分化的調控[J].中華骨科雜志,2011,31(9):970-975.
[20]N?th U,Tuli R,Seghatoleslami R,et al.Activation of p38 and Smads mediates BMP-2 effects on human trabecular bone-derived osteoblasts[J].Exp Cell Res,2003,291(1):201-211.
[21]Tsai HY,Lin HY,Fong YC,et al.Paeonol inhibits RANKL-induced osteoclastogenesis by inhibiting ERK,p38 and NF-kappaB pathway[J].Eur J Pharmacol,2008,588(1):124-133.
[22]趙良功.MAPK家族在成骨細胞分化過程中調控作用的研究[D].蘭州大學,2015.
[23]陳學鵬,施潔珺,葉青松,等.p38MAPK信號通路在BMP-2誘導人牙囊細胞成骨分化中的作用[J].中國細胞生物學學報,2013,35(6):816-823.
[24]Guo C,Yang XG,Wang F,et al.IL-1α induces apoptosis and inhibits the osteoblast differentiation of MC3T3-E1 cells through the JNK and p38 MAPK pathways[J].Int J Mol Med,2016,38(1):319-327.
[25]汪姍,葉山東,孫文佳,等.吡格列酮對腎小球系膜細胞ROS和p38MAPK的影響[J].中國藥理學通報,2014,30(1):82-85.
[26]Jung JY,Yoo CI,Kim HT,et al.Role of mitogen-activated protein kinase (MAPK) in troglitazone-induced osteoblastic cell death[J].Toxicology,2007,234(1-2):73-82.

