基于決策樹模型對我國6種保肝藥物治療藥物性肝損傷的成本-效果分析
田艷平,崔向麗,劉麗宏,張長平(.首都醫科大學附屬北京朝陽醫院藥事部,北京 0000;.首都醫科大學附屬北京佑安醫院藥學部,北京 00069)
藥物性肝損傷(drug-induced liver injury,DILI)是臨床常見的藥品不良反應之一。保肝治療是藥物性肝損傷治療的一部分,保肝藥物的種類較多,目前臨床選擇多以治療經驗為主,隨著循證醫學的發展,保肝藥物治療DILI的系統研究逐漸深入,多項系統評價表明保肝藥物治療DILI的療效和安全性均較好。藥物經濟學(pharmacoeconomy,PE)是運用經濟學原理和方法在藥物治療領域中的具體應用,是可從一系列用藥方案中選擇、判斷出最優方案的有效工具[1]。本文通過構建PE評價模型,對臨床常用的保肝藥物注射劑進行PE分析,以期為臨床選擇具有成本-效果優勢的保肝藥物提供參考。
1 資料和方法
1.1 研究對象
參考國家基本醫療保險/工商保險和生育保險藥品目錄(2017年版),選擇對于肝和膽治療藥中療效肯定,且已普遍用于臨床的6種保肝藥物的注射劑,包括異甘草酸鎂注射液(100 mg·次-1,qd,61.12元·d-1,正大天晴藥業集團股份有限公司)、多烯磷脂酰膽堿注射液(465 mg·次-1,qd,38.36元·d-1,成都天臺制藥有限制藥)、注射用還原型谷胱甘肽(1.2 g·次-1,qd,25.4元·d-1,重慶藥友制藥有限責任公司)、注射用復方甘草酸苷(100 mg·次-1,qd,46.7元·d-1,瑞陽制藥有限公司)、注射用硫普羅寧(200 mg·次-1,qd,20.05元·d-1,悅康藥業集團有限公司)、甘草酸二銨注射液(150 mg·次-1,qd,9.6元·d-1,正大天晴藥業集團股份有限公司)。
1.2 文獻檢索
檢索數據庫包括:中文期刊全文數據庫、維普數據庫及萬方數據庫。檢索時間為建庫至2018年2月。檢索關鍵詞為藥物性肝損傷、藥物性肝損害、藥物性肝炎、肝損傷、肝損害、異甘草酸鎂、多烯磷脂酰膽堿、還原型谷胱甘肽、復方甘草酸苷、硫普羅寧、甘草酸二銨;匹配度為模糊。
1.3 文獻納入及排除標準
納入標準:(1)以上6種藥物治療DILI的隨機對照臨床研究。(2)為保證成本核算的一致性,廠家和給藥劑量均一致。(3)療程為4周。(4)療效判斷標準[2]:顯效:臨床癥狀消失,血清生化指標恢復正常;有效:臨床癥狀消失(或改善),血清生化指標較之前明顯好轉;無效:治療后血清生化指標無明顯變化或未達到上述顯效。排除標準:(1)非RCT研究;(2)口服藥物保肝治療方案者;(3)聯合用藥治療方案;(4)重復文獻;(5)不符合上述入選標準。
1.4 文獻篩選和質量評價
2名研究者分別單獨根據本研究設定的納入及排除標準篩選文獻,如有分歧則請第3位研究者協商解決。根據Jadad改良法[3]對文獻是否使用隨機方法、盲法、基線相似性及失訪退出等指標進行質量評分。先由2名研究者各自單獨評分,然后互相核對,如有分歧,兩人討論或請第三方仲裁決定。其中隨機、分配隱藏和雙盲分別占2分;退出或失訪描述為1分,未進行描述者為0分,總分在4分以下提示文獻質量較低。
1.5 模型結構
決策樹模型是經濟學評價中最常見的決策模型,決策樹模型屬于靜態模型[4],靜態模型通常適用于病程較短的急性疾病或者病情不太復雜的疾病,能夠反應事件與決策時間變化而產生的各種后果。本研究納入的文獻均為急性DILI,療程較短,治療方案邏輯簡單,適合采用決策樹模型進行分析。采用TreeAge Pro 2011軟件進行決策樹模型的構建,對6種保肝藥物注射劑進行成本效果分析,基于文獻資料的療程確定本研究的模型跨度時間為4周,本研究決策樹模型圖如圖1所示(□決策出發點;○狀態點;△效果值)。
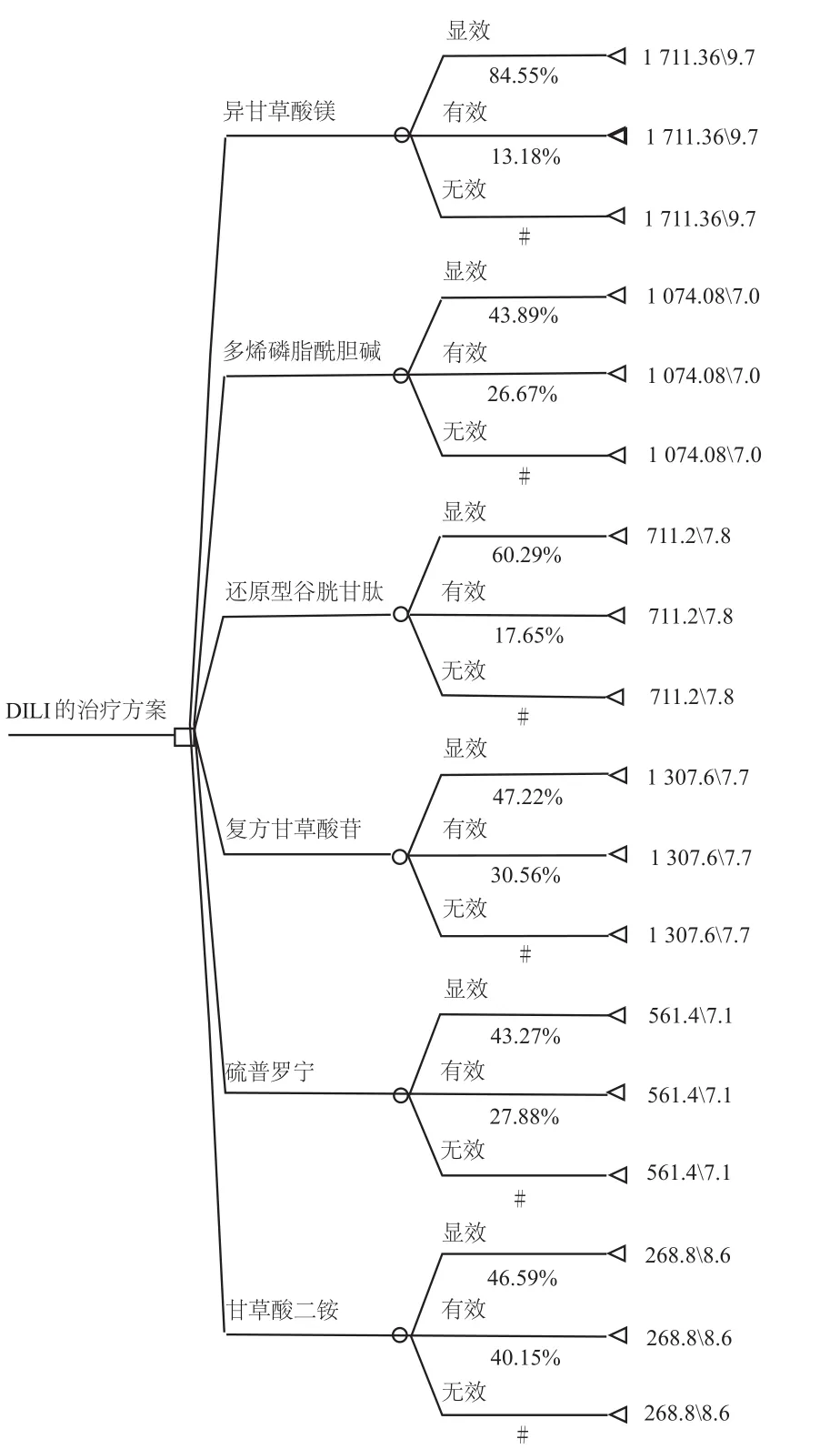
圖1 決策樹模型圖Fig 1 Decision tree model structure
模型參數:(1)率值參數:檢索共計14篇文獻,病例總數944例[5-18],對文獻中的顯效率、有效率、無效率進行Meta分析,獲得率值參數。(2)效果參數:治療效果在PE評價中指的是疾病治療的終末狀態,患者在經過治療后達到痊愈或病情穩定情況,若進行定量分析,則需對治療結果加以賦值[19],本研究咨詢了臨床肝病專家和藥物經濟學研究者共同決定以治療總有效率為基準[20]。(3)成本參數:本次研究從醫療系統角度出發,為避免數據偏差,本著經濟學保守原則,本研究僅計算6種治療方案的藥品直接成本。由于本研究的時間較短,并未進行貼現處理。詳見表1(率值參數來源于Meta分析,效果參數來源于專家意見,藥品費用來源于北京市醫藥陽光采購綜合管理平臺實時藥品價格)。
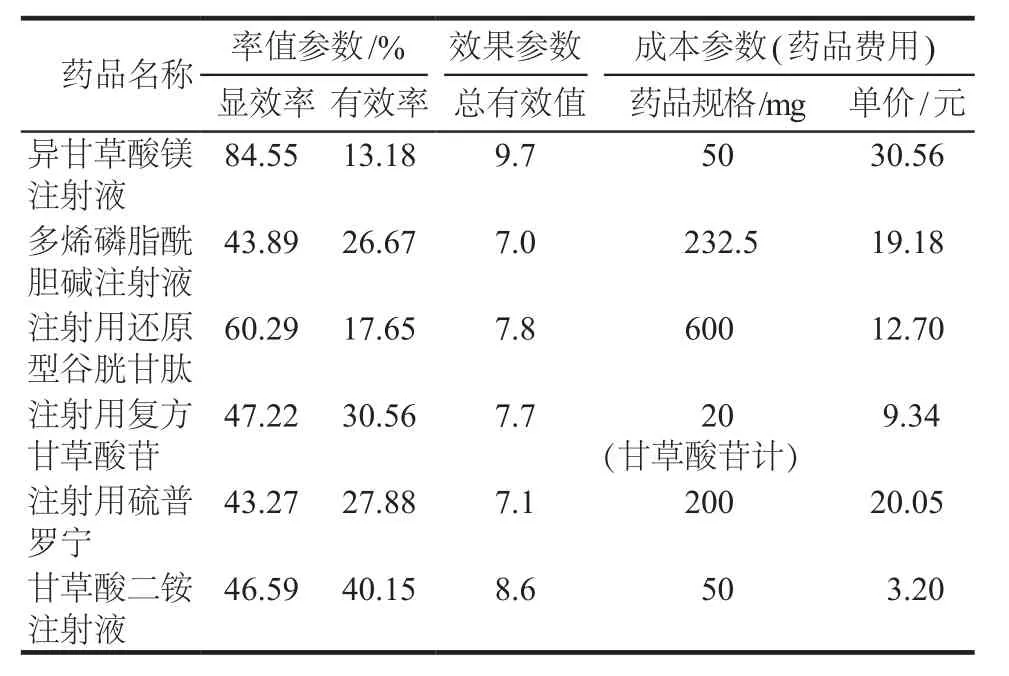
表1 模型參數Tab 1 Parameters used in the decision model
1.6 統計學處理
決策樹模型的建立和分析采用TreeAge Pro2011軟件。本研究采用成本-效果分析(cost-effectiveness analysis,CEA)和增量成本效果比(the incremental cost-effectiveness ratio,ICER)。CEA是藥物經濟學評價中的主要分析方法之一;ICER則是成本效果分析中最常用的分析指標,表示各種干預情況下獲得單位效果值所需增加的費用。
2 結果
2.1 文獻質量評價結果
參考Jadad改良法的評分標準,在納入的14篇文獻中,僅有2篇文獻描述隨機序列產生的方式[12-13],其余文獻都沒有清楚地描述隨機序列的產生方式、如何分配隱藏的、是否進行了盲法、撤出與退出詳細情況,因此這14項研究皆為低質量研究。
2.2 經濟學評價結果
2.2.1 以效果為產出的CEA分析 結果顯示,6種保肝藥物注射劑對DILI效果均顯著,經濟學分析顯示,6種治療方案中,相比甘草酸二銨方案,復方甘草酸苷、多烯磷脂酰膽堿、硫普羅寧、還原型谷胱甘肽效果更低,成本更高,為絕對劣勢策略,具體情況見圖2。優勢方案中,異甘草酸鎂效果值(9.7)優于甘草酸二銨(8.6),異甘草酸鎂CEA(176.43)高于甘草酸二銨(31.26),ICER為1 311.42。詳見表2。
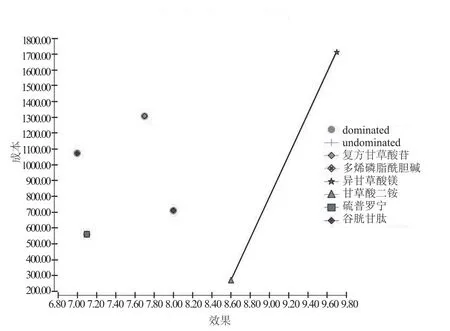
圖2 成本-效果邊界圖Fig 2 Cost-effectiveness eff i ciency frontier
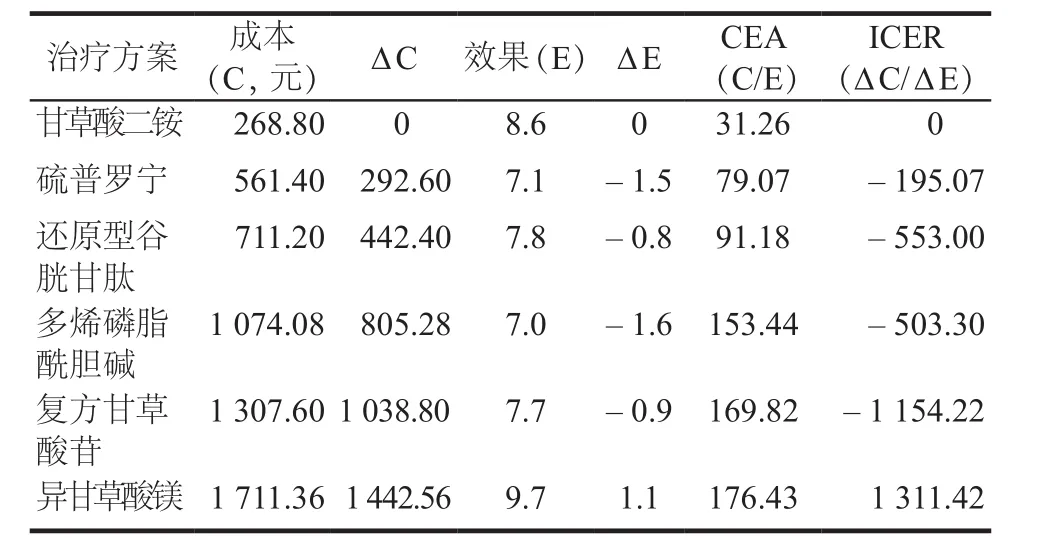
表2 以效果為產出的成本-效果分析結果Tab 2 Cost-effectiveness analysis of 6 groups based on effect values
2.2.2 以顯效率為產出指標的成本-效果分析 患者肝功能的恢復情況會影響治療的依從性,患者肝功能的各項指標完全恢復正常,將會促進患者足量足療程的完成DILI的治療方案,因此顯效率作為DILI治療方案的評估指標更具有臨床意義,從表3可以看出,異甘草酸鎂顯效率最高(84.55%),CEA為2 024.08,ICER為4 122.67,詳見表3。
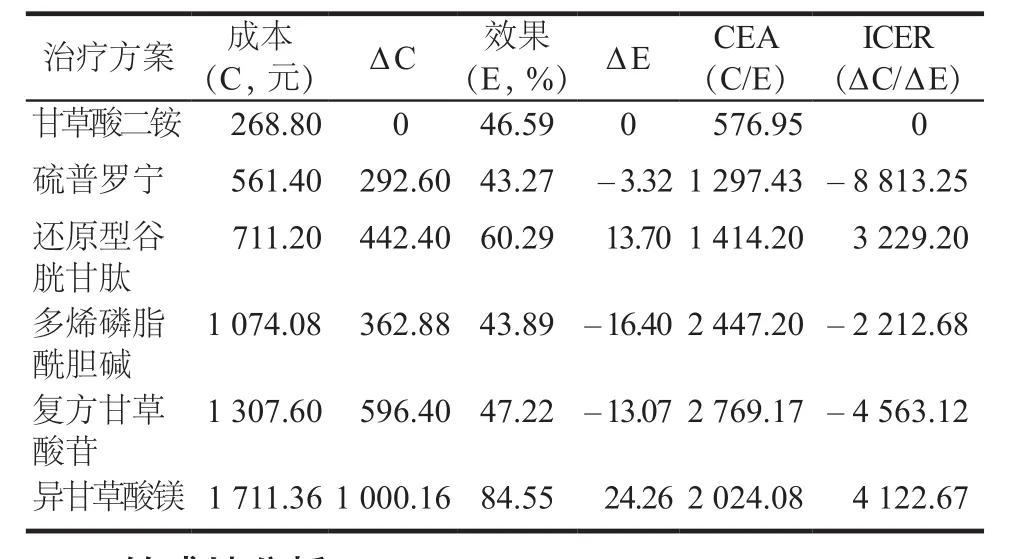
表3 以顯效率為產出的成本-效果分析結果Tab 3 Cost-effectiveness analysis of 6 groups based on excellence rate
2.3 敏感性分析
各種保肝藥物的率值參數來源于文獻的Meta分析結果,文獻的納入質量參差,顯效率為影響率值參數的主要因素,因此本研究將每種治療方案的顯效率按“±10%”作為觀察點,進行單因素靈敏度分析;另考慮藥品價格下降是必然趨勢,因此假定藥品價格下降10%,進行單向敏感度分析。結果顯示,顯效率和藥品價格2個參數對各治療方案的成本效果排名沒有影響,具體見表4 ~ 7。當藥品成本下降10%,DILI治療的顯效率下降或上升10%后,敏感性分析結果與初始結果一致。
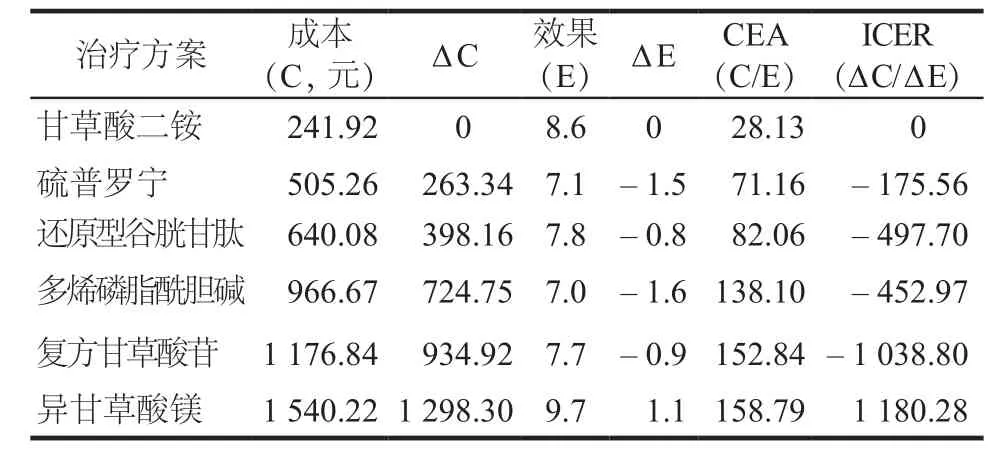
表4 以效果為產出指標的成本下降10%的敏感性分析結果Tab 4 Sensitivity analysis for a 10% reduction in costs of 6 groups based on effect values
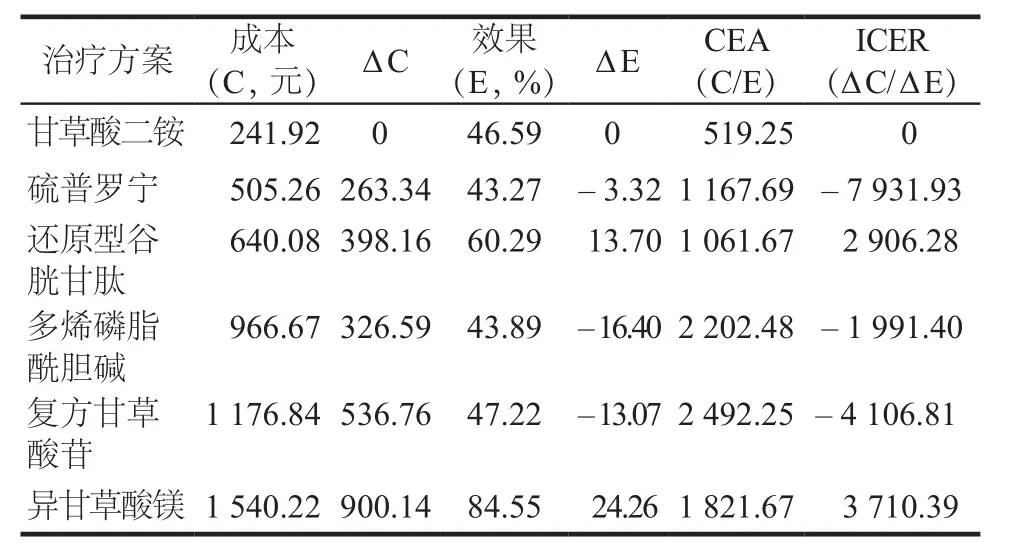
表5 以顯效率為產出指標的成本下降10%的敏感性分析結果Tab 5 Sensitivity analysis for a 10% reduction in costs of 6 groups based on excellence rate
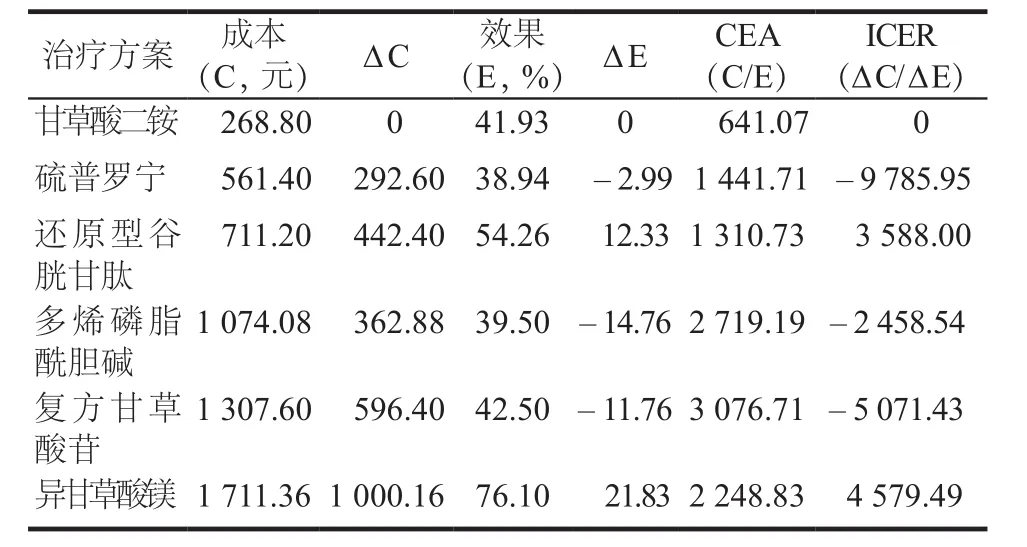
表6 以顯效率為產出指標的顯效率下降10%的敏感性分析結果Tab 6 Sensitivity analysis for 10% reduction in excellence rate of 6 groups based on excellence rate
3 討論
3.1 保肝藥物治療DILI機制
異甘草酸鎂、甘草酸二銨以及復方甘草酸苷屬于甘草酸類制劑,該類藥物可改善各類肝炎所導致的血清轉氨酶升高以及其他生化指標異常,明顯減輕肝臟的病理損害[21],甘草酸能夠改善對乙酰氨基酚引起的肝損傷。可以顯著抑制對乙酰氨基酚所致的長鏈酰基肉堿水平的增加[22]。硫普羅寧分子中含有巰基,能降低肝細胞線粒體ATP酶的活性,升高細胞內ATP的含量,同時參與肝細胞的蛋白質、糖代謝,維持肝細胞內谷胱甘肽的濃度,抑制肝細胞線粒體過氧化脂質體形成,保護肝細胞膜[23]。還原型谷胱甘肽在對外源性物質的解毒,調節細胞增殖和凋亡、免疫功能等方面起著重要作用[24],外源性補充的還原型谷胱甘肽在酶催化下可直接與氧化損傷產生的自由基結合,從而抑制或減少自由基的產生,防止肝細胞持續損傷[25]。多烯磷脂酰膽堿作為肝細胞膜修復保護劑,調節肝臟的能量代謝、促進肝細胞的再生、減少氧應激和脂質過氧化、抑制肝細胞凋亡、降低炎癥反應等,從多個方面保護肝細胞,促進肝臟組織的再生。
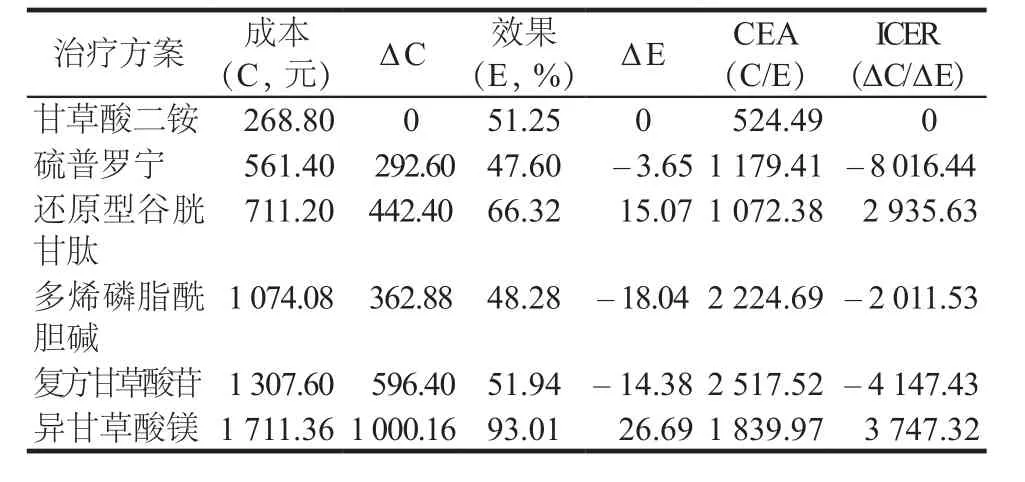
表7 以顯效率為產出指標的顯效率提高10%的敏感性分析結果Tab 7 Sensitivity analysis for 10% improvement in excellence rate of 6 groups based on excellence rate
3.2 保肝方案間的經濟學比較分析
當多個方案進行經濟學比較研究中,出現了效果較高、成本較高或效果較低、成本較低的情況下,無法直接判斷方案的經濟性,需要進行ICER的進一步的評價與分析,在此條件下需要引入成本效果閾值這一參數,也可以認為是增加一單位健康產出的最大支付意愿[26]。在6種治療方案中,以效果為產出方案中,異甘草酸鎂的療效優于其他5種治療方案;CEA異甘草酸鎂最高,甘草酸二銨最低,與甘草酸二銨相比,異甘草酸鎂的ICER為1 311.42。以顯效率為產出計算,異甘草酸鎂顯效率最高,且成本-效果比低于多烯磷脂酰膽堿和復方甘草酸苷,與甘草酸二銨相比,硫普羅寧、復方甘草酸苷、多烯磷脂酰膽堿此三種藥物為絕對劣勢方案;甘草酸二銨、還原型谷胱甘肽、異甘草酸鎂三種藥物為優勢方案。當增加一個單位健康產出的最大支付意愿值小于3 229.20元時,甘草酸二銨更具有經濟性;當最大支付意愿值介于3 229.20元 ~ 4 122.67元時,還原型谷胱甘肽具有經濟性;當最大支付意愿值大于4 122.67元時,異甘草酸鎂具有較好的成本效果優勢。因此臨床醫生在治療DILI選擇保肝藥物時,可以根據患者個人意愿支付值來選擇,呼吁醫療保健部門鼓勵臨床選擇異甘草酸鎂,并給予選擇該藥物的患者增加補貼,以提高整體的社會效益,對于經濟條件有限、治療預期低的患者,甘草酸二銨也可以作為一種選擇。
敏感性分析是經濟決策中常用的一種不確定性分析方法,對于經濟學研究結果的可信度至關重要。本研究中藥品的價格為影響結果敏感因素之一,隨著醫療改革的深入開展,藥品價格下降是必然趨勢,因此,假定藥品價格下降10%,對藥品價格進行單因素敏感性分析;本研究納入的文獻參差,而顯效率作為一個重要參數參與到成本-效果以及增量-成本效果的評價中,對顯效率進行敏感性分析,將6種保肝藥物的顯效率分別增減10%作為觀察點,進行單因素敏感性分析,經過靈敏度分析,藥品價格和顯效率對CEA和ICER的初始結果排序沒有影響,說明了本研究結果的穩定性。
3.3 局限性
本研究存在的局限性:(1)本研究納入的文獻皆為中文文獻,文獻質量參差,故臨床療效的統計可能存在選擇偏倚,通過單向敏感率分析來校正選擇偏倚,以保證結果的可靠性;(2)本研究在成本核算方面,僅考慮了藥物的直接成本,期待在以后的研究中,將考慮間接成本以及隱性成本在內的所有成本,同時從多個角度包括患者、醫院以及醫療保險付費等方面來考慮藥物經濟學問題,希望未來開展更大規模、更精細的PE研究來評價保肝藥物治療DILI的療效和經濟性。
[1] 王愛華,唐紅波,李心蕾,等.抗炎保肝藥治療藥物性肝損傷的藥物經濟學評價[J].胃腸病學和肝病學雜志,2015,24(10):1232-1237.
[2] 杜世奇,焦栓林,秦建增,等.異甘草酸鎂治療慢性藥物性肝損傷療效分析[J].肝臟,2018,23(4):312-313.
[3] Jadad AR, Moore RA, Carroll D, et al. Assessing the quality of reports of randomized clinical trials: is blinding necessary?[J].Control Clin Trials, 1996, 17(1): 1-12.
[4] 李洪超.基于文獻的藥物經濟學評價:方法和挑戰[J].藥學與臨床研究,2016,24(2):188-191.
[5] 劉幸,陳潔.3種保肝藥物治療艾滋病人的藥物性肝損傷的成本-效果分析[J].抗感染藥學,2009,6(1):66-68.
[6] 王淮,龔天斌.3種常用改善肝功能藥物治療藥物性肝損傷的效果比較[J].臨床肝膽病雜志,2016,32(4):761-763.
[7] 楊松,張耀亭,殷建團.72例抗結核藥物性肝炎的還原型谷胱甘肽治療[J].臨床肺科雜志,2006,11(6):765-766.
[8] 關榮,吳治龍.多烯磷脂酰膽堿聯合還原型谷胱甘肽治療化療藥物性肝損害的療效觀察[J].中國腫瘤臨床與康復,2014,21(10):1181-1183.
[9] 鄭于珠,張西,蔣莎莎,等.異甘草酸鎂聯合多烯磷酯酰膽堿治療化療藥物性肝損害的臨床療效觀察[J].中國醫藥指南,2013,11(23):668-669.
[10] 王新軍,田豐.復方甘草酸苷治療抗結核藥物性肝炎的臨床分析[J].中國社區醫師,2012,14(7):85-86.
[11] 顏寒斌.甘草酸二銨聯合硫普羅寧治療抗結核藥物所致中度肝損害的療效觀察[J].內蒙古中醫藥,2010,2:67-68.
[12] 路秀萍.還原型谷胱甘肽聯合門冬氨酸鉀鎂治療藥物性肝炎臨床觀察[J].中國現代藥物應用,2012,6(2):72-73.
[13] 楊惠衛,李冬雷,李潤浦,等.抗癆藥物致藥物性肝損傷患者應用異甘草酸鎂治療的臨床療效[J].現代消化及介入診療,2016,21(4):578-580.
[14] 姜建國.異甘草酸鎂注射液治療藥物性肝損傷的臨床觀察[J].中國醫師進修雜志,2010,33(4):72-73.
[15] 聶琦,袁治,陶立軒,等.異甘草酸鎂治療抗結核藥物性肝損害150例[J].實用藥物與臨床,2015,18(12):1488-1490.
[16] 張麗萍,劉幸,陳潔.三種保肝藥物治療結核病藥物性肝損傷的成本-效果分析[J].中國民族民間醫藥,2010,19(7):46-47.
[17] 陳發明.用還原型谷胱甘肽聯合多烯磷脂酰膽堿治療急性藥物性肝損害的效果研究[J].當代醫藥論叢,2015,13(15):163-164.
[18] 林躍平.復方甘草酸苷聯合還原型谷胱甘肽治療抗結核藥所致肝損害的臨床療效分析[J].現代醫藥衛生,2011,27(9):1308-1309.
[19] 孔曉東.藥物經濟學:概念、方法和應用[J].國外醫學·藥學分冊,1994,21(1):13-18.
[20] 陳婷,葉曉光.常用非酒精性脂肪性肝病藥物治療方案的藥物經濟學評價[J].肝臟,2017,22(9):794-799.
[21] Manns MP, Wedeyer H, SingerA, et al. Glycyrrhizin in patients who failed previous interferon alpha-based therapies: biochemical and histological effects after 52 weeks[J]. J Viral Hepat, 2012,19(8): 537-546.
[22] 甘草酸制劑肝病臨床應用專家委員會.甘草酸制劑肝病臨床應用專家共識[J].中華實驗和臨床感染病雜志(電子版),2016,10(1):1-9.
[23] 馬俊,馮端浩.硫普羅寧治療抗結核藥致肝損害療效的Meta分析與系統性評價[J].中國醫院用藥評價與分析,2011,11(5):390-393.
[24] Wang C, Wang W, Ma S, et al. Reduced glutathione for prevention of renal outcomes in patients undergoing selective coronary angiography or intervention[J]. J Interv Cardiol, 2015,28(3): 249-256.
[25] 張楊,沈素,程晟,等.223例注射用還原型谷胱甘肽臨床使用情況分析[J].中國藥物應用與監測,2017,14(3):173-176.
[26] 張楠,石學峰,吳晶.增量成本效果比在衛生技術評估中的應用[J].中國衛生政策研究,2012,5(2):64-68.

