微小RNA-451調控COX- 2等細胞因子對人肝癌細胞株增殖和侵襲能力的影響△
馬松林,謝飛,葉龍,呂洋
荊門市第二人民醫院普外科,湖北 荊門448000
高復發率是影響肝細胞癌(hepatocellular carcinoma,HCC)患者治療效果的主要因素之一。目前,有研究認為腫瘤微環鏡是導致腫瘤復發的重要因素。研究表明,HCC腫瘤微環境中環加氧酶2(cyclo-oxygenase-2,COX-2)表達過量是炎性反應的罪魁禍首[1]。近年來,有研究表明,microRNA通過調控腫瘤細胞的增殖、凋亡和遷移從而影響HCC的復發、轉移和預后。微小RNA-451(microRNA-451,miRNA-451)在多種腫瘤組織中的表達明顯下調,腫瘤細胞的增殖和侵襲能力明顯增強[2-4]。miRNA-451表達下調后,受其調控的巨噬細胞移動抑制因子(migration inhibition factor,MIF)表達增加,促進了腫瘤的發生和轉移[5]。本研究擬以miRNA-451為靶點,探討miRNA-451對腫瘤微環境細胞因子表達的作用,從而證明miRNA-451在抑制HCC微環境炎性遞質表達中的調控作用,為防治HCC的復發提供新的實驗室依據,現報道如下。
1 材料與方法
1.1 材料
正常肝細胞株L-02以及人肝細胞癌的HCCLM-3、MHCC-97H/L、Huh-7、SMMC-7721、HepG-2(惡性程度:HCCLM-3>MHCC-97H>MHCC-97L>Huh-7>SMMC-7721>HepG-2)細胞株均由廣西醫科大學附屬腫瘤醫院捐贈。高糖DMEM培養液和胎牛血清均購自美國Gibco公司,Trizol試劑購自美國Invitrogen公司,SYBR?Premix和逆轉錄試劑盒均購自日本Takara公司,Matrigel膠購自美國BD公司,7300型熒光定量PCR儀購自美國ABI公司。miRNA-451反轉錄引物和RT-PCR引物由上海生工生物工程股份有限公司合成。
1.2 方法
1.2.1 miRNA-451高表達細胞株構建LV-premiRNA-451慢病毒載體由上海吉凱基因化學技術有限公司構建,轉染細胞的具體步驟按照轉染試劑盒操作說明進行。
1.2.2 熒光定量RT-PCR 采用熒光定量逆轉錄聚合酶鏈反應(reverse transcription polymerase chain reaction,RT-PCR)法檢測MIF、MAPK、ERK、COX-2、轉化生長因子-β(transforming growth factor-β,TGF-β)、血管內皮生長因子(vascular endothelial growth factor,VEGF)、前列腺素 E2(prostaglandin E2,PGE2)mRNA和miRNA-451的相對表達量:取對數生長期的HCC細胞株,采用Trizol法提取細胞中的總RNA,取適量的總RNA進行逆轉錄,獲得的cDNA于-20℃保存。以cDNA為模板進行RTPCR。反應體系:每管總量為 20.0 μl,SYBR?Premix Ex Taq Ⅱ10.0 μl,上下游引物各 0.8 μl,模板2.0 μl,滅菌蒸餾水6.4 μl;反應條件:94℃預變性1 min,94℃變性30 s,60℃退火30 s,72℃延伸5 min,共30個循環;72℃延伸10 min。以GAPDH為內參。應用2-△△Ct法計算相對表達量。實驗重復3次。引物序列詳見表1。

表1 熒光定量RT-PCR的引物序列
1.2.3 Transwell實驗 采用Transwell小室檢測細胞的侵襲和轉移能力:取對數生長期的MHCC-97H細胞株作為空白對照組,轉染LV-pre-miRNA-451的MHCC-97H細胞株作為LV-pre-miRNA-451組,應用不含血清的DMEM培養基制備成1×106/ml的細胞懸液,在Transwell上室中加入100 μl的細胞懸液(細胞侵襲實驗需要制備人工基底膜,將Matrigel膠和無血清的DMEM培養基按照1∶3的比例混合),下室加入600 μl 10%胎牛血清的DMEM培養基,37℃孵育24 h后用棉簽擦去杯內細胞,在95%乙醇中固定30 min。下室細胞在吉姆薩中染色30 min。然后磷酸鹽緩沖液(PBS)沖洗細胞2次,于顯微鏡下計數,隨機選取5個視野,實驗重復3次,取平均值。
1.2.4 平板克隆實驗 空白對照組和LV-pre-miRNA-451組細胞按200/孔分別接種于6孔板,每組設置3個復孔。37℃孵箱中培養2周后進行吉姆薩染色,同時光學顯微鏡下觀察,以≥50個細胞的細胞球作為1個克隆,并計算克隆形成率;克隆形成率=(克隆形成數目/接種細胞總數目)×100%。實驗重復3次。
1.3 統計學分析
采用SPSS 19.0軟件對數據進行統計分析。計量資料以均數±標準差(±s)表示,組間比較采用t檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 RT-PCR檢測HCC細胞株中miRNA-451的相對表達量
HCC細胞株HCCLM-3中miRNA-451的相對表達量為(0.11±0.01),MHCC-97H中miRNA-451的相對表達量為(0.23±0.01),MHCC-97L中miRNA-451的相對表達量為(0.44±0.03),Huh-7中miRNA-451的相對表達量為(0.55±0.02),SMMC-7721中miRNA-451的相對表達量為(0.74±0.03),HepG2中miRNA-451的相對表達量為(0.70±0.01),與正常肝細胞株L-02細胞比較,差異均有統計學意義(P<0.05)。(圖1)
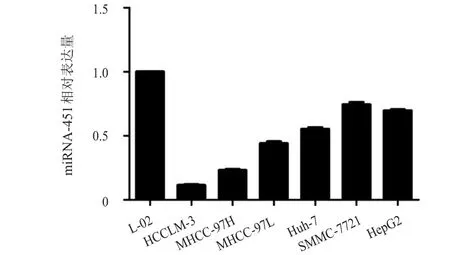
圖1 不同HCC細胞株miRNA-451的相對表達量
2.2 空白對照組和LV-pre-miRNA-451組miRNA-451的表達情況
轉染72 h后,LV-pre-miRNA-451組miRNA-451的相對表達量較空白對照組上調了(12.09±0.15)倍(P<0.05)。
2.3 MHCC-97 H細胞過表達miRNA-451后對各基因表達的影響
miRNA-451過表達后,MHCC-97H中MIFmRNA的相對表達量為(0.30±0.13),MAKPmRNA的相對表達量為(0.68±0.02),ERKmRNA的相對表達量為(0.48±0.02),COX-2mRNA的相對表達量為(0.56±0.01),TGF-βmRNA的相對表達量為(0.51±0.02),VEGFmRNA的相對表達量(0.42±0.02),PGE2mRNA的相對表達量為(0.76±0.03),與空白對照組比較,差異均有統計學意義(P<0.05)。(圖2)
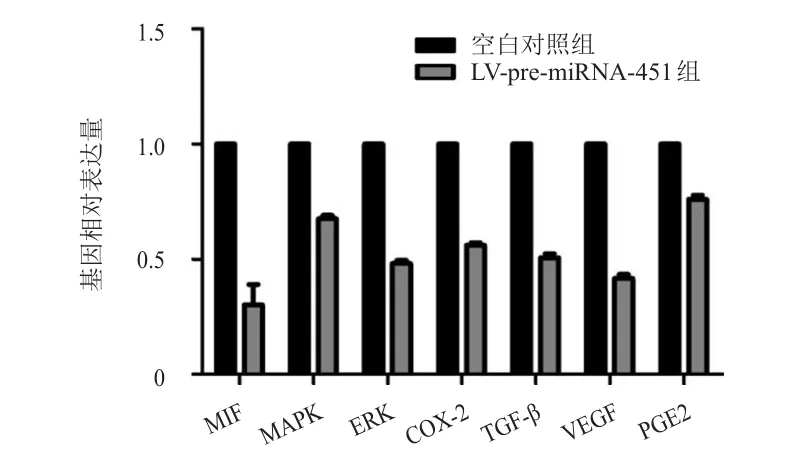
圖2 MHCC-97 H轉染LV-pre-miRNA-451后相關基因的相對表達量
2.4 Transwell侵襲實驗
培養24 h后,LV-pre-miRNA-451組侵襲至Transwell膜背面的細胞數量為(53±5)個,明顯低于空白對照組的(79±4)個,差異有統計學意義(t=7.700,P<0.01)。
2.5 Transwell遷移實驗
空白對照組細胞遷移至Transwell膜背面的細胞數量為(34±4)個,LV-pre-miRNA-451組細胞遷移至Transwell膜背面的細胞數量為(17±4)個,空白對照組明顯高于LV-pre-miRNA-451組,差異有統計學意義(P<0.01)。
2.6 平板克隆形成實驗
HCC細胞株MHCC-97H過表達miRNA-451后的平板克隆形成率為(15.7±0.5)%,明顯低于空白對照組細胞的(27.0±0.4)%,差異有統計學意義(t=31.705,P<0.01)。
3 討論
腫瘤微環境是指腫瘤局部浸潤的免疫細胞、間質細胞及所分泌的活性介質等與腫瘤細胞共同構成的局部內環境,其在腫瘤的發生、發展、侵襲和轉移過程中發揮著至關重要的作用[6]。COX-2能夠導致腫瘤微環境中TGF-β、VEGF、PGE2、白細胞介素-10(IL-10)以及IL-12等因子分泌增加,促使腫瘤復發[7-9]。因此,下調COX-2的表達對于減少腫瘤的復發具有重要意義。
有研究采用了microRNA芯片技術,對術后早期肝癌復發(2年內復發)患者的癌組織和晚期復發(2年后復發)患者的癌組織進行分析,同時與正常肝組織進行比較,發現晚期復發組中癌組織中miRNA-451表達較正常肝組織下調[10]。本研究發現,在HCC細胞株中miRNA-451的表達與腫瘤的侵襲及轉移等惡性行為關系密切。miRNA-451表達下調后,受其調控的MIF表達水平升高,促進了腫瘤的發生和轉移[5]。而在腫瘤微環境的相關研究中,有研究表明MIF通過活化MAPK/ERK信號通路,最終導致COX-2表達上調,使腫瘤微環境產生炎性反應,從而導致腫瘤復發或轉移[11]。推測miRNA-451表達下調后,MIF表達水平增高,從而導致COX-2增多,腫瘤微環境產生炎性反應,導致HCC術后遠期復發。
本研究通過HCC細胞株MHCC-97H過表達miRNA-451后發現,與腫瘤微環境相關的各基因MIF、MAKP、ERK、COX-2、TGF-β、VEGF、PGE2相對于空白對照組表達均出現下調,Transwell實驗發現侵襲和遷移至Transwell膜背面的細胞數量相對于空白對照組均明顯下降(P<0.01);MHCC-97H過表達miRNA-451后的平板克隆形成率也明顯低于空白對照組細胞(P<0.01)。因此,miRNA-451在HCC細胞株中的相對表達量下調,下調后可能通過活化MAPK/ERK信號通路,導致COX-2上調,并促進腫瘤微環境中炎性介質TGF-β、VEGF以及PGE2的生成和釋放,從而進一步促進腫瘤的復發和轉移。
miRNA-451是抑制HCC腫瘤微環境炎性反應的重要因子,通過阻斷MIF/MAPK/ERK通路,最終減少COX-2的相對表達量,降低腫瘤微環境中的炎性反應,從而減少腫瘤復發,為防治HCC的復發提供一種新的實驗室依據。
[1]Yang HJ,Jiang JH,Yang YT,et al.Cyclooxygenase-2 expression is associated with initiation of hepatocellular carcinoma,while prostaglandin receptor-1 expression predicts survival[J].World J Gastroenterol,2016,22(39):8798-8805.
[2]Wang R,Wang ZX,Yang JS,et al.MicroRNA-451 functions as a tumor suppressor in human non-small cell lung cancer by targeting ras-related protein 14(RAB14)[J].Oncogene,2011,30(23):2644-2658.
[3]Bandres E,Bitarte N,Arias F,et al.microRNA-451 regulates macrophage migration inhibitory factor production and proliferation of gastrointestinal cancer cells[J].Clin Cancer Res,2009,15(7):2281-2290.
[4]Huang JY,Zhang K,Chen DQ,et al.MicroRNA-451:epithelial-mesenchymal transition inhibitor and prognostic biomarker of hepatocelluar carcinoma[J].Oncotarget,2015,6(21):18613-18630.
[5]Mamoori A,Gopalan V,Lu CT,et al.Expression pattern of miR-451 and its target MIF(macrophage migration inhibitory factor)in colorectal cancer[J].J Clin Pathol,2017,70(4):308-312.
[6]Dehne N,Mora J,Namgaladze D,et al.Cancer cell and macrophage cross-talk in the tumor microenvironment[J].Curr Opin Pharmacol,2017,35:12-19.
[7]Ma X,Aoki T,Tsuruyama T,et al.Definition of prostaglandin e2-ep2 signals in the colon tumor microenvironment that amplify inflammation and tumor growth[J].Cancer Res,2015,75(14):2822-2832.
[8]Lerrer S,Liubomirski Y,Bott A,et al.Co-Inflammatory roles of TGFβ1 in the presence of TNFα drive a pro-inflammatory fate in mesenchymal stem cells[J].Front Immunol,2017,8(4):479.
[9]Gandhi J,Khera L,Gaur N,et al.Role of modulator of inflammation cyclooxygenase-2 in gammaherpesvirus mediated tumorigenesis[J].Front Microbiol,2017,8(e1004581):538.
[10]姜經航,郭哲,楊浩潔,等.肝細胞癌根治術后早期復發相關microRNAs的篩選[J].中國癌癥防治雜志,2014,6(3):224-229.
[11]Pan X,Wang R,Wang ZX.The potential role of miR-451 in cancer diagnosis,prognosis,and therapy[J].Mol Cancer Ther,2013,12(7):1153-1162.

