PD?L1在食管鱗癌中的表達及其與食管鱗癌預后的關系*
杜國波,謝曉翠,周晶(.川北醫學院附屬醫院腫瘤科,四川南充637000;.醫學影像四川省重點實驗室,四川南充637400)
食管癌已成為全球癌癥相關死亡的第五大因素,我國食管癌發生率和死亡率位居第4位,盡管其發病率與死亡率呈下降趨勢,但依然對人類健康和生命存在極大威脅[1-2]。食管癌目前主要治療手段為傳統的手術結合放化療,但總體5年生存率目前仍徘徊在30%左右,如何尋找與臨床療效相關的分子標記物及這些分子標記是否可以作為新的治療靶點是近年來各大腫瘤研究領域的熱點問題。
程序性死亡分子1配體(PD-L1)屬于B7家族的一個共刺激信號分子。PD-L1作為程序性死亡受體1(PD-1)阻斷T細胞活化及介導腫瘤免疫抑制的主要配體,其在多種細胞(T細胞、B細胞、單核-巨噬細胞和全稱樹突狀細胞等)上表達[3]。近幾年,針對PD-1/PD-L1通路的單克隆抗體治療是腫瘤免疫治療的一個重大突破,其在惡性黑色素瘤、非小細胞肺癌、腎癌、膀胱癌等癌癥治療中表現出令人振奮的療效[4]。但其在食管鱗癌(ESCC)中的研究報道較少,PD-1/PD-L1的表達和ESCC預后之間的關系存在爭議,其作用機制也有待進一步研究。本研究擬探討ESCC組織中PD-L1的表達情況及其與ESCC預后的關系。
1 資料與方法
1.1一般資料選取2012年5月至2015年12月就診于川北醫學院附屬醫院并經過術后病理確診為ESCC的108例患者,其中男75例,女33例;年齡(63.5±5.3)歲,未進行術前放、化療,有完整的臨床病理及隨訪資料。取108例患者的ESCC組織、60例癌旁食管組織。
1.2方法
1.2.1PD-L1表達檢測方法采用免疫組織化學(免疫組化)法。蠟塊切片4~5μm,置于二甲苯Ⅰ、Ⅱ中脫蠟10 min,放切片于梯度酒精脫水,切片浸入枸櫞酸鈉緩沖液中并加熱,沸騰20 min進行抗原修復。然后封閉抗原,加入一抗,濕盒中4℃孵育過夜,滴加二抗,室溫孵育盒中孵育30 min,然后二氨基聯苯胺法(DAB)顯色,洗滌封片后光鏡下觀察拍照。免疫組化結果采用Fromowitz半定量分級法分析,以腫瘤細胞染色強度和陽性細胞比例進行計分。計分標準:無著色(0分),淡黃色(1分),棕黃色(2分),棕褐色(3分)。陽性細胞比例計分是在光學顯微鏡下隨機選擇5個高倍鏡視野(400×),計算呈現染色陽性的腫瘤細胞占視野內所有腫瘤細胞的百分比,以各視野的均值作為陽性細胞百分比,計分標準:<10%腫瘤細胞著色(0分),10%~30%腫瘤細胞著色(1分),>30%~60%腫瘤細胞著色(2分),>60%腫瘤細胞著色(3分)。以染色強度評分與陽性細胞比例評分的乘積為最終分值。最終分值0~3分定義為陰性,4~9分定義為陽性。
1.2.2隨訪隨訪方式為電話、門診及復診病例資料隨訪,隨訪結束時間為患者死亡,末次隨訪時間為2017年6月16日。隨訪率為95.4%。隨訪到截止時間,108例患者共有62例死亡,其中3例死于非腫瘤(感染、放射性肺炎、心肺意外),存活41例,失訪5例。
1.3統計學處理采用SPSS17.0統計軟件進行數據處理,計數資料以率表示,組間比較采用χ2檢驗;生存資料采用中位數表示,組間比較采用Kaplan-Meier法和Log-Rank法進行生存率分析;采用Cox比例風險模型進行多因素分析。P<0.05為差異有統計學意義。
2 結 果
2.1PD-L1在ESCC中的表達情況PD-L1免疫組化染色主要定位于細胞膜或細胞質,呈棕黃色顆粒,見圖1。在癌組織、癌旁組織中PD-L1陽性表達率分別為54.6%(59/108)、16.7%(10/60),癌組織 PD-L1陽性表達率顯著高于癌旁組織,差異有統計學意義(χ2=22.968,P<0.01)。
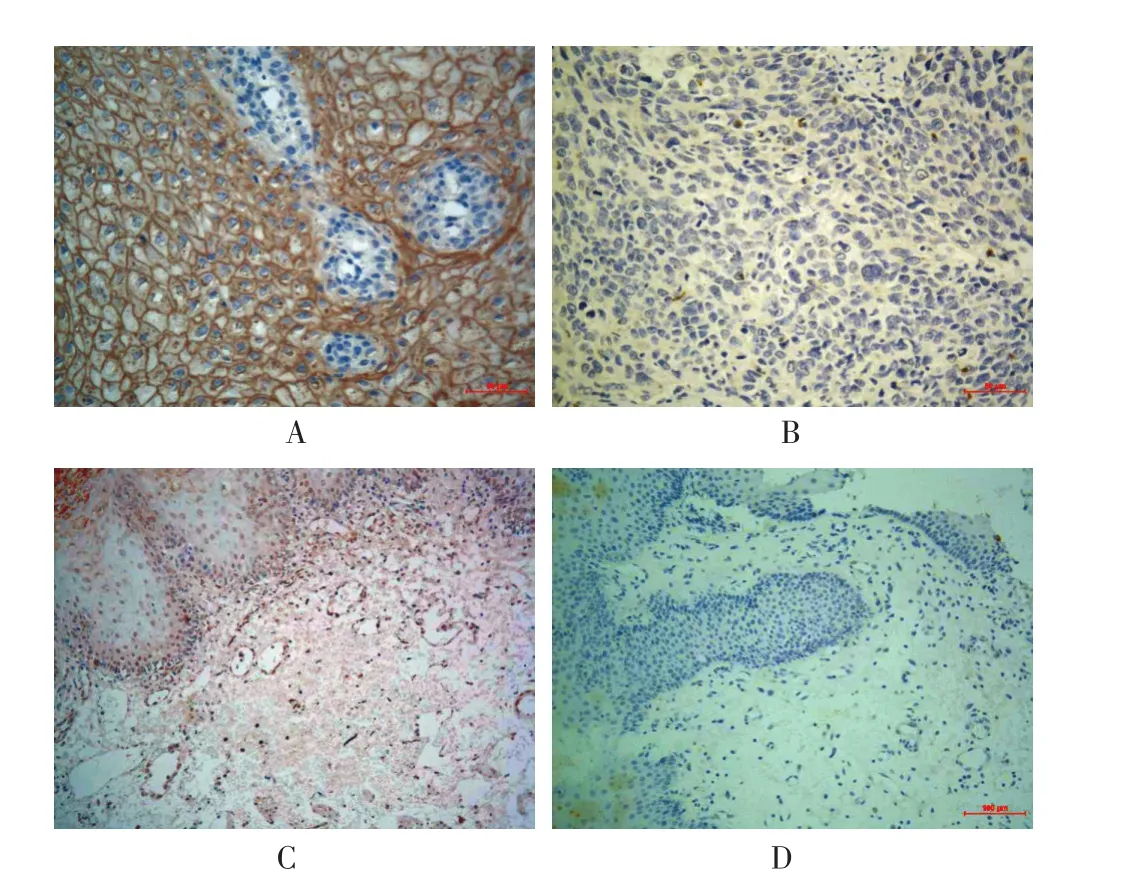
圖1 PD-L1免疫組化染色情況
2.2PD-L1與ESCC臨床病理參數的關系PD-L1表達水平與ESCC淋巴結轉移有關(P<0.05),而與患者的年齡、性別、病變部位、病變長度、腫瘤浸潤深度、臨床分期無顯著相關性(P>0.05),見表1。

表1 PD-L1表達和ESCC臨床病理參數的關系(n)
2.3PD-1表達與ESCC患者預后的關系經Kaplan-Meier法計算得PD-L1表達陽性組中位生存時間為18個月,表達陰性組為25個月,PD-L1表達陽性組3年總生存率為25.2%,表達陰性組3年總生存率為47.9%,PD-L1表達陽、陰性組中位生存時間、總生存率比較,差異均有統計學意義(P<0.05)。單因素分析及Cox回歸模型進行多因素分析,結果顯示,T分期和PD-L1為獨立預后因素。見圖2。

圖2 Kaplan-Meier法對108例ESCC患者的總生存期的分析結果
3 討 論
食管癌在全球范圍內呈現明顯的地區分布差異,不同地區的發病率和病死率有明顯差異[5]。據2015年發布的中國最新癌癥登記年報,中國西南部食管癌的新發病例數及死亡數占據年報所示國內7個大區的第1位,川東北地區長久以來被認為是全國的第2個食管癌高發現場[2],防控形勢極為嚴峻。食管癌中約90%為鱗狀細胞癌。研究顯示,食管癌病因與遺傳因素和飲食習慣有明顯關系,但確切發病機制不詳[6-7]。
PD-L1是近年來新發現的B7家族成員之一,對調節T細胞或B細胞的免疫功能具有明顯的效應[8]。研究發現,當PD-L1與受體PD-1結合后可促進效應T細胞凋亡,降低效應T細胞對腫瘤細胞的殺傷力,促進腫瘤的發生[9]。近年來,大量研究關于PD-L1在惡性腫瘤中表達與臨床病理特征、預后的相關性,但關于PD-L1表達與ESCC患者臨床病理參數和預后關系的文獻報道研究較少。因此,本研究檢測了ESCC組織中PD-L1的表達情況,并分析其與患者預后的關系。結果顯示,癌組織PD-L1表達水平顯著高于癌旁組織(54.6%vs.16.7%),PD-L1陽性表達患者淋巴結轉移率更高(64.9%vs.35.1%),PD-L1陽性表達與年齡、性別、病變部位、病變長度、腫瘤浸潤深度、臨床分期無顯著相關性(P>0.05),與 LENG等[10]的結論一致。本研究結果還顯示,PD-L1陽性者較陰性者的中位生存時間更低(18個月vs.25個月),3年總生存率更差(25.2%vs.47.9%),與張鋒等[11]的研究結果一致。PD-L1可能作為預測食管癌疾病進展和預后的一個新的指標。WU等[12]的meta分析顯示,實體瘤PD-L1陽性表達的預后更差,其中PD-L1陽性表達的食管癌患者的3年生存率更差。最近TSUTSUMI等[13]的研究也顯示,PD-L1陽性表達的食管癌患者預后更差,與JIANG等[14]的研究結論和QU等[15]的meta分析一致。而ZHANG等[16]研究結果顯示,食管癌腫瘤細胞PD-L1陽性表達者5年總生存率和無病生存率與陰性表達者無顯著差異,而食管癌組織中腫瘤浸潤免疫細胞的PD-L1陽性表達者5年總生存率高于陰性表達者者(37.6%vs.20.5%),無病生存率也明顯高于陰性組(37.6%vs.18.9%),提示PD-L1在腫瘤浸潤免疫細胞的表達而不是腫瘤細胞的表達與食管癌預后有關。而CHEN等[17]的報道結果相反,PD-L1陽性表達降低了ESCC疾病復發風險,中位無病生存率更高,但總生存率無統計學差異,研究結果與大多數研究結論不一致。作者認為,雖然研究顯示PD-L1與受體PD-1結合后導致腫瘤細胞的免疫抵抗,但過高的PD-L1的表達可能促進PD-L1與PD-1之外的其他未知受體結合,導致T細胞增殖、某些細胞因子如白細胞介素10、γ-干擾素等的分泌增加,使機體抗腫瘤作用增強,促進免疫應答[18],但這種推斷需要進一步研究證實。CHEN等[19]在機制方面進行了探討,研究顯示PD-L1的表達能夠促進食管癌細胞的增殖、侵襲和上皮間質轉化。
總之,多數研究顯示PD-L1陽性表達的食管癌患者預后更差,PD-L1是否可作為預測食管癌疾病進展和預后的新指標,以及PD-L1參與食管癌及其他實體惡性腫瘤發生、發展過程的確切分子機制都需要進一步研究。

