抓好幾條主線,提高化學(xué)復(fù)習(xí)的效率
海南 夏繼文 李 莉
2017年高考已漸漸遠(yuǎn)去,2018年高考漸漸臨近,奮戰(zhàn)在高三一線的教師和學(xué)生們正在緊張地復(fù)習(xí)和探索中。如何在有限的時(shí)間里提高復(fù)習(xí)效率,復(fù)習(xí)方法至關(guān)重要,化學(xué)學(xué)科是知識(shí)點(diǎn)比較零散的學(xué)科,很多老師和學(xué)生認(rèn)為只要花時(shí)間去記憶就能學(xué)好,對(duì)于初學(xué)化學(xué)知識(shí)的學(xué)生來(lái)說(shuō)好像是有效的,但要應(yīng)付高考這一招是不靈的。面對(duì)知識(shí)點(diǎn)眾多、條理性不是很強(qiáng)的化學(xué)復(fù)習(xí),很多同學(xué)一籌莫展,無(wú)所適從。作為高三教師有必要從更高的高度為學(xué)生整理出化學(xué)復(fù)習(xí)的主線,筆者整理出了化學(xué)復(fù)習(xí)中幾條重要的主線,供同仁們參考。
一、元素、原子主線。化學(xué)學(xué)習(xí)是從元素、原子開始的,它貫穿化學(xué)學(xué)習(xí)的全過程,元素、原子之間的內(nèi)在聯(lián)系在元素周期表和元素周期律中有所體現(xiàn)。因此活用元素周期表、巧用元素周期律可以解決這方面的大多數(shù)問題,同時(shí)要知道“三素”概念的異同,即元素、核素(同位素)、同素異形體概念的區(qū)別和聯(lián)系,由此還可以延伸出一些化學(xué)概念,如單質(zhì)和化合物,氧化物,酸、堿、鹽、合金的概念等。
二、分類主線。縱觀上次課改后的新教材(現(xiàn)在使用的人教版),其章節(jié)就是按分類的觀點(diǎn)來(lái)設(shè)置的,如實(shí)驗(yàn)、金屬和非金屬、化學(xué)反應(yīng)中的能量變化、化學(xué)反應(yīng)原理、有機(jī)物都是分類后集中來(lái)學(xué)習(xí)的。分類是一種很好的學(xué)習(xí)方法,復(fù)習(xí)時(shí)要充分利用這種方法來(lái)提高效率。化學(xué)知識(shí)中的分類起初是從化學(xué)反應(yīng)方面的分類開始的,之后又將其繼續(xù)分化出四種基本類型反應(yīng),高中又從新的分類角度分為氧化還原反應(yīng)和非氧化還原反應(yīng)、離子反應(yīng)和非離子反應(yīng),有機(jī)化學(xué)中又將反應(yīng)分為加成、取代、消去、氧化、還原、加聚、縮聚等。另一種分類方法體現(xiàn)在物質(zhì)類別上的分類,教材上重點(diǎn)介紹了樹狀分類法和交叉分類法、分散系的分類等方面,這部分內(nèi)容的掌握要注意概念的嚴(yán)謹(jǐn)性和包含關(guān)系。
三、物質(zhì)構(gòu)成的微粒主線。構(gòu)成物質(zhì)的微粒主要有分子、原子和離子,它們質(zhì)量和體積很小,為了更好地學(xué)習(xí),化學(xué)上引入相對(duì)原子質(zhì)量和相對(duì)分子質(zhì)量。物質(zhì)的量及阿伏加德羅定律是解決它們間數(shù)量關(guān)系的重要概念,也是高考中必考知識(shí)點(diǎn);原子序數(shù)、核電荷數(shù)、質(zhì)子數(shù)、中子數(shù)等概念,物質(zhì)結(jié)構(gòu)上要求學(xué)生寫出原子結(jié)構(gòu)示意圖、電子式和核外電子排布規(guī)律等。更需要牢固掌握由此演變出的化學(xué)用語(yǔ),例如元素符號(hào)、分子式、化學(xué)式、結(jié)構(gòu)式、結(jié)構(gòu)簡(jiǎn)式、離子符號(hào)、化學(xué)方程式、離子方程式、電離方程式、熱化學(xué)方程式等;這些微粒在構(gòu)成物質(zhì)時(shí)需要掌握離子鍵、共價(jià)鍵、氫鍵和分子間作用力等相關(guān)內(nèi)容,還要與原子結(jié)構(gòu)相聯(lián)系,了解原子結(jié)構(gòu)與族、周期的關(guān)系等。學(xué)生能將這些看似不相干的內(nèi)容整合在一起,可以大大提高學(xué)習(xí)效率。

A.+4 B.+5
C.+6 D.+7
本題就是典型的氧化還原反應(yīng)中得失電子守恒的題目,答案為C。
五、定量配比主線。熟悉各種方程式中計(jì)量數(shù)的含義,主要考查化學(xué)反應(yīng)或離子方程式書寫時(shí)反應(yīng)物過量或不足時(shí)的產(chǎn)物的確定。如:往FeBr2溶液中通入Cl2,當(dāng)Cl2少量時(shí)產(chǎn)物的離子方程式,過量時(shí)反應(yīng)離子方程式的書寫;NaOH溶液中通入少量CO2和足量CO2時(shí)產(chǎn)物的書寫和相關(guān)計(jì)算;再如向NaHCO3溶液中加入少量和過量的澄清石灰水離子方程式的書寫;AlCl3溶液中加入少量或足量的NaOH溶液時(shí)產(chǎn)物離子方程式的書寫;鐵粉與少量和過量的稀HNO3溶液反應(yīng)方程式的書寫等。
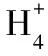
七、平衡主線。平衡主線的內(nèi)容主要包括弱電解質(zhì)的電離平衡、難溶物質(zhì)的沉淀溶解平衡、弱酸陰離子和弱堿陽(yáng)離子的水解平衡、氣體的溶解和揮發(fā)平衡。這些平衡原理的相似性極高,它們有某些相同的特征,且表面靜止,但都是動(dòng)態(tài)平衡,這些平衡受外界因素影響會(huì)發(fā)生移動(dòng),都適合用勒夏特列原理來(lái)解釋。要學(xué)好這部分內(nèi)容需弄清概念上的區(qū)別,以及各種平衡對(duì)應(yīng)的平衡常數(shù)的表達(dá)式。“考綱”中對(duì)化學(xué)平衡的要求是掌握化學(xué)平衡的特征,能利用化學(xué)平衡常數(shù)進(jìn)行相關(guān)的計(jì)算,要理解外界條件對(duì)平衡的影響。可以說(shuō)要求很高,學(xué)生學(xué)習(xí)難度較大,但這是高頻考點(diǎn),近些年高考中全國(guó)卷和一些自主命題的省份多有考查,所以老師和同學(xué)們必須足夠重視。
八、能量最低主線和離子濃度最小主線。化學(xué)反應(yīng)的自發(fā)進(jìn)行大多數(shù)遵循能量下降原理,自然界中很多自發(fā)進(jìn)行的現(xiàn)象也遵循這一原理。離子濃度最小主線可以對(duì)復(fù)分解反應(yīng)為什么會(huì)發(fā)生作出很好的解釋,生成沉淀、水和氣體主要是溶液中離子濃度減小;它也可以進(jìn)一步解釋為什么溶解度小的物質(zhì)易轉(zhuǎn)化為溶解度更小的物質(zhì);為什么AgCl沉淀會(huì)在氨水中溶解形成銀氨溶液,也是因?yàn)殂y氨絡(luò)離子電離出Ag+比AgCl溶解電離出Ag+更難。


