吳茱萸次堿抑制AngⅡ誘導的血管平滑肌Cx43表達上調
汪小英,余艷榮,王美玲,彭維杰,,羅 丹
(南昌大學1. 基礎醫學院生理學系、2. 藥學院藥理重點實驗室、3. 江西省醫學科學院,江西 南昌 330006)
血管平滑肌細胞(vascular smooth muscle cells,VSMCs)異常增殖和表型轉化是高血壓、動脈粥樣硬化、血管成形術后狹窄等血管重構病變發生、發展的重要病理基礎。 縫隙連接蛋白43(connexin43,Cx43)是構成VSMCs間縫隙連接的主要連接蛋白,參與調節VSMCs功能。近年來的大量研究發現,Cx43表達異常增高是多種病理因素誘導VSMCs增殖的重要機制,而靶向抑制Cx43成為藥物和基因手段改善血管重構的研究熱點[1]。血管壁局部腎素-血管緊張素-醛固酮系統亢進導致的血管緊張素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)增高,是誘導VSMCs增殖和表型轉換的重要病理因素。研究表明,AngⅡ誘導的VSMCs功能改變與Cx43表達增高有關。在大鼠胸主動脈和人隱靜脈平滑肌的研究均發現,Ang II可劑量依賴性地上調Cx43表達。Alonso等[2]的研究進一步發現,AngⅡ可激活NF-κB途徑,導致p65-NF-κB核轉位,后者可與編碼Cx43的Gja1基因啟動子結合,從而促進Cx43表達。
吳茱萸作為傳統中藥,在臨床上被應用了數千年,其主要有效成分吳茱萸次堿(rutaecarpine,Rut)具有廣泛的心血管保護效應,如抗炎、抗血栓、舒血管等[3]。Rut作為一種天然產物提取物,可能通過多靶點發揮藥理學作用,其中辣椒素受體(transient receptor potential vanilloid 1,TRPV1)被認為是Rut發揮心血管保護作用的重要靶點[3]。TRPV1廣泛分布于血管組織中,血管內皮細胞和平滑肌細胞均有表達。我們實驗室前期在血管內皮的研究中發現,Rut可抑制溶血性磷脂酰膽堿[4]和Ox-LDL誘導的內皮Connexin表達模式的改變,從而改善內皮功能[5],其機制與激活TRPV1有關。因此,本研究以大鼠胸主動脈平滑肌細胞為研究對象,探討Rut對AngⅡ誘導的Cx43表達改變及VSMCs功能變化的影響,并探討其機制是否涉及TRPV1/NF-κB途徑。
1 材料與方法
1.1藥品與試劑Rut(純度>99%,上海君拓生物技術有限公司);AngⅡ、TRPV1的競爭性拮抗劑辣椒卓平(Capsazepine,CAPZ),均購自美國Sigma公司;CCK-8(北京全式金生物技術有限公司);EdU檢測試劑盒(廣州銳博生物技術有限公司);α-平滑肌肌動蛋白(α-smooth muscle actin,α-SMA)和調寧蛋白(Calponin)抗體(Proteintech公司);Cx43和NF-κB p65抗體(CST公司);免疫細胞化學試劑盒(SP-9001,北京中杉金橋有限公司);抗Cyclin D1抗體、細胞周期試劑盒(江蘇碧云天生物技術有限公司);BCA蛋白定量試劑盒、胞質/核蛋白提取試劑盒(北京普利萊生物技術有限公司)。
1.2儀器酶聯免疫檢測儀、電泳儀和自動曝光儀(美國Bio-Rad公司);流式細胞儀(美國Becton Dickinson公司);熒光顯微鏡(日本Olympus公司)。
1.3實驗分組取大鼠胸主動脈,組織貼塊法原代培養VSMCs,采用含10% FBS的DMEM培養基培養,傳代后取3~8代用于后續實驗。按實驗目的加入不同的處理因素:①正常對照組(Control);②AngⅡ損傷組:加入AngⅡ(終濃度為1 μmol·L-1)孵育VSMCs 24 h;③~⑤Rut(低、中、高)保護組:加入Rut(終濃度為0.3、1.0、3.0 μmol·L-1)孵育VSMCs后,再加入AngⅡ繼續孵育24 h;⑥CAPZ+Rut(H)組:用TRPV1受體阻斷劑CAPZ(10 μmol·L-1)預處理細胞10 min后,再加入Rut(3.0 μmol·L-1)孵育10 min,后加入AngⅡ繼續孵育24 h。
1.4Westernblot檢測Cx43、CyclinD1、α-SMA、Calponin蛋白表達水平裂解細胞并提取總蛋白樣品,經BCA法蛋白定量,變性。制膠,上樣,聚丙烯酰胺凝膠電泳,濕法轉膜。5%的脫脂牛奶室溫封閉2 h,與一抗(1 ∶1 000稀釋)結合,4℃孵育過夜。洗膜,與二抗結合(1 ∶5 000稀釋),室溫孵育1 h。洗膜,加入ECL化學發光液于自動曝光儀下檢測。使用Image J軟件進行灰度分析,以β-actin或GAPDH的密度值為內參,計算相對密度,作為蛋白表達水平進行比較分析。
1.5Westernblot結合免疫細胞化學檢測NF-κBp65核轉位收集細胞至1.5 mL EP管,4℃、12 000 r·min-1離心5 min,棄去PBS,于沉淀中加入100 μL CEB-A,劇烈振蕩后冰浴15 min;于裂解物體積中加入5 μL CEB-B,冰浴1 min。4℃、12 000 r·min-1離心5 min,沉淀即是核粗提物,上清為粗制的胞質蛋白組分。將上清轉入另一預冷的離心管,再次離心沉淀,取上清即是胞質蛋白組分。取上述核粗提物沉淀,加入100 μL CEB-A和5 μL CEB-B振蕩,冰浴1 min,離心棄上清,重復此步驟。在離心沉淀中加入100 μL 預冷的NEB,冰浴30 min,離心,取上清即為核蛋白組分。其余步驟同“1.4”。
免疫細胞化學:4%多聚甲醛固定細胞30 min,PBS清洗3次;3%過氧化氫37℃孵育10 min,PBS清洗3次;正常羊血清工作液37℃孵育10 min;NF-κB p65(1 ∶100稀釋)一抗4℃孵育過夜。加入二抗于37℃孵育15 min;鏈霉素卵白素工作液37℃孵育15 min;加入新配制的DAB溶液2 min后,于顯微鏡下觀察細胞著色情況。
1.6CCK-8和EdU試劑盒檢測VSMCs增殖
1.6.1CCK-8法 將VSMCs消化后制成單細胞懸液,以每孔5×105個細胞均勻接種于96孔板,每孔200 μL,每組6個復孔,同時設置調零孔(只加等體積培養基,不加細胞)。24 h后向各孔加入20 μL的CCK-8試劑,在細胞培養箱中避光繼續孵育1~4 h,終止培養,在450 nm波長處用酶標儀檢測各孔吸光度。細胞活力(OD)=樣品吸光度值-調零孔。
1.6.2EdU標記法 用無血清培養基按1 000 ∶1稀釋EdU試劑A;各組加入100 μL 孵育2 h;4%多聚甲醛室溫固定30 min;于各孔加入2×10-3mg·L-1甘氨酸溶液,5 min后用PBS洗3次;加入1×Apollo染色液100 μL,避光孵育30 min,棄去,加入100 μL通透液,室溫10 min;加入甲醇100 μL,清洗2次;制備適量1×Hoechst 33342反應液,各孔加入100 μL,避光孵育30 min,PBS洗3次;染色結束后,立刻于顯微鏡下拍照記錄。
1.7流式細胞術測定VSMCs細胞周期變化胰酶消化并收集細胞,轉移到離心管,2 000×g離心5 min沉淀細胞。PBS洗滌2次,離心除上清。用70%乙醇于4℃固定過夜。再次離心沉淀細胞,PBS清洗去上清,最后向各管加入0.5 mL PI,輕輕吹打細胞沉淀,使之與染料充分接觸,37℃水浴避光孵育30 min,轉移至流式管,立即用流式細胞儀檢測。

2 結果
2.1AngⅡ對平滑肌細胞Cx43蛋白表達的影響Fig 1的Western blot結果顯示,AngⅡ孵育VSMCs可時間依賴性上調Cx43的表達,8 h時Cx43水平明顯上調,24 h作用最為明顯(P<0.01)。
2.2Rut對AngⅡ誘導的Cx43表達的影響如Fig 2所示,不同濃度的Rut均能明顯抑制AngⅡ誘導的Cx43表達上調,預先給予TRPV1阻斷劑CAPZ可取消這一效應(P<0.01)。
2.3Rut抑制NF-κBp65轉位Fig 3A的Western blot結果顯示,Ang Ⅱ孵育細胞4 h可明顯增加細胞核中NF-κB p65的水平,胞質中NF-κB p65水平則下降。不同濃度的Rut能劑量依賴性抑制AngⅡ誘導的p65入核,CAPZ可取消Rut這一效應(P<0.05)。免疫細胞化學結果顯示,AngⅡ孵育細胞4 h可明顯促進NF-κB p65蛋白從細胞質轉位到細胞核,Rut(3.0 μmol·L-1)能在一定程度上抑制其入核,該效應可被CAPZ所阻斷(Fig 3B)。
2.4Rut對AngⅡ誘導的VSMCs增殖的影響Fig 4的EdU結果顯示,AngⅡ可增加VSMCs的EdU陽性細胞百分率(P<0.01),不同濃度的Rut可抑制增殖期陽性細胞數量,該效應可被TRPV1受體阻斷劑CAPZ(10 μmol·L-1)阻斷(P<0.01)。CCK-8結果顯示,AngⅡ孵育細胞24 h可明顯促進VSMCs增殖(P<0.05),不同濃度的Rut可劑量依賴性減少AngⅡ誘導的細胞增殖,預先給予CAPZ可取消Rut的這一效應(P<0.01)。
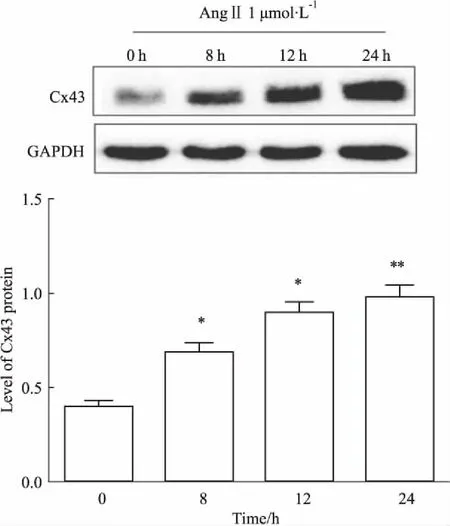
Fig 1 Effect of AngⅡ treatment on expressionof Cx43 in
*P<0.05,**P<0.01vscontrol group

Fig 2 Effect of Rut on expressionof Cx43 induced by AngⅡ
*P<0.05vscontrol group;#P<0.05,##P<0.01vsAngⅡ group;▲▲P<0.01vsAngⅡ+Rut (3 μmol·L-1) group
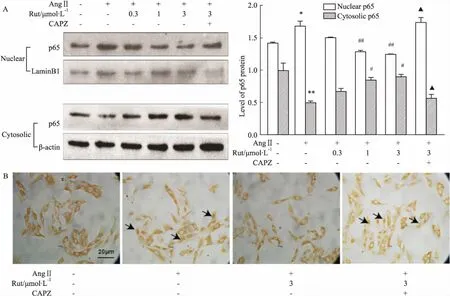
Fig 3 Possible mechanism of Rut in down-regulation of

Fig 4 Effects of Rut on proliferation of VSMCs induced by AngⅡ
2.5Rut對AngⅡ誘導的VSMCs周期分布的影響Fig 5的流式細胞周期結果顯示,AngⅡ可增加增殖期細胞(S期+G2/M期)的比例(P<0.05)。Rut(3.0 μmol·L-1)可明顯降低AngⅡ誘導的增殖期VSMCs比例(P<0.01),該效應可被CAPZ所取消(P<0.05)。Western blot結果顯示,AngⅡ可上調細胞周期蛋白Cyclin D1的表達,Rut可明顯抑制Ang II誘導的Cyclin D1表達上調(P<0.01),CAPZ可取消Rut的這一作用(P<0.01)。
2.6Rut對AngⅡ誘導的VSMCs表型的影響如Fig 6所示,加入AngⅡ孵育48 h后,VSMCs細胞表面收縮型標志蛋白α-SMA和Calponin表達均降低,Rut可部分恢復二者的表達水平,該效應可被CAPZ阻斷(P<0.01)。
3 討論
Rut是傳統降壓藥吳茱萸的主要有效成分,Qin等[6]在研究Rut的降壓機制時發現,Rut可改善高血壓導致的阻力血管的重構。最近有研究報道,Rut還可抑制AngⅡ誘導的VSMCs增殖[7],但具體機制未明。Cx43是構成VSMCs間縫隙連接的主要蛋白,參與調控VSMCs功能,被認為是改善血管重構的重要靶點[8-9]。國外學者在培養的人隱靜脈平滑肌細胞和大鼠胸主動脈平滑肌細胞均發現,AngⅡ誘導的VMSCs功能改變與上調Cx43表達有關[2,10]。我們在大鼠胸主動脈VSMCs也證實,AngⅡ(1.0 μmol·L-1)可明顯上調Cx43的表達,而不同濃度的Rut均可抑制AngⅡ誘導的Cx43表達增加。這提示Rut可能通過抑制Cx43的表達,改善VSMCs功能。Rut是TRPV1的部分激動劑[11],其主要心血管效應均與激活TRPV1有關[12]。本實驗發現,Rut抑制Cx43表達的作用可被TRPV1競爭性阻斷劑CAPZ所阻斷,提示TRPV1介導了Rut調節Cx43的作用。

Fig 5 Effect of Rut on VSMCs cell cycle induced by AngⅡ

Fig 6 Effect of Rut on VSMCs phenotype transformation by AngⅡ using Western
*P<0.05,**P<0.01vscontrol group;#P<0.05vsAngⅡ group;▲▲P<0.01vsAngⅡ+Rut (3 μmol·L-1) group
Alonso等[2]在培養的大鼠胸主動脈VSMCs中發現,AngⅡ上調Cx43的表達與促進NF-κB亞基 p65核轉位有關,主要證據如下:大鼠編碼Cx43的Gja1基因啟動子的-312~-301 bp有NF-κB的結合區,熒光報告基因結果顯示,AngⅡ可促進NF-κB和該啟動區的結合,而ChIP結果證實,AngⅡ激活啟動子的效應可被NF-κB抗體所取消。本實驗采用Western blot及免疫細胞化學結果均顯示,AngⅡ誘導的VSMCs在4 h即可促進p65由細胞質轉移到細胞核,而不同濃度的Rut可抑制AngⅡ誘導的p65核轉位,預先給予CAPZ可取消Rut的作用。以上結果提示,Rut激活TRPV1下調Cx43表達的作用,可能與抑制AngⅡ誘導的NF-κB的激活有關。
在人大隱靜脈VSMCs的研究中發現,過表達Cx43可明顯促進人VSMCs的增殖能力,而敲除Cx43則抑制AngⅡ誘導的VSMCs增殖和細胞周期蛋白Cyclin E的表達上調[10],提示AngⅡ誘導的VSMCs增殖與Cx43表達上調有關。本實驗進一步證實,Rut可抑制AngⅡ誘導的VSMCs增殖,表現為逆轉AngⅡ誘導的VSMCs內的DNA合成增加及細胞活力升高。細胞周期結果顯示,AngⅡ可導致增殖期(S+G2/M期)細胞的比例增加,伴隨細胞周期蛋白Cyclin D1水平增加,后者作為細胞周期正性調節因子可促進細胞增殖。而Rut可明顯抑制Cyclin D1的表達上調和AngⅡ誘導的細胞周期轉換,預先給予CAPZ可阻斷Rut的這些抗增殖效應。由此我們推論,Rut可抑制AngⅡ誘導的VSMCs增殖,其機制至少部分與激活TRPV1,抑制有促增殖效應的Cx43的表達有關。
VSMCs表型轉換是導致VSMCs功能異常的重要原因,本實驗發現,加入AngⅡ孵育后,VSMCs的收縮型標志蛋白α-SMA和Calponin表達降低,說明AngⅡ促進VSMCs由收縮表型轉變為合成表型。而Rut可部分恢復兩種標志蛋白的表達,其效應被CAPZ所阻斷。Rut這種抑制VSMCs表型轉換的作用也可能與Cx43有關,已有研究表明Cx43參與調節VSMCs的表型轉換[13]。在豬冠狀動脈平滑肌中也發現,過表達Cx43可下調收縮型標志蛋白α-SMA和 Calponin的表達,敲除Cx43則產生相反的作用[14]。
綜上所述,本研究結果表明,Rut通過下調Cx43的表達,抑制AngⅡ誘導的VSMCs增殖和表型轉化,其機制涉及TRPV1/NF-κB信號途徑。

