微波干燥對生物解離富肽豆粉蛋白亞基及功能性的影響
王 歡 佟曉紅 鐘明明 齊寶坤 李 楊,2 江連洲
(1.東北農業大學食品學院,哈爾濱 150030; 2.哈爾濱市食品產業研究院,哈爾濱 150028)
0 引言
生物解離是一種新型的綠色提油工藝,在機械破碎的基礎上,通過對植物油料進行酶解處理可實現油脂與蛋白的同步提取,具有廣闊的應用前景[1]。生物解離同步制取大豆油脂及蛋白技術以其安全、健康、環保等優點,已充分體現其工業可行性。破乳技術使油和蛋白的提取率分別高達98%和96.5%,然而其水資源及副產物綜合利用率低的問題亟待解決[2]。生物酶法同步制取油脂及蛋白工藝產生的副產物水解液中主要成分為水解蛋白。研究表明,每生產1 L油脂可產生4.4 kg豆渣和約28 L水解液[3]。生物解離大豆廢料與傳統大豆加工副產物廢料相比,經過酶解后會有更多的高價值成分釋放,典型的水解液含60%蛋白質(水解蛋白)、22%碳水化合物以及原料中幾乎50%的磷脂。現有的用于發酵酒精、生產水溶性多糖等再利用方案不能很好地利用異黃酮等生理活性物質,造成一定程度的浪費[4]。因此,如何對水解液進行高值化利用是提高此項技術經濟效益、環境效益和社會效益的重要因素。
微波干燥技術現已廣泛應用于多種食品的生產。REDDY等[5]研究微波干燥條件(固形物含量、進口溫度)對山羊奶粉性質的影響,研究發現,L*值、水分活度、堆積密度隨著進口溫度的升高而降低,固形物含量的升高引起堆積密度的增大,溶解性、可濕性和分散性均受到微波干燥條件的影響,平均值分別為98.49%、533.4 s和81.48%。TELANG[6]研究微波干燥條件對發酵豆粉性質的影響,研究發現,較高進口溫度、較低進料速度時,粉末顆粒的殘留水分較低;產品得率在較低進料速度條件下較高;升高進口溫度引起產品異黃酮種類的減少及含量的降低;較低進料速度使物料更多暴露于干燥塔,蛋白質更易變性,且形成較多小顆粒粉末,從而引起豆粉溶解性下降。SHEN[7]利用微波干燥生產乳蛋白-纖維復合物的研究發現,隨著進口溫度升高,所得產品顆粒水分活度降低,微波干燥所得粉末顆粒就微生物腐敗來說相對穩定。目前,關于微波干燥技術的利用多集中于工藝參數的優化,而微波干燥條件對產品性質的影響機理尚不明確,因此有必要針對生產過程產品特性的變化進行深入研究。
本文以模擬大豆油提煉工藝條件下的生物解離大豆水解液為研究對象,運用高效液相體積排阻色譜技術研究不同微波干燥條件對富肽豆粉中蛋白類物質亞基組分和空間構象的變化規律,并對生物解離富肽豆粉的粉體性質及功能性質進行研究,旨在探討結構變化與理化、功能特性的內在聯系,為生物解離技術工業化示范提供理論指導。
1 材料與設備
1.1 材料與試劑
大豆,哈爾濱市依蘭大豆專業合作社;堿性蛋白酶Protease 2.4L,諾維信生物技術有限公司;氫氧化鈉,上海市天力化學試劑有限公司;鹽酸,上海市天力化學試劑有限公司;正己烷,天津渤海化工集團供銷公司;乙腈,天津渤海化工集團供銷公司;其他常用化學試劑均為分析純。
1.2 儀器與設備
手提式多功能粉碎機,天津市華鑫儀器廠;剖分式雙螺桿擠壓機,東北農業大學工程學院自行研制;HS-25型數字酸度計,上海偉業儀器廠;DK-98-1型電熱恒溫水浴鍋,天津常儀儀器設備有限公司;JJ-1型增力電動攪拌器,上海科升儀器有限公司;GL-21M型高速冷凍離心機,北京醫用離心機廠;BL-6000Y型微波干燥機,上海比朗儀器制造有限公司;FD5-3型冷凍干燥機,美國SIM公司;AL204型分析天平,北京京國藝科技發展有限公司; Waters型高效液相色譜儀,美國Waters公司。
2 實驗方法
2.1 生物解離水解液的制備
大豆生物解離水解液制備流程[8]如下:大豆清理→粉碎→擠壓膨化(模孔孔徑18 mm、套筒溫度90℃、水分調節14%、螺桿轉速100 r/min)→粉碎(過60目篩)→酶解(50℃,pH值9,3 h)→滅酶(沸水浴10 min)→離心(4 500 r/min, 20 min)→大豆生物解離水解液。
2.2 生物解離富肽豆粉的制備
采用微波干燥技術制備大豆生物解離富肽豆粉,在進行微波干燥前,對大豆生物解離水解液進行濃縮處理,隨后用2 mol/L NaOH溶液調至pH值7.4,并用膜截留分子量為500 u的透析膜進行脫鹽。依據前人實驗,選取微波干燥條件為:進口溫度140、150、160、170、180、190、200℃;固形物質量分數15%、20%、25%、30%、35%、40%、45%;進料速率3、6、9、12、15、18、21 mL/min。將旋風分離器和干燥塔中所得富肽豆粉用聚氯乙烯袋收集并密封,于干燥器中室溫(20℃)保存備用[9]。
2.3 高效液相體積排阻色譜(HPLC-SEC)分析
聯用AKTA快速蛋白液相(FPLC)系統與10/300 GL Superdex TM 75型凝膠色譜柱測定樣品肽分子量分布。將不同微波干燥條件所得大豆生物解離高值粉溶解于磷酸緩沖液(0.05 mol/L,pH值6.8)中,得到質量濃度1 mg/mL樣品,用孔徑為0.45 μm的親水性纖維素膜過濾,注入量500 μL,流動相速率0.6 mL/min,在215 nm處進行紫外檢測。根據標準品(磷酸化酶97.4 ku;牛血清蛋白66.2 ku;肌動蛋白43 ku;碳酸酐酶31 ku;生長激素22.0 ku;溶菌酶14.4 ku;胰島素5.5 ku)分子量對數值與洗脫體積的關系建立回歸方程[10]。
2.4 熒光光譜分析
對不同微波干燥條件生物解離富肽豆粉進行熒光測定。將0.2 mg/mL的樣品溶液置于石英比色皿中,激發波長285 nm,發散波長掃描范圍300~500 nm,激發狹縫和發射狹縫均為5 nm[11]。
2.5 水溶性指數的測定
稱取(1±0.01) g生物解離豆粉于燒杯,加入15 mL蒸餾水進行混勻,在室溫條件下磁力攪拌1 h后以5 000 r/min離心20 min。將上清液倒入蒸發皿,于105℃下干燥至質量恒定,所得干物質占所稱取豆粉的質量分數即為水溶性指數[12]。
2.6 分散性指數的測定
準確稱取10.00 g生物解離富肽豆粉放入100 mL 25℃的去離子水中,記錄粉體完全分散所用時間,分散性指數測定方法參照文獻[13]。
2.7 統計分析
本實驗數據均為3個平行樣的平均值,結果采用SPSS 22.0分析軟件和Origin 8.0進行處理,并對數據進行差異顯著性分析(P<0.05)。
3 結果與分析
3.1 HPLC-SEC分析
已知分子量的標準蛋白質經Sephadex G-75凝膠層析分離后,各蛋白質分子量、分子量對數值和洗脫體積所得結果見表1。根據標準分子量對數值與洗脫體積關系建立線性方程(圖1)。采用最小二乘法求出直線的回歸方程為
y=-0.048 8x+5.304 4
式中x——洗脫體積,mL
y——分子量對數值
采用該回歸方程可以根據某蛋白的洗脫體積估算出其分子量。
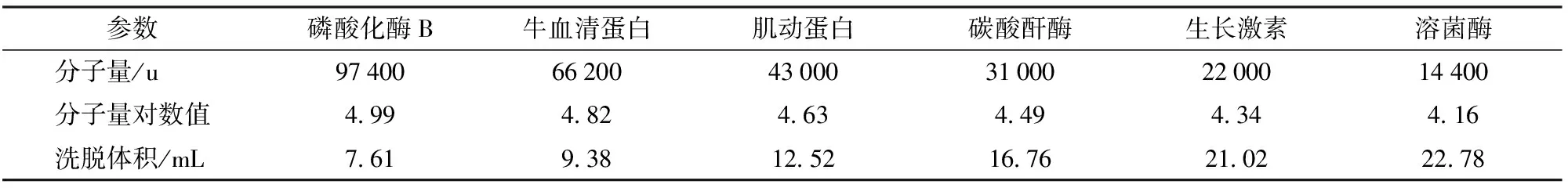
表1 蛋白質標準品的分子量與洗脫體積關系Tab.1 Relationship of protein standard sample and retention volume
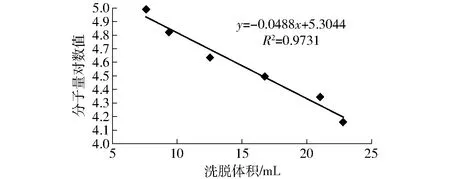
圖1 分子量對數值與洗脫體積關系Fig.1 Logarithm relationship of molecular weight as a function of retention volume
采用體積排阻-凝膠色譜(HPLC-SEC)方法研究在不同微波干燥條件下生物解離富肽豆粉中蛋白(肽)類分子量大小及其分布情況。不同微波干燥進口溫度條件下生物解離富肽豆粉蛋白(肽)類分子量分布見表2。
由表2可知,洗脫譜圖的排阻時間位置存在1個主峰,微波干燥條件的不同對出峰時間無明顯影響,但對峰的強度影響明顯,即在數量上影響蛋白質水解產物。根據圖1分子量對數值與洗脫體積關系的線性方程換算出各峰的分子量分布發現,先出峰的為分子量大于44 ku的蛋白質,后出現的一系列峰為分子量小于18 ku的肽,數量最多的蛋白質水解物分子量為18~44 ku,占總蛋白質類的73.47%~89.36%,其主要亞基成分為大豆球蛋白,這與VIRGINIE等[14]研究所得大豆球蛋白是大豆水解產物較高的組成成分相似。這可能是由于不同微波干燥條件下的物相轉換率和分子間碰撞機會不同,蛋白纖維化聚集形成的速度不同,從而對生物解離富肽豆粉分子量產生影響。
3.2 熒光光譜分析
內源熒光光譜主要用于表征色氨酸殘基附近微環境極性的變化,用于反映蛋白質三級結構的變化。色氨酸的最大熒光強度和熒光峰位受微環境變化的影響,熒光強度的變化與熒光猝滅有關;熒光峰位藍移表示色氨酸附近微環境極性降低,紅移則表示色氨酸附近微環境極性增加[15]。不同微波干燥條件生物解離富肽豆粉的熒光光譜如圖2所示。
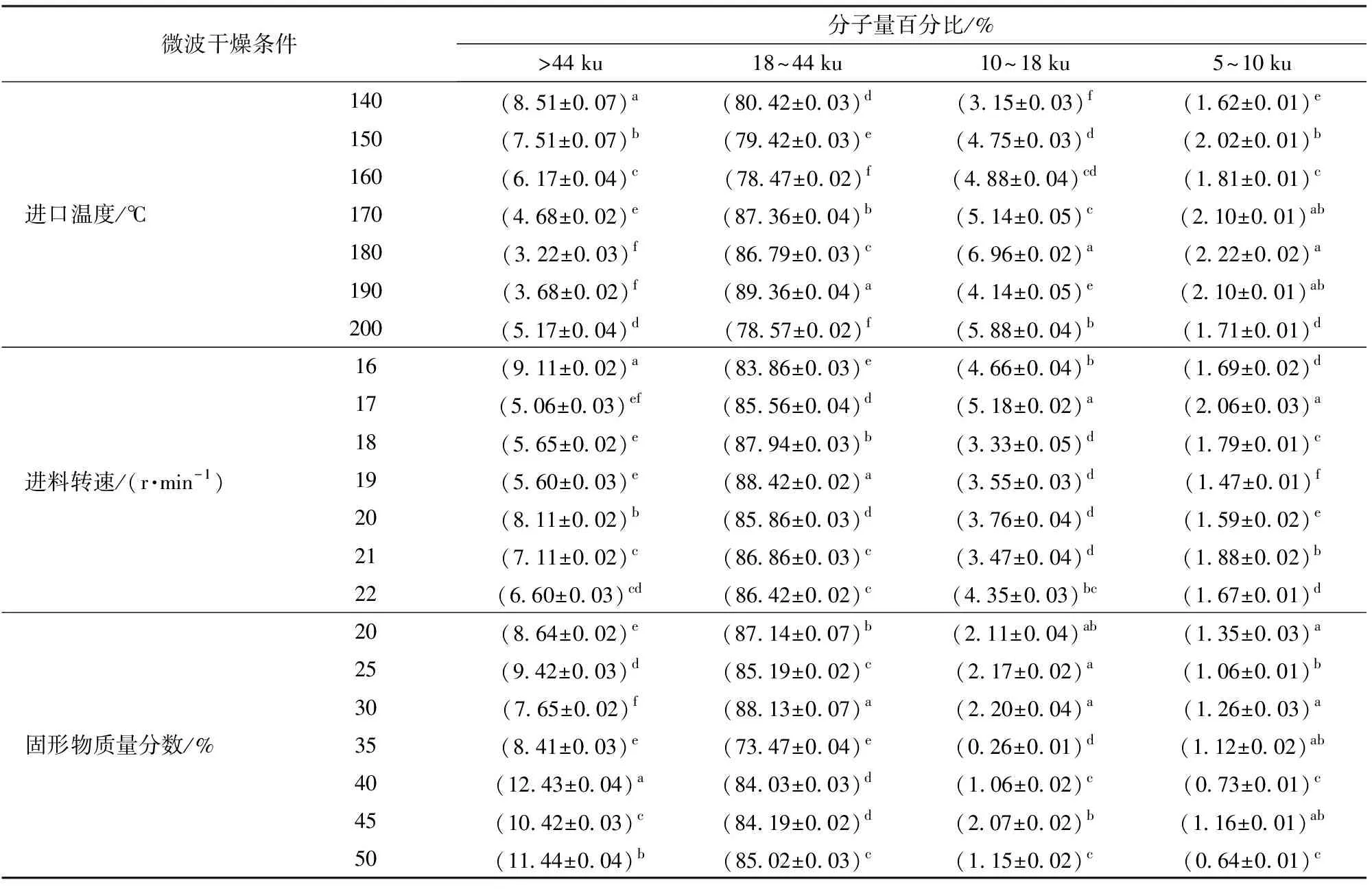
表2 不同微波干燥條件下生物解離富肽豆粉的蛋白質分子量分布Tab.2 Molecular weight distribution (MWD) of spray dried EAEP soy skim powders
注:同一參數同一列的不同字母表示差異顯著(P<0.05)。
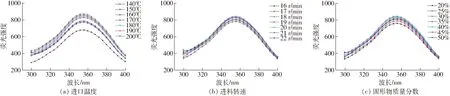
圖2 不同微波干燥條件下生物解離富肽豆粉熒光光譜Fig.2 Fluorescence spectra of soy skim powder under different spray drying conditions
由圖2可知,當激發波長為285 nm時,生物解離富肽豆粉在不同微波干燥進口溫度、不同轉速以及不同固形物含量條件下的最大吸收波長均為355 nm。這表明微波干燥條件對色氨酸周圍空間結構無明顯影響。由圖2a可知,當微波干燥進口溫度由140℃升到160℃時,生物解離富肽豆粉的熒光強度呈減小趨勢,隨著溫度繼續升高,熒光強度則呈增大趨勢,在200℃時熒光最強。由圖2b可知,當進料速度為19 r/min時,樣品熒光最強。這表明在19 r/min時,色氨酸的屏蔽作用最弱。
圖2c顯示,當固形物質量分數由20%增加到35%時,生物解離富肽豆粉的最大熒光強度逐漸增大,當料液固形物質量分數繼續增加至50%,最大熒光強度減小。這可能是因為一定范圍內的固形物含量增加伴隨著物料中蛋白含量的增加,從而引起色氨酸含量增加,因此引起熒光強度增強;隨著固形物含量的繼續增加,糖類與蛋白分子交聯加劇,加強了其對色氨酸殘基周圍區域的屏蔽作用,熒光強度減弱[16]。
3.3 水溶性分析
水溶性是表征粉體復溶特性的重要指標。水溶性高分子之所以溶于水是因為在水分子與聚合物的極性側基之間形成了氫鍵。不同微波干燥條件生物解離富肽豆粉的水溶性指數如圖3所示。由圖3可知,較高的進口溫度和較大的物料固形物質量分數都能使粉體顆粒具有較好的水溶性。依據GOULA等[17]的研究成果,粉體顆粒的殘留水分越低則水溶性越好,因此,當微波干燥的進口溫度升高,所得粉體顆粒的殘余水分少,則水溶性較好;增大物料固形物含量,可引起物料中蛋白質類含量的增加,據DE ALMEIDA等[18]報道,蛋白質的高溶解性可使所得粉體顆粒水溶性增強。MUZAFFAR[19]利用微波干燥生產酸角粉也得到相似趨勢。當進料速度增加,粉體顆粒水溶性減小,因為較大的進料速率導致粉體顆粒的殘余水分增多,從而一定程度上減小粉體顆粒的水溶性。
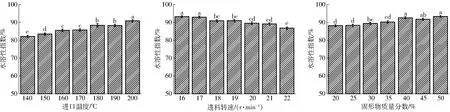
圖3 不同微波干燥條件下生物解離富肽豆粉水溶性指數Fig.3 WSI of soy skim powder under different spray drying conditions
3.4 分散性分析
分散性是速溶豆粉的功能特性之一。不同微波干燥條件所得生物解離富肽豆粉的分散性指數如圖4所示。由圖4可知,生物解離富肽豆粉的分散性隨著溫度的升高而呈上升的趨勢,且上升幅度較大,而隨著進料速度的提高,生物解離富肽豆粉的分散性明顯下降。隨著固形物質量分數的增加,生物解離富肽豆粉的分散性呈增加趨勢,但當固形物質量分數達到40%以后其分散性則隨著固形物含量的增加而減少。較高微波干燥溫度促使蛋白質分子結構伸展,也能引發不溶性蛋白質裂解為可溶性蛋白質,有助于提高生物解離富肽豆粉的分散性[20-21]。分散性先會隨著固形物含量的增加而增加,這是因為大豆蛋白主要成分球蛋白的親水性側鏈基團(鹽鍵、酯鍵等)絕大多數處于其分子表面,易分散于水中[22],但隨著蛋白濃度的繼續增加,蛋白質分子之間的相互作用和分子聚集的作用也隨之加劇,蛋白質分子隨機聚成簇,并進一步聚集成厚的索狀結構從而形成粗糙型凝膠,則會導致分散性下降[23]。

圖4 不同微波干燥條件下生物解離富肽豆粉分散性指數Fig.4 Dispersibility of soy skim powder under different spray drying conditions
4 結束語
以生物解離大豆水解液為研究對象,運用高效液相凝膠排阻色譜技術研究了不同噴霧-微波干燥條件對富肽豆粉中蛋白類物質亞基組分和空間構象變化規律,并對生物解離富肽豆粉的粉體性質及功能性質進行研究。研究結果表明,微波干燥條件對HPLC-SEC分離主峰的強度影響明顯,分子量18~44 ku的蛋白質水解物約占總蛋白質類的73.47%~89.36%,主要亞基成分為大豆球蛋白。此外,生物解離富肽豆粉的水溶性和分散性在不同微波干燥條件下具有相似趨勢,與粉體殘余水分量、分子運動劇烈程度、分子構象變化及分子聚集與裂解有關。

