體外細胞轉化試驗的研究與應用進展
王 丹 耿興超 李 波 王 雪 * 文海若*
( 1.中國藥科大學中藥學院,江蘇 南 京 211198;2.中國食品藥品檢定研究院國家藥物安全評價監測中心,藥物非臨床安全性評價研究北京市重點試驗室,北京 100176 )
癌癥是全球范圍內嚴重危害人類健康的疾病。根據美國癌癥協會(American Cancer Society,ACS)[1]發布的最新數據,2018年美國將出現新發癌癥病例超過173萬例,癌癥死亡病例接近70萬例。隨著人口增長、老齡化加劇、以及不健康的生活方式等因素(如吸煙、運動量過少和不健康飲食等),發展中國家癌癥的疾病負擔日益增加。在眾多癌癥誘因中,長期接觸有害因素與癌癥的發生直接相關,其中約90%以上為化學因素。監管部門和企業加強對致癌物的篩查并逐步禁止其生產和銷售,或制定出最低接觸安全劑量將有效降低整體癌癥的發生率。
用于評價新藥潛在致癌性風險的致癌試驗是安全評價的重要內容。人用藥物注冊技術要求國際協調會(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use,ICH)[2]、美國食品藥物管理局(Food and Drug Administration,FDA)[3]等國際機構已頒布了有關新藥臨床前致癌性評價的技術指導原則或指南,對藥物致癌性試驗的必要性、試驗方法、劑量選擇和限度進行了全面闡述。為期兩年的嚙齒類動物試驗在近半個世紀以來一直作為臨床前藥物致癌性評價的金標準,其試驗結果幾乎可以辨別所有已知的人類致癌物。然而該方法也存在一定弊端。據統計,檢測每種化學物質需要兩個物種的動物共計600~800只,加上超過40種組織的病理學檢查,需要花費大概100萬歐元[4]。長期動物試驗并不適用于例如歐盟法規《化學品的注冊、評估、授權和限制》(Registration,Evaluation,Authorization and Restriction of Chemicals,REACH)[5]要求下的大量化學物質檢測。此外,歐盟自2013年開始禁止使用動物開展化妝品安全評價研究,并禁止出售任何經過動物試驗的化妝品產品。可見,監管單位迫切需要確立符合動物試驗3R原則的高通量替代試驗方法。細胞轉化試驗(cell transformation assays,CTAs)是從細胞生物學和分子生物學水平上研究腫瘤發生與發展的基本技術,能夠較為快速檢測化學物的致癌作用,在研究腫瘤的發生、發展及防治方面具有重要意義。本文將就體外CTAs的背景、優化、影響因素以及國內外發展趨勢4個方面進行綜述,為轉化試驗的應用提供借鑒。
1 細胞轉化試驗的背景
Berwald和Sachs[6]于1963年首次發現原代的正常敘利亞地鼠胚胎(Syria hamster embryo cell,SHE)細胞經體外培養后會出現形態學改變,繼續培養一段時間并移植回地鼠體內后可致瘤。進一步研究顯示,SHE細胞的形態學改變與嚙齒類動物致癌性之間有良好的相關性,從而逐漸形成了使用CTAs對化合物致癌性進行研究的想法。SHE轉化試驗一方面借助SHE細胞形態學改變的能力檢測致癌物,另一方面作為體外試驗系統也可以研究致癌機制,包括腫瘤發生的多階段性,致癌物改變DNA 的原理以及在腫瘤形成過程中特定基因的突變等。然而不同試驗室間操作變異性較大,且經典的遺傳毒理試驗也可以檢出大部分的致癌物,SHE轉化試驗的發展受到了限制。直至1996年,Kerckaert等[7]先后報道了培養基的pH值是決定SHE細胞生長和轉化能力的關鍵因素之一,并對該方法進行了改良,形成我們今天所熟知的降低了pH值的SHE轉化試驗,從而提高了細胞形態轉化與嚙齒類致癌性結果的一致性。
隨著試驗方法的不斷優化,使用SHE轉化試驗進行致癌性機制探討和驗證的研究持續至今。以SHE細胞轉化試驗為基礎,Aaronson和Todaro[8]率先建立了體外的小鼠細胞轉化試驗。與地鼠胚胎細胞不同,小鼠胚胎細胞(其中BALB/c 3T3和C3H 10T1/2最為常見)更易于自發轉變為永生化細胞,可以將轉化灶的形成作為致癌物誘導細胞轉化的檢測終點。如Sasaki等[9]利用v-Ha-ras轉染BALB/c 3T3后得到的Bhas 42細胞系開展CTAs。此外,人源CTAs被認為是檢測人類致癌物的最佳選擇,因受細胞來源限制,使用人類永生化細胞系開展轉化試驗成為當前主要的發展趨勢。
嚙齒類動物細胞或人類細胞的轉化均至少包含4個階段[10]:①細胞分化阻滯;②通過獲得無限壽命、非整倍體的核型以及遺傳的不穩定性進行永生性表達;③獲得致瘤性;④包括轉移在內的完全惡性腫瘤。SHE細胞轉化試驗采用的是細胞轉化的第一階段作為誘導腫瘤形成前的終點,也就是細胞分化阻滯;而永生化BALB/c 3T3以及人類細胞則依據非致癌永生性到致癌性轉變形成灶以及典型的非貼壁依賴型生長作為檢測終點。
2 細胞轉化試驗的優化
2.1 SHE細胞轉化試驗
SHE細胞轉化試驗是經典的CTAs方法,自誕生以來經歷了一系列的優化和改良。SHE細胞轉化試驗中細胞接種密度較小,通常使用X射線照射刺激細胞的滋養層供養靶細胞的生長。然而細胞滋養層的背景為分辨轉化群落和正常群落造成一定困難。通過將靶細胞接種在培養過原種細胞的條件培養基里而不是滋養層細胞上[11],這一改進,可避免X射線的使用,細胞群落的分辨也變得更為容易。此外,Schechtman等[12]在BALB/c 3T3和C3H 10T1/2細胞系中增加大鼠肝S9活化體系,擴大了可轉化細胞系的敏感度。
如何客觀準確地判斷轉化灶,是細胞轉化試驗標準化需要攻克的一大難題。研究人員正在探索是否能使用紅外光譜分析細胞組分(蛋白質、脂質、糖原、DNA、RNA),從而對轉化細胞群落進行更為客觀的判定并提供機制方面的信息。例如,使SHE細胞在紅外反射的載玻片上生長并轉化,轉化結果通過傅里葉變換衰減全反射紅外光譜和常規計數兩種方法觀察[13],發現前者的計數結果大于常規計數,紅外可監測到視覺無法辨認的轉化灶。
從地鼠體內分離得到的SHE細胞是多種胚胎細胞的混合物,其中只有一部分子群能發生形態學上的轉變。研究顯示這種易感性的群體包括間葉和上皮兩種細胞中未分化的和定向干細胞樣的部分,可通過阻礙這些細胞的分化而發生轉化。而癌細胞的來源可能也對應于正常的組織干細胞和定向組細胞[14]。這也成為SHE試驗與體內試驗有關聯性的重要證據。如果能應用現代的分析手段描繪SHE細胞轉化中易感子群并確定干細胞與定向組細胞的潛在角色,將有助于促進SHE試驗的發展。
2.2 BALB/c 3T3細胞轉化試驗
BALB/c 3T3細胞轉化試驗以轉化灶計數為評價指標,數據分析是試驗的重要組成部分。轉化試驗中,通常采用每個平皿中三型轉化灶的數目作為試驗評判標準,然而BALB/c 3T3轉化試驗可用的草案里沒有強調必須用哪種方法進行數據分析,所以有的人就每個平皿中轉化灶的數目進行分析,如線性方差分析[15],非參數曼-惠特尼U檢驗或者泊松分布的參數檢驗等;另一部分人則對每個平皿中轉化灶比例進行分析,如確切概率法[16]。歐洲替代方法驗證中心(European Centre for the Validation of Alternative Methods,ECVAM)回顧了這些應用于BALB/c 3T3細胞試驗的數據分析方法后,推薦了威廉姆型衰退保護趨勢測試的負二項廣義線性模型和通過特殊的轉換對數據進行歸一化兩種方法。Hoffmann等[17]對上述兩種方法進行了驗證,認為它們適于分析BALB/c 3T3試驗數據。Kajiwara等[18]則建議使用ITES培養基培養細胞,即在T培養基或者DMEM/F12培養基中加入胰島素、轉鐵蛋白、乙醇胺以及硒和2%的胎牛血清以增強轉化頻率,這種改進同時也讓轉化灶的形成更為清晰并縮短了試驗周期。該方法在日本多個試驗室都得以復現,但由于測試的化合物較少,很難得出ITES培養基促進BALB/c 3T3細胞轉化的結論。隨后Kajiwara等人又用更多的化合物進行驗證,證明該方法是可靠的短期檢測潛在致癌物的方法。
2.3 Bhas 42細胞轉化試驗
在Bhas 42細胞轉化試驗中,與人類腫瘤相關的生物標志物也被認為是評價細胞轉化較為客觀的方法。乙酰膽堿酯酶(acetyl cholinesterase, AChE)和 丁 酰 膽 堿 酯 酶(butyrylcholinesterase,BChE)在腫瘤細胞的增殖與分化過程中扮演著重要角色,其基因會發生結構上的改變或是其產物可在多種組織的腫瘤中異常表達。在體外研究中已證實AchE可以促進非貼壁依賴型腫瘤細胞的生長[19]。肺、睪丸、輸卵管、胃腸道腫瘤中也發現了堿性磷酸酶(alkaline phosphatase,ALP)的異常表達。在Bhas 42細胞轉化試驗中,未轉化的Bhas 42細胞為單層,并且很少或幾乎不表達AchE、BChE和ALP,而三型轉化灶(轉化灶的特征為強嗜堿性,形態異于單層生長的細胞,生長密集,在轉化灶的邊緣細胞隨機定位)與二型轉化灶(生長密集,復層生長,嗜堿性弱于三型轉化灶)相比,AchE、BChE和ALP活性和表達量都更高[20]。這些生化指標也可以用于BALB/c 3T3細胞轉化試驗,但并不適宜SHE細胞轉化試驗,因為大多數腫瘤標志物在胚胎細胞中活性也很好(SHE細胞轉化試驗與Bhas 42細胞轉化試驗的比較見表1)。
Bhas 42細胞轉化試驗也進行了高通量改良。從平皿到6孔板,以及目前使用的96孔板,將該方法的高通量篩選致癌物的能力逐步提升。Sasaki等[21]采用96孔板培養細胞,簡化了轉化灶的計數,無論孔中有1個或是幾個轉化灶都記作1個,最終記錄每塊孔板上有轉化灶的孔數,實現了對轉化灶的高通量篩選。王穎等[22]采用H22O來區分未轉化細胞和轉化細胞,因低濃度的H2O2可以殺傷大部分正常細胞,而對轉化細胞影響較小,在對活細胞進行CCK-8染色后,可以采用酶標儀等記錄數據,并進行統計分析,增加了結果的客觀性。Bhas 42細胞轉化試驗中啟動試驗與促癌試驗分別進行,記種板日為第0天。啟動試驗在第1天給藥,然后在第4、7、10、14天更換新鮮培養基;促癌試驗在第4、7、10天給藥,第14天更換新鮮培養基(以陽性劑為例,試驗流程圖詳見圖1和圖2)。

表1 細胞轉化試驗的比較
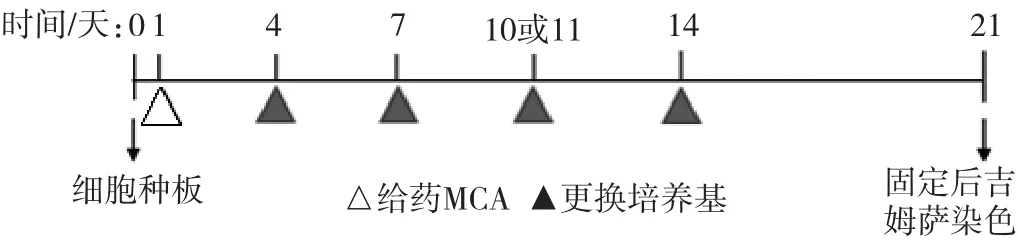
圖1 細胞轉化試驗流程-啟動試驗
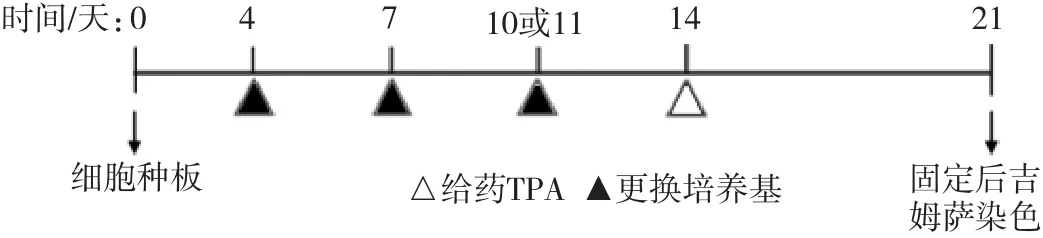
圖2 細胞轉化試驗流程-促癌試驗
2.4 兩階段細胞轉化試驗
Lasne等在1974年首次采用小鼠成纖維細胞系模擬兩階段的細胞形態惡性轉化,其后Sasaki等[23]在BALB/c 3T3細胞轉化試驗的基礎上提出了兩階段轉化試驗模型。這種改進根據腫瘤發生的多階段理論,從試驗設計上將啟動劑和促癌劑的檢測區分為兩階段,同時檢測遺傳毒性致癌物與非遺傳毒性致癌物的活性。Sasaki等[24]經過長期試驗對這種方法進行了改進,最終推薦使用以BALB/c 3T3(clone A31-1-1)為基礎的兩階段細胞轉化試驗方法的標準化方法。Bhas 42細胞中導入了癌基因,因此可視為已處于啟動階段,在檢測促癌物時可以不必經過啟動劑預處理便可檢測促癌活性,縮短了試驗周期。由于細胞分裂在腫瘤啟動階段起著很重要的作用,而在腫瘤促長階段細胞間通訊則占有重要地位。因此可以通過接種不同濃度的細胞,調整待測物質與細胞共同培養的時間,采用不同的培養間隔可區分啟動劑和促癌劑。兩階段細胞轉化即是在細胞對數生長期給予啟動劑進行短暫處理,引起細胞基因突變而誘發轉化。而在細胞融合后的生長靜止期用促癌劑處理較長的時間,阻斷細胞間通訊從而誘發轉化,這樣可以提高細胞惡性轉化的頻率。然而,腫瘤啟動階段被認為是涉及一個或多個突變的不可逆的過程,采用Bhas 42細胞篩查啟動劑時,啟動劑仍能誘導轉化可能是引起其他轉化相關基因的突變從而引起細胞轉化。ECVAM[25]于2013年指出,Bhas 42細胞高通量轉化試驗是一種體外致癌性的檢測方法,但該試驗方法并不用于明確區分致癌物屬于遺傳毒性致癌物或非遺傳毒性致癌物。
2.5 人源細胞轉化試驗
除了基于嚙齒類動物細胞的轉化模型,利用人源細胞通過在生理條件下促進其轉化來鑒別致癌物方面也不失為一個理想模型。然而轉化人源細胞比嚙齒類需要更多的基因。例如,SV40大T抗原和癌等位基因H-RAS的引入足以讓嚙齒類細胞發生轉化但卻一直無法誘導人類細胞發生轉化,這也是基于人源細胞的CTAs還沒有作為常規方法而建立起來的主要原因之一[4]。另外,復制性衰老是人類細胞永生化和發生惡性轉化的主要障礙,這個障礙也限制了人源CTAs的發展。嚙齒類動物試驗為繞過促進惡性轉化的癌基因/應激誘導衰老提供了有用的方式,但是依舊不能克服復制性衰老。而對克服復制性衰老所需基因的認識正在增加,這將有助于模擬人類端粒酶活性和復制性衰老旁路試驗的發展。
3 細胞轉化的影響因素
適于開展轉化試驗的細胞需具備以下3個特點:在體外生長過程中具有穩定的生物學特性,對致癌因子的作用反應敏感,以及較低的細胞自發轉化率。常用的細胞系包括:以SHE試驗為主的原代正常雙倍體細胞和永生化的非整倍體小鼠細胞系(傳代細胞系,BALB/c 3T3和C3H 10T1/2和Bhas 42細胞系轉化試驗最為常見)。原代細胞系容易制備和培養,自發轉化率低,轉化后容易識別并能以定量的方式獲得數字結果。與原代細胞相比,傳代細胞則具有細胞群落穩定性高,試驗重復性好,劑量反應關系明顯等特點。
細胞轉化可能受到其他因素的制約:①細胞性質。細胞分化程度與轉化潛伏期長短呈負相關,如妊娠12天的鼠胚細胞和20個月齡的金黃地鼠皮膚成纖維細胞誘發轉化的潛伏期分別為20.3和10.8個細胞群體倍增時間[26]。②培養條件。血清濃度降低,細胞轉化率降低;有滋養層細胞存在時,細胞轉化率提高;培養基的組成,ITES培養基能促進BALB/c 3T3細胞的轉化;培養溫度降低、加入兩性霉素和長期缺氧會使已轉化的細胞失去轉化細胞的生物學性質。③給藥方式與活化酶的使用。因細胞轉化試驗給藥周期較長,而S9等體外活化酶系統本身存在一定細胞毒性不適于與該方法結合長期重復給藥,可能無法檢出需代謝活化后產生致癌性物質。然而,研究顯示Bhas 42細胞本身含有CYP1A1等P450細胞色素酶,可代謝多環芳烴、乙酰氨基芴和環磷酰胺等物質[27]。
4 細胞轉化試驗的發展趨勢
CTAs當前已被廣泛應用于化學物、農藥、化妝品、環境污染物等[28-29]的檢測。當其試驗結果與遺傳毒性數據、構效分析、藥代動/毒代動信息相結合時,可對化合物潛在致癌性進行相對綜合的評估。目前CTAs的應用前景包括:①解釋體外遺傳毒性結果;②評估在低預測性傳統遺傳毒性試驗中化學物的分類,篩選遺傳毒性或非遺傳毒性致癌物;④考察腫瘤的啟動和促進行為;⑤研究特定致癌物的致癌機制等。
CTAs對于尚未實施致癌試驗的化合物(如REACH法規下大范圍的檢測項目)或常規遺傳毒性試驗方法不適用的化合物(如無法經細菌代謝的醫用納米材料或抑菌性強的化合物,不適合開展Ames試驗),尤其是化妝品和醫療器械的早期致癌性預測方面有重大意義。其最重大的價值是對非遺傳毒性致癌物進行鑒別,并提供低劑量條件下化合物的遺傳毒性作用機制,以驗證閾值下遺傳毒性化合物的特征。
近年來有研究發現地鼠細胞可克服癌基因應激/誘導衰老屏障的研究對CTAs試驗的預測能力是有力的支持[4]。BALB/c 3T3和Bhas 42試驗中轉換后生化指標的鑒別也比傳統方法更具客觀性。然而很多科學家仍舊對CTAs持保留意見,該方法目前尚未被國際安全監管體系完全接受。有待改進的關鍵內容是如何通過CTAs對致癌機制進行探討以及如何增加計數的客觀性等。Sasaki等通過對Bhas 42 CTAs的試驗操作方法和評價方法進行規范化,已形成指導原則草案并遞交OECD[30],有望在今后應用于致癌性安全性評價。就目前應用較多的Bhas 42細胞來說,限制該試驗發展的主要問題是細胞活性,活性的強弱直接影響了細胞的轉化力和最終轉化灶形成的多寡。當前迫切需要改善其細胞活性的方法,在試驗過程中務必對其活性進行密切觀察。
5 結語
CTAs是應用較為廣泛的潛在致癌物檢測方法。盡管該方法與嚙齒類生物試驗存在良好的相關性,但并不能完全模擬體內的整個致癌過程,而且考慮到用形態學標準來鑒定轉化細胞較為主觀以及對機制理解的缺乏,較難作為標準被接受。然而CTAs可以同時檢測遺傳毒性與非遺傳毒性致癌物,并確定化合物毒性的閾值。以Bhas 42細胞轉化試驗為例,它可用于化合物致癌性進行早期的初步篩選,是對體內多終點遺傳毒性評價結果的良好補充。隨著分子生物學、生物化學、遺傳學等相關學科的發展,研究人員對機制的研究和了解不斷深入。通過不斷地對方法學優化和改良,將會形成更為客觀準確的細胞轉化灶判斷標準,CTAs將在臨床前致癌性早期評價的舞臺上發揮更重要的價值。

