中美創新醫療器械審批進展、差距及建議
劉清峰 莫國民
摘 要 中美兩國先后推出創新醫療器械行動計劃,中國審批進展明顯落后于美國。分析創新計劃的驅動機構、創新政策的基本理念、創新實施的理論基礎等基礎性因素和創新計劃具體實施措施,表明兩國政府在政策框架上盡管相似,但中國政府在創新驅動行政層級、監管科學理論基礎、外部資源整合和內部資源挖掘方面都落后于美國,中國政府應提高創新醫療器械行動的行政層級,加大監管科學研究的力度,對外部資源整合和內部資源挖掘盡早做出規劃。
關鍵詞 創新醫療器械 審批進展 建議
中圖分類號:R951 文獻標志碼:C 文章編號:1006-1533(2018)13-0058-04
Progress of the approval of innovative medical devices between China and the United States and its gaps and suggestions*
LIU Qingfeng**, MO Guomin
(Shanghai University of Medicine & Health Sciences, Shanghai 201318, China)
ABSTRACT Innovative medical device action plans have been launched by China and the United States. The approval progress in China has lagged behind that of the United States. By analyzing innovation drive mechanism, the basic conception of innovation policy, innovation implementation of fundamental factors such as the theoretical basis and specific implementation measures, it shows that although policy framework is similar at the two governments, the administrative hierarchy in the innovation drive, a scientific theory foundation, the external resources and integration of internal resources mining in China is behind the United States. We suggested that Chinese government should improve the administrative levels of innovative medical device operation, and promote the supervision of scientific research strength, and the external resource integration and internal resources mining should be planned as early as possible.
KEY WORDS innovative medical device; progress of approval; proposal
為讓患者更快地獲得安全、有效的醫療器械產品,同時又能保證上市產品的安全性、有效性,保護和促進公眾健康,促進醫療器械產業結構調整和技術創新,美國食品藥品管理局(FDA)于2011年發布了《醫療器械創新計劃白皮書》[1]。中國在2014年3月發布了《創新醫療器械特別審批程序(試行)》,2015年8月發布了《國務院關于改革藥品醫療器械審評審批制度的意見》,又于2017年10月發布了《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》,來助推我國創新醫療器械的發展。已有學者分別從我國醫療器械創新環境、知識產權角度對我國醫療器械創新進行了分析[2-3],提出了在大數據背景下的監管策略和建議[4]。筆者通過對中美兩國創新醫療器械審批進度的回顧,分析兩國政策的差別,對我國創新醫療器械的發展提出建議。
1 中美兩國對創新醫療器械審批的實踐
1.1 中美創新醫療器械審批進展
通過查閱美國FDA官網和中國原食品藥品監督管理總局(CFDA)官網公開信息,對兩國創新醫療器械審批數量進行統計,結果見表1。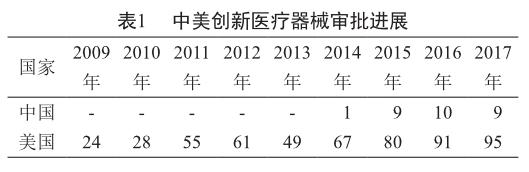
1.2 中美創新醫療器械審批政策
1.2.1 兩國審批政策的基礎性要素對比
在創新醫療器械審批實踐中,有些要素沒有直接體現在政策條文中,卻構成了創新審評政策的基礎。盡管中國從2014年起頒布多項政策來促進醫療器械的創新,但中美兩國的創新審批政策在創新計劃的驅動機構、創新政策的基本理念、創新實施的理論基礎等方面存在明顯差距(表2)。
1.2.2 兩國審批政策的具體措施對比
在創新醫療器械審批實踐中,影響注冊產品申報審批時限長短、獲準審批與否的關鍵就是具體的條款規定和執行措施,筆者梳理了中美兩國創新醫療器械注冊的執行文件和相關規定,中國在溝通機制、外部資源整合及配套政策等方面與美國創新政策存在差距(表3)。
2 中美創新醫療器械政策比較分析
2.1 創新驅動行政層級的差別
美國創新計劃是由《食品藥品法案修正案》驅動,法案為國會頒布,具有最高立法效力,政府行政部門必須貫徹實施,FDA在此框架下推出各種計劃和制度予以落實,只要法案不變,FDA就必須持續執行創新行動的要求。而中國創新計劃僅為政府部門的規范性文件,文件與法律的差別在于,文件的簽發部門可以隨時修改甚至廢除自己所頒布的文件,而法律則必須經過立法部門嚴格的程序才能修改,因此,中國醫療器械創新政策對創新行動的保障力度與美國相比有顯著的差距。

2.2 監管科學理論基礎的差別
美國的創新行動有監管科學作理論支持,中國則沒有明確的系統理論來指導。監管科學是用來開發FDA監管產品的安全性、有效性、質量和性能的新工具、新標準和新方法的科學,最小工作量和關鍵路徑是監管科學的核心要義,FDA所頒布的創新醫療器械的措施與行政措施是一脈相承的,共同點就是滿足最小工作量和關鍵路徑,即便在創新探索階段不是一次性滿足這些要求,但監管科學本身具有自我糾錯能力,也會在最短時間內回到最小工作量和關鍵路徑軌道。再看中國,不但創新行動起步比美國晚6~8年,而且創新進度也遠落后于美國,最近3年FDA的創新審評效率是CFDA的8~10倍。兩國創新行動實踐的差距其實是兩國是否由監管科學理論支撐所決定的。以審評員早期介入為例,中國的早期介入,是申請人把申報資料提交給政府,經審核滿足創新要求并獲準以創新通道程序進行審批之后,再由專人負責一路綠燈依照程序進行。美國在最小工作量和關鍵路徑原則指導下,從企業的研發或改進創意的提出FDA就開始介入,包括研發過程的關鍵階段、動物試驗、臨床試驗、質量體系建立、注冊申報資料填寫等。
2.3 在外部資源整合及內部資源挖掘上的差別
FDA認為醫療器械新興技術的出現,必然會給FDA在科學知識和監管政策方面帶來挑戰,為了彌補內部資源的不足或技術滯后,FDA充分整合外部資源以保持與技術創新步調的一致性。為此,FDA不但組建了外部專家網(庫)、咨詢委員會,還實施第三方檢測項目的自我認證、臨床試驗機構的認證及海外臨床試驗數據的認證等項目,與非企業性質的學術機構建立長期合作機制,促進監管科學的發展。通過對外部資源的整合,使得FDA在未增加任何投資的前提下,其審批能力大大提高,以應對技術革新給監管政策帶來的挑戰。而中國在外部資源整合方面,僅外部專家作用的發揮與美國接近,在第三方檢測認證、臨床試驗機構認證及海外臨床試驗數據認證等方面都尚未真正起步。
同時,FDA在內部資源的挖掘和利用方面也明顯領先于中國。隨著計算機科學和信息技術的發展,原有的海量數據已成為監管部門內部的重要資源。為此,FDA制定專項規劃對這些數據進行開發以提升創新醫療器械的開發速度和監管措施的改進。而CFDA對內部數據挖掘、利用的正式規劃尚未在公開的資料中見到。
3 對中國創新醫療器械行動計劃的建議
3.1 將創新醫療器械行動上升至法律層面
醫療器械尤其是創新醫療器械屬于高科技和學科交叉的產品,技術發展快、風險高,在醫療器械已成為一個國家技術水平和綜合國力象征的今天,中國應將創新醫療器械行動上升到法律地位,用法律保證創新行動的發展動力和持續性。習近平同志于2014年6月在兩院院士大會上指出:“實施創新驅動發展戰略,最根本的是要增強自主創新能力,最緊迫的是要破除體制機制障礙,最大限度解放和激發科技作為第一生產力所蘊藏的巨大潛能”。筆者認為,破除體制機制障礙最有效的途徑就是通過立法手段予以保障。
3.2 加大監管科學研究力度
任何政策的制定都是以一定思想理論做指導的,監管政策的制定應以監管科學為基礎。美國提出監管科學已有10余年,監管科學的思想已植入FDA官員的思維方式,社會各界對監管科學的發展都給予了支持。而中國對監管科學的研究尚未正式啟動,雖然近幾年已有學者開始發表文章介紹監管科學的理論體系,介紹FDA為促進監管科學發展所采取的行動措施,還有學者呼吁要創建中國自己的監管科學[8],建議政府制定研究發展規劃,內容至少應包括以下內容:毒理學創新、臨床評估新方法、產品制造和改進方法、創新技術評估、信息技術與健康、社會學與公民健康等方面。
3.3 對外部資源整合和內部資源挖掘做出規劃
正如經濟學理論的觀點“資源是有限的”,政府對醫療器械創新行動的審批資源(包括人力和設施)也必然是有限的。中國應該借鑒美國FDA的做法,充分發揮外部資源的作用,包括外部專家和外部機構及設施資源,都可為創新行動服務,關鍵在于如何設計整合這些外部資源的方法。2017年10月,中共中央辦公廳、國務院辦公廳聯合發出通知,對創新醫療器械的指導思想非常明確,關于醫療器械的臨床試驗、海外試驗數據、第三方機構檢測和審評文件等工作,都可通過政府購買服務的形式實現。已為整合外部資源指出了明確方向,現在需要做的,就是以監管科學的理論為指導,在保證產品安全有效的前提下,盡快制定第三方機構檢測實施細則、臨時試驗海外數據認定標準、第三方機構審批實施細則以及內部數據資源挖掘計劃等,以進一步加快我國醫療器械創新審批速度,縮小與發達國家之間的差距。
參考文獻
[1] U.S. Food and Drug Administration. Medical device innovation initiative white paper[EB/OL]. [2018-02-12]. https://www.fda.gov/aboutfda/centersoffices/ officeofmedicalproductsandtobacco/cdrh/cdrhinnovation/ ucm242067.htm.
[2] 劉文博, 石浩. 對創新醫療器械特別審批程序所涉及知識產權問題的思考[J]. 廣東化工, 2016, 43(11):128, 146.
[3] 宋鐸. 創新醫療器械特別審批的相關要求探討[J]. 醫療器械信息, 2015(9): 16-19.
[4] 楊依晗, 王廣平, 高惠君. 美國食品藥品監管大數據實踐簡介及對我國的啟示[J]. 上海醫藥, 2017, 38(9): 16-19.
[5] 徐研偌. 美國FDA最少工作量原則應用給我們的啟示[J].中國醫療器械信息, 2011, 17(5): 34-36.
[6] FDA. The critical path initiative[EB/OL]. [2018-02-12]. https://www.fda.gov/down loads/ScienceRes-earch/ SpecialTopics/CriticalPathInitiative/ UCM 2216 51.Pdf.
[7] FDA. Advancing regulatory science at FDA: a strategic plan, August 2011[EB/OL]. [2018-02-11]. https://www.fda.gov/ downloads/ Science Research/SpecialTopics/Regulatory Science /UCM 268 225.pdf.
[8] 劉昌孝, 程翼宇, 范驍輝. 轉化研究: 從監管科學到科學監管的藥物監管科學的發展[J]. 藥物評價研究, 2014, 31(5): 385-391.

