櫛孔扇貝Foxl2蛋白的原核表達、純化及多克隆抗體制備與檢測
劉曉玲,王振東,孫涵甜,王振華,趙振軍,李 忌
(煙臺大學生命科學學院,山東煙臺 264005)
Foxl2(forkhead box l2)是叉頭框轉錄因子基因,研究發現其在脊椎動物卵巢中高表達,而在精巢中弱表達或不表達[1],深入的功能研究表明,該基因參與哺乳動物卵巢功能維持[1-2]。該基因在無脊椎動物中的相關研究相當有限,在海膽 (Strongylocentrotus purpuratus)[3]、皮 海 綿(Suberites domuncula)[4]、太 平 洋 牡 蠣(Crassostrea gigas)[5]和 櫛 孔 扇 貝 (Chlamys farreri)[6]中有表達研究,且其表達研究主要集中在轉錄水平:其中 TU等[3]對紫色球海膽的Foxl2研究僅發現胚胎期都有表達,是一種合子基因,未有深入研究。DHEILLY等[5]利用基因芯片技術通過差異檢測發現Foxl2在太平洋牡蠣中是雌性相關基因,在卵巢中特異表達。劉曉玲等[7]發現Foxl2在成體櫛孔扇貝中具與已報道的脊椎動物一樣的明顯性別二態性表達,推測該基因在性別穩定的無脊椎動物櫛孔扇貝的卵巢中發揮一定功能。LI等[8]通過轉錄組測序發現Foxl2在蝦夷扇貝 (Patinopecten yessoensis)卵巢中高表達,推測參與卵巢決定和分化。然而上述無脊椎Foxl2的性別相關表達研究僅集中在轉錄水平,僅ADELL等[4]利用免疫組化技術對皮海綿的Sd-Foxl2進行了蛋白水平表達檢測,發現在各種細胞中都有表達,認為在皮海綿中該基因不是性別相關基因。
綜上,Foxl2基因在低等動物中的功能尚需深入研究。在前期研究的基礎上,本研究繼續選取性別穩定的櫛孔扇貝為研究對象,通過PCR克隆櫛孔扇貝Foxl2基因,構建了大腸桿菌表達載體并誘導獲得重組蛋白,純化后制備了多克隆抗體,探索了Foxl2蛋白在性腺中的表達,旨在為進一步研究Foxl2在櫛孔扇貝卵巢中的作用奠定實驗基礎。
1 材料與方法
1.1 材料
櫛孔扇貝cDNA、質粒及菌種cDNA均由本實驗室制備,DH5α、BL21(DE3)及載 pET-28a等則購自寶生物工程(大連)有限公司。
1.2 試劑與儀器
限制性內切酶 EcoRΙ和 HindIII、T4 DNA連接酶等工具酶以及IPTG等購自寶生物工程 (大連)有限公司;PCR反應體系、質粒提取試劑盒、DNA回收試劑盒、Ni-NTA蛋白純化試劑盒、DNA Marker、動物組織總蛋白提取試劑盒、羊抗兔IgG購自生工生物工程 (上海)股份有限公司;蛋白Marker購自北京經科宏達生物技術有限公司;新西蘭大白兔 (New Zealand white rabbits)由煙臺綠葉制藥公司提供,弗氏完全佐劑及弗氏不完全佐劑、考馬斯亮藍染色液、脫色液等購自德國Sigma公司,PVDF膜購自博士德公司。
儀器包括:搖床DYY-Ⅲ型穩流穩壓電泳儀(北京市六一儀器廠);高速冷凍離心機5810R型(Eppendorf公司);凝膠成像系統(美國 UVP公司);NANODROP 1000核酸蛋白測定儀 (Thermo公司);TC-XP型基因擴增儀 (杭州博日科技有限公司);RT-6000酶標分析儀(Rayto公司)。
1.3 引物設計
根據櫛孔扇貝 Foxl2基因cDNA全長(GenBank JN642286)[7]設計引物,以期擴增獲得其完整的開放閱讀框。對其閱讀框內所含的酶切位點及pET-28a載體多克隆位點進行分析,在上下游引物中增加EcoRΙ和HindIII兩個酶切位點序列(下劃線),引物由華大基因公司合成,序列如下:5′GAATTCATGGCCTTGTCATTTTACGA 3′;5′AAGCTTTCACCTCTCTCCCCAGTATG3′。
1.4 目的基因PCR擴增、TA克隆及質粒提取
采用柱式動物RNAout試劑盒(北京天恩澤公司)提取櫛孔扇貝卵巢RNA,cDNA反轉錄試劑盒(大連寶生物公司)反轉錄形成cDNA,以此cDNA為模板,構建如下20μL PCR體系:10×PCR buffer 2.0μL;MgCl2(25 mM)1.6μL;dNTP(10 mM)0.4μL;引物 (10μM)各2.0μL;Taq DNA聚合酶 (5UμL-1)0.2μL;cDNA模板 1 μL,ddH2O補齊。反應條件為:95℃預變性5 min;95℃變性30 s,57℃退火35 s,72℃延伸90 s,30個循環;72℃充分延伸10 min。產物電泳鑒定后TA連接,轉化DH5α,篩選陽性克隆后提取質粒。
1.5 重組表達質粒構建與測序鑒定
上述提取的質粒與pET-28a分別進行EcoRΙ和HindIII雙酶切,對酶切產物進行膠回收,T4連接酶16℃溫育連接過夜,連接產物轉化感受態DH5α,卡那霉素及菌落PCR篩選陽性克隆,提取質粒雙酶切鑒定,對應菌株送華大基因測序。
1.6 重組質粒提取及BL21轉化
將測序結果與櫛孔扇貝Foxl2基因序列一致的陽性菌株大量培養,提取質粒后轉化感受態BL21,卡那霉素篩選陽性克隆,并再次測序驗證序列。
1.7 蛋白誘導條件優化與表達
分別取陽性克隆30 mL,37℃培養至OD 600 nm達0.6左右,分別加入IPTG至終濃度為0.2、0.4、0.8、1.0、1.2 mmol·L-1,誘導 6 h對 IPTG誘導濃度進行優化。
1.8 目標蛋白的SDS-PAGE分析及鎳柱純化
取含重組質粒的誘導后菌液4 000 r·min-1離心5 min,收集沉淀,加入無菌1×PBS溶液懸浮,于冰浴中200 W超聲波破碎細胞。分別取全細胞、12 000 r·min-1離心后的上清和沉淀進行SDS-PAGE分析以確定重組蛋白的可溶性。
大量誘導的菌液,用Ni-NTA蛋白純化試劑盒中的Binding/wash buffer(含有終濃度為8 M的尿素)溶解(包涵體),室溫下溫育30~60 min。待溫育完全后,12 000 r·min-1離心30 min,將上清進行Ni柱親和層析純化,核酸蛋白測定儀檢測純化蛋白濃度。
1.9 抗體制備與檢測
取200μg純化后的重組Foxl2蛋白,與弗式完全佐劑按1∶1的體積比乳化完全(油包水狀),采用背部皮下多點注射的方法分別免疫兩只雄性新西蘭大白兔;兩周后取100μg純化的Foxl2蛋白與弗式不完全佐劑按1∶1的體積比乳化完全,進行二次免疫,兩周后以同樣的方法進行第三次免疫,一周后取血,4℃靜置24 h后,血液變為膠凍狀,5 000 rpm離心10 min,收集上層血清。
以純化后的Foxl2蛋白為抗原,將制備的抗體血清按照1∶200~1∶256 000倍稀釋,采用HRP(辣根過氧化物酶)標記的羊抗兔IgG為二抗,進行間接ELISA分析,當OD450nm=1.0時,抗血清的稀釋度即為抗體效價[9]
WB(Western blot)分析所制備抗體的特異性,利用蛋白提取試劑盒(上海生工生物工程公司)提取扇貝成體精卵巢組織蛋白,分別進行SDS-PAGE電泳(兔抗β-actin多抗調平組織蛋白上樣量),將蛋白轉到PVDF膜上,用稀釋到1∶2 000的所制抗體血清進行孵育,洗膜后再用羊抗兔IgG孵育后顯色,凝膠成像系統拍照觀察結果。
2 結果與分析
2.1 PCR擴增得到的Foxl2基因
如圖1所示,利用設計的引物擴增目的基因,獲得與預期大小(1 119 bp,含引物中增加的酶切位點序列)相符的片段。

圖1 Foxl2基因PCR擴增結果Fig.1 PCR amplification results of Foxl2 gene注:1:Foxl2基因擴增產物;M:DL2000 DNA markerNotes:1:Foxl2 PCR amplification product;M:DL2000 DNA marker
2.2 重組質粒p ET-28a的構建與鑒定結果
目的基因與pET-28a連接后轉化感受態DH5α,選陽性克隆提取重組質粒pET-28a進行雙酶切鑒定,結果如圖2顯示:酶切后出現與目的條帶大小吻合的片段。選取對應的陽性菌株送華大基因有限公司完成DNA序列測序,結果顯示與扇貝Foxl2基因序列完全一致。提取質粒轉入BL21后再次測序仍與目的基因序列一致。
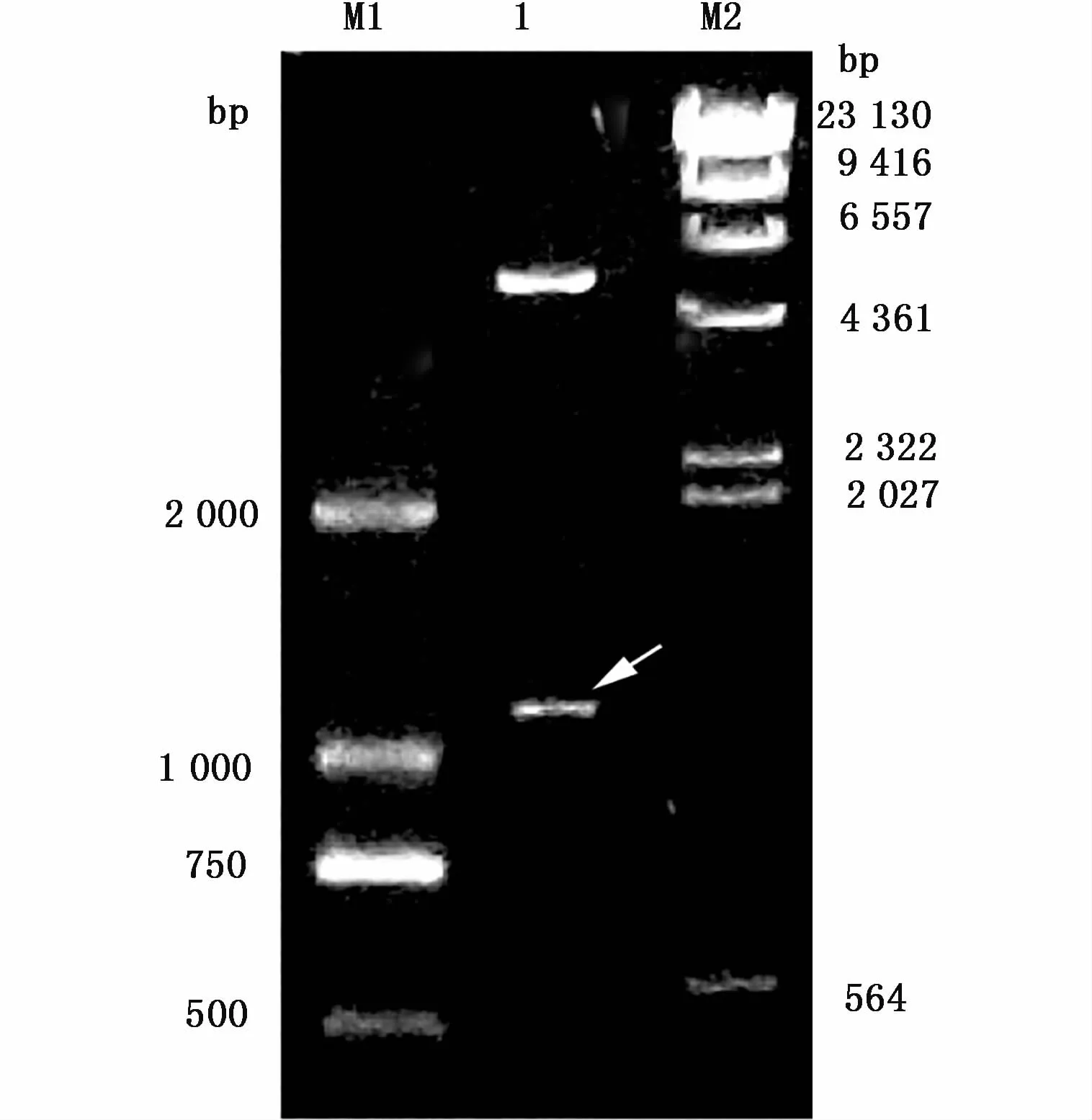
圖2 重組載體的酶切鑒定Fig.2 Identification of recombinant vector by enzyme digestion注:M1:DL2000 DNA marker;1:雙酶切重組質粒 pET-28a(箭頭所指為酶切后的目的條帶,另一條為酶切后的pET-28a);M2:λDNA/HindIII MarkerNotes:M1:DL2000 DNA marker;1:recombinant plasmid pET-28a digested by double restriction enzymes(arrow represents the objective gene fragment,the other band is pET-28a after enzyme digestion);M2:λDNA/HindIII Marker
2.3 重組蛋白的表達與鑒定(含條件優化)結果
對IPTG誘導濃度進行優化,結果如圖3所示,IPTG終濃度在1.0 mmol L-1以內時,誘導效果隨IPTG濃度增加而增強,故選擇1.0 mmol L-1為最終誘導濃度。
對含空質粒及含重組質粒的菌液誘導6 h后進行SDS-PAGE電泳分析,結果如圖4所示,與對應含空載體pET-28a的菌液相比,含重組載體的菌液經6 h誘導后約在46 KD(采用Dnastar軟件預測Foxl2蛋白分子量約為41.96 KD,載體上融合表達的標簽約3.7 KD)左右出現較粗的蛋白條帶。
收集細菌超聲破碎后,離心獲得沉淀和上清,SDS-PAGE電泳結果顯示:重組蛋白主要存在于沉淀中,說明pET-28a原核表達的Foxl2蛋白產物主要以包涵體形式存在。
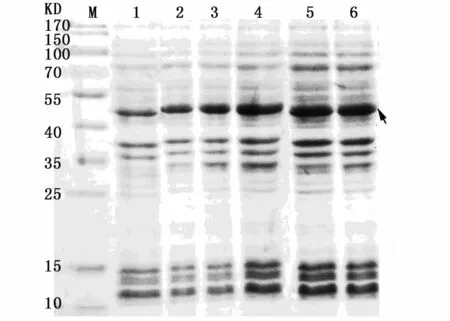
圖3 IPTG濃度對誘導效果的影響Fig.3 Induction effect of different IPTG concentrations注:1:IPTG終濃度為 0 mmol·L-1;2:IPTG終濃度為 0.2 mmol·L-1;3:IPTG濃度為0.4 mmol·L-1;4:IPTG濃度為0.8 mmol·L-1;5:IPTG濃度為 1.0 mmol·L-1;6:IPTG濃度為1.2 mmol·L-1;箭頭所指為目的蛋白Notes:1:IPTG final concentration was 0 mmol·L-1;2:IPTG final concentration was 0.2 mmol· L-1;3: IPTG final concentration was 0.4 mmol·L-1;4:IPTG final concentration was 0.8 mmol·L-1;5:IPTG final concentration was 1.0 mmol·L-1;6:IPTG final concentration was 1.2 mmol·L-1;the arrow shows interest protein

圖4 誘導蛋白SDS-PAGE圖Fig.4 SDS-PAGE of induced protein注:1:空質粒菌液全細胞;2:空質粒菌液上清;3:空質粒菌液沉淀;4:重組質粒菌液全細胞;5:重組質粒菌液上清;6:重組質粒菌液沉淀;箭頭所指為目的蛋白Notes:1:whole cell with empty plasmid;2:supernatant with empty plasmid;3:precipitation with empty plasmid;4:whole cell with recombinant plasmid;5:supernatant with recombinant plasmid;6:precipitation with recombinant plasmid;the arrow shows interest protein
2.4 包涵體的溶解與純化結果
包涵體用含8 M尿素的Binding/wash buffer(Ni-NTA蛋白試劑盒中提供)溶解,利用Ni柱進行目的蛋白純化,結果如圖5所示,獲得目的蛋白,進一步測得純化所得蛋白濃度為800μg mL-1。
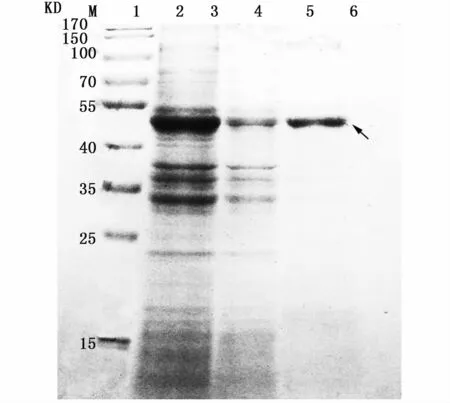
圖5 蛋白純化SDS-PAGE圖Fig.5 SDS-PAGE of purified protein注:1:純化前蛋白;2:過柱流出液;3:純化后蛋白;箭頭所指為目的蛋白Notes:1:protein before purified;2:column effluent;3:purified protein;the arrow shows interest protein
2.5 多克隆抗體的制備與鑒定
ELISA效價測定顯示所制備抗體效價大于1:128 000。WB結果顯示所制備抗體血清能特異識別扇貝卵巢中42 KD左右蛋白(與Foxl2大小吻合),Foxl2蛋白在卵巢中表達,而精巢中幾乎不表達。
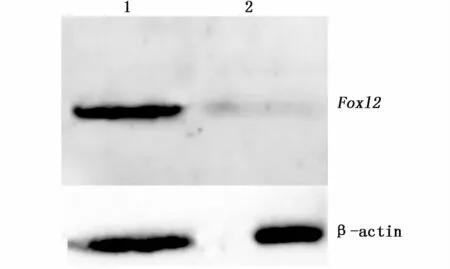
圖6 櫛孔扇貝性腺組織中Foxl2蛋白表達的Western blot圖Fig.6 Western blot of Foxl2 protein expression in gonads of scallop Chlamys farreri注:1:卵巢;2:精巢Note:1:Ovary;2:Spermary
3 討論
本研究中含Foxl2基因重組pET-28a載體的大腸桿菌在37℃誘導系統中有表達,但主要以不溶性包涵體形式存在,實驗嘗試用較低溫度條件誘導表達,其表達的目的蛋白仍不可溶,或與表達的Foxl2蛋白偏大有關,通常大腸桿菌所表達的胞質蛋白大于100個氨基酸,則容易形成包涵體[10]。本研究中,包涵體經尿素溶解后純化所得蛋白免疫新西蘭大白兔,所得抗體效價高、特異性強,已能滿足后續研究需要。
在哺乳動物中Foxl2基因被認為是卵巢分化的早期標記分子[11],對其功能研究發現,該基因可調節卵巢顆粒細胞分化,在卵巢發育及功能維持方面發揮作用[12]。而該基因在無脊椎動物中的功能研究極少見報道,LIU等[6,13]通過對櫛孔扇貝中Foxl2 mRNA水平表達模式研究,推測其在成體卵巢發育及幼貝卵巢分化中發揮作用,其具體功能研究有待進行。
Foxl2屬于叉頭框轉錄因子家族,其功能主要依靠蛋白水平對其他基因的調控來發揮[14-15],對于哺乳動物Foxl2基因的研究發現其蛋白水平與mRNA水平的表達與定位存在差異,小鼠卵母細胞中可定位到該基因的mRNA[16],小鼠和山羊的睪丸中也可檢測到該基因的mRNA[16-17],但對哺乳動物 Foxl2蛋白的表達研究卻發現,其僅在卵巢顆粒細胞中表達,而在精巢和卵母細胞中不表達[11],故有研究者認為該蛋白最終是通過調節卵巢顆粒細胞增殖的方式發揮作用[1]。無脊椎動物中Foxl2的表達研究多集中在RNA水平,僅在皮海綿中通過免疫組化研究了Foxl2蛋白的表達,卻顯示其在各類細胞中都有所表達[4],Foxl2蛋白在無脊椎動物中的表達模式仍不明確。本研究通過制備櫛孔扇貝Foxl2多克隆抗體,進一步通過WB檢測到Foxl2在卵巢中強表達,而在精巢中幾乎不表達,該結果與劉曉玲等[7]對櫛孔扇貝成體性腺中RNA的表達模式相吻合,也與 LI等[8]對蝦夷扇貝中Foxl2轉錄水平表達的研究相符,推測該蛋白在扇貝卵巢中發揮重要作用。
對櫛孔扇貝Foxl2蛋白進行體外表達及抗體制備可為扇貝卵巢中該蛋白的具體細胞定位提供分子工具,從而為進一步研究其在貝類卵巢中的作用機制奠定實驗基礎。
4 小結
本研究首次在大腸桿菌原核表達系統中表達出櫛孔扇貝的Foxl2蛋白,其在BL21中主要以包涵體形式高效表達,經純化后獲得的Foxl2具強免疫原性,免疫新西蘭大白兔獲得效價高且能特異識別天然Foxl2的多克隆抗體,用WB檢測發現Foxl2蛋白在櫛孔扇貝成體中呈雌性性別相關表達,該表達模式暗示Foxl2蛋白在櫛孔扇貝卵巢中發揮重要功能。

