土壤Mehlich-3可浸提態鎳對大麥根伸長的毒性
朱廣云,蔣 寶,李菊梅,李合蓮,馬義兵
?
土壤Mehlich-3可浸提態鎳對大麥根伸長的毒性
朱廣云1,2,蔣 寶2,李菊梅2,李合蓮1,馬義兵3*
(1.濟南大學資源與環境學院,山東 濟南 250022;2.中國農業科學院農業資源與農業區劃研究所 北京 100081;3.廣東省生態環境技術研究所,廣東 廣州 510650)
本研究選擇我國具有代表性的11種外源添加鎳(水溶性鎳鹽)污染土壤樣品,在模擬田間人工降水(淋洗和非淋洗)處理后,研究了Mehlich-3單次或連續3次浸提態鎳對大麥根伸長的毒性.結果發現: 結合重要影響因素土壤pH值,Mehlich-3可浸提態鎳和外源添加鎳具有顯著相關關系;基于Mehlich-3可浸提態鎳的植物毒性閾值也顯著受土壤性質影響(半抑制濃度可相差38倍以上).通過回歸分析發現土壤性質對Mehlich-3浸提鎳的生物毒性的影響與Mehlich-3浸提次數有關,主要影響因子分別是鐵鋁錳氧化物和粘粒含量(單次浸提)或土壤pH值和有機質(3次浸提).研究建立了基于可浸提態鎳對大麥根伸長的毒性閾值預測模型.研究結果證明了重金屬的化學浸提態代替全量作為風險評價標準的可行性,為提高土壤中鎳的生態風險評估的準確性和科學性提供支撐.
鎳;Mehlich-3;可浸提態;土壤;生物有效性
目前,大多數土壤生態風險評價和土壤環境質量標準多以重金屬總量為指標來判斷其生態毒性,基于土壤重金屬總量的生態風險評估和土壤環境質量標準在評估重金屬的生態毒害方面往往具有很大的不確定性[1],主要是由于總量不能很好地表示重金屬的移動性和生物有效性[2].基于總量建立的生物毒害模型在生物有效性低的高背景土壤或不同污染源重金屬土壤中具有很大的局限性.重金屬的生態風險評估不僅應該考慮重金屬含量還需要考慮其生物有效性.因此研究基于重金屬生物有效性或可浸提性的重金屬毒性及其預測模型對于土壤重金屬生態風險評價是非常必要的[3].
重金屬的生物有效部分被認為是真正對有機體造成毒害的部分[4].重金屬的生物有效性可以反應土壤重金屬污染程度以及對生態系統的潛在危害.明確重金屬的生物有效性是土壤重金屬生態風險評價的關鍵.化學浸提法是目前應用最廣泛的重金屬有效性的評價方法[5-6].其中Mehlich-3作為浸提劑[7],適用范圍廣泛,它不僅適用于酸性和中性土壤,也適用于堿性或石灰性土壤[8-10],是一種較好的聯合通用浸提劑.浸提劑中含有無機鹽組成的緩沖溶液和絡合劑,可以浸提土壤樣品中重金屬的可交換態,部分碳酸鹽結合態和有機結合態[11].土壤浸提劑Mehlich-3在土壤營養元素的生物有效性評價已經得到了廣泛應用,但是在土壤重金屬毒性方面的研究還比較缺乏[9-10].
本研究結合土壤理化性質,量化總外源添加鎳濃度和Mehlich-3可浸提態鎳濃度之間的關系;建立基于Mehlich-3可浸提態鎳對大麥根伸長的毒性閾值和土壤性質的生物有效性模型.研究重金屬的化學浸提態代替全量作為風險評價標準的可行性,提高土壤中鎳的生態風險評估的準確性和科學性.
1 材料和方法
1.1 土壤樣品的采集和處理
土壤樣品采集于11個地點的表層(0~20cm)我國不同土壤性質的,風干備用,其中土壤樣品的pH值和有機碳含量分布與傳統農業土壤基本一致,土壤主要理化性質、土壤類型及種植農作情況見表1.土壤pH值: 4.93~8.90,CEC: 7.47coml+/kg~ 33.6coml+/kg,OC: 0.6%~2.2%,黏粒含量(<2μm): 16%~66%.
取過尼龍篩(<2mm)的風干土,以NiCl2溶液的形式向土壤中均勻添加鎳.添加鎳的濃度根據土壤pH值不同設置7個濃度(不包括對照),土壤pH值<5時,鎳的添加量分別是0,12.5,25,50,100,200,400, 800mg/kg;pH值為5~7時,鎳的添加量分別是0,25,50,100,200,400,800,1600mg/kg;pH值>7時,鎳的添加量分別是0,37.5,75,150,300,600,1200, 2400mg/ kg.所有處理保持100%最大持水量培養2d后,風干,過篩(<2mm),保存.用ICP-OES測定土壤中鎳添加的準確含量[19].將一半的土壤樣品采用模擬田間條件做淋洗處理減少重金屬添加時伴隨的鹽害同時縮小實驗室處理和田間處理的差別.淋洗液的組份包括: CaCl25×10-4mol/L、Ca(NO3)25×10-4mol/L、MgCl25×10-4mol/L、Na2SO410-4mol/L和KCl 10-4mol/L,pH=5.9[20].淋洗處理后的樣品風干、過篩(<2mm),用ICP-OES測定淋洗處理后土壤樣品中鎳含量[19].
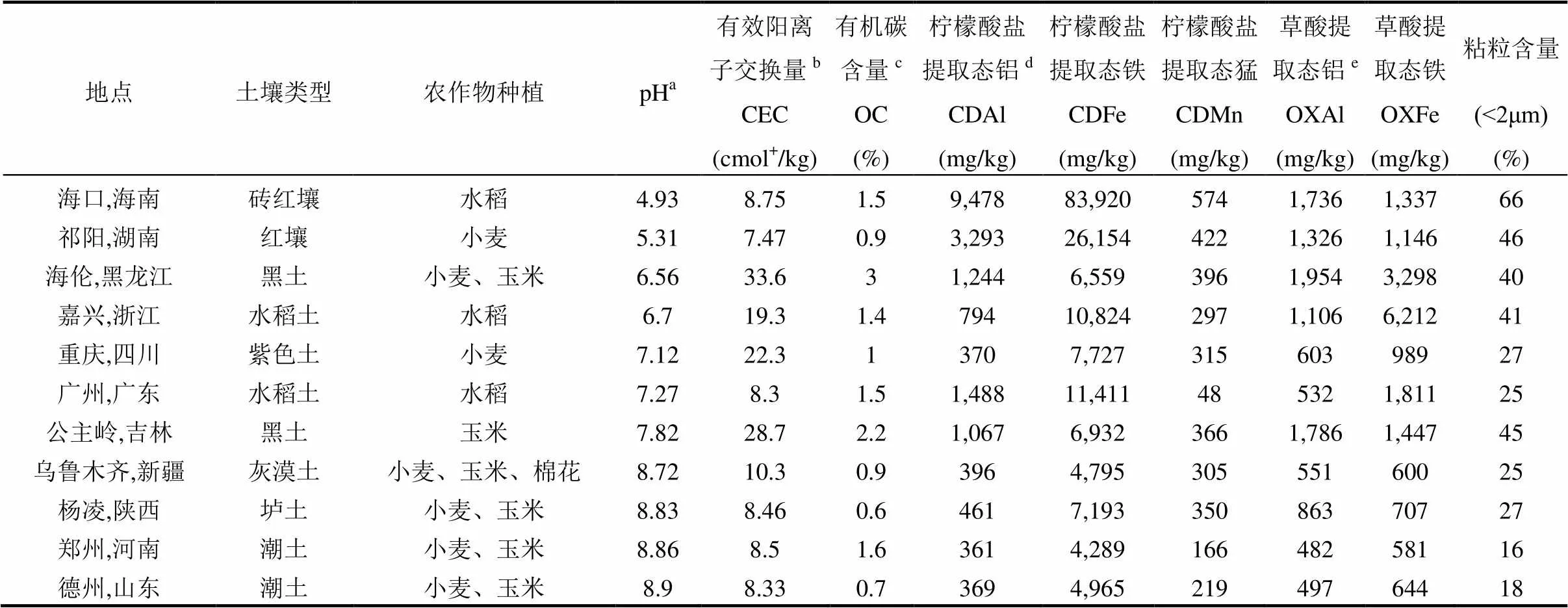
表1 土壤的主要理化性質
注:a去離子水測定(水土比為5:1)[12];b氯化銨方法測定[12];c有機碳含量測定方法[13-14];d檸檬酸鹽可提取態鋁、鐵和錳測定方法[15-16];e草酸可提取態鋁和鐵測定方法[17-18].
1.2 化學浸提方法
1.2.1 Mehlich-3浸提劑的配制 NH4F-EDTA貯備液:稱取27.78g NH4F和14.61g EDTA,加入去離子水溶解,定容至120mL去離子水中,加入14.61g EDTA去離子水定容至200mL,貯于塑料瓶中保存(在冰箱中冷藏可長期使用);Mehlich-3試劑:稱取20.0g NH4NO3溶于約500mL去離子水中,加入4mL上述NH4F-EDTA貯備液,再加入11.5mL CH3COOH和0.82mL HNO3,去離子水定容至1L.pH值應為(2.5±0.1),貯于塑料瓶中備用.
1.2.2 土壤中鎳的浸提 土壤樣品稱取5.00g左右于50mL離心管中,加入25mL Mehlich-3溶液,擰緊離心管瓶蓋,室溫下(25℃)于振蕩機上200r/min振蕩2h.振蕩結束后,離心管放置在離心機上4000r/min離心20min,取上清液經孔徑0.45μm的濾膜或濾紙過濾后,收集濾液于塑料小方瓶中,待測,1次Mehlich-3浸提完成.離心后的土壤沉積物中再次加入25mL Mehlich-3溶液,按照上述方法再次振蕩,離心,過濾,收集濾液.連續浸提3次,3次Mehlich-3浸提完成.采用原子吸收光譜法(ZEEnit 700;Analytik Jena Germany)測定濾液中Mehlich-3浸提態鎳的濃度.所有處理做2個重復.總樣本數為1056個.
1.3 基于Mehlich-3浸提態鎳含量的植物毒性計算
1.3.1 大麥很伸長試驗 大麥根伸長試驗根據國際標準方法(ISO)11269-1[21]進行.將大麥在氣候培養箱中進行培養,生長條件為白天14h(22℃),夜間10h(18℃),光照強度為24000lux/m2,濕度保持在70%,保持整個試驗過程中土壤含水量為最大持水量的65%,測量大麥5d的根伸長,相關試驗細節和大麥根伸長數據參考Li等[19].
1.3.2 劑量-效應曲線擬合 根據劑量-效應log- logistic[22]方程擬合得到抑制大麥根伸長10%、20%和50%的Mehlich-3浸提態鎳的濃度.
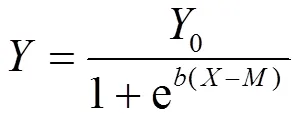
式中:為大麥相對根伸長;為Mehlich-3浸提態鎳的濃度,mg/kg;為EC(EC10、EC20、EC50)取對數;0和是模型擬合參數.
1.3.3 低劑量毒物刺激作用曲線擬合 根據方程得到毒性刺激作用曲線和毒性閾值EC10、EC20和EC50以及95%置信區間.
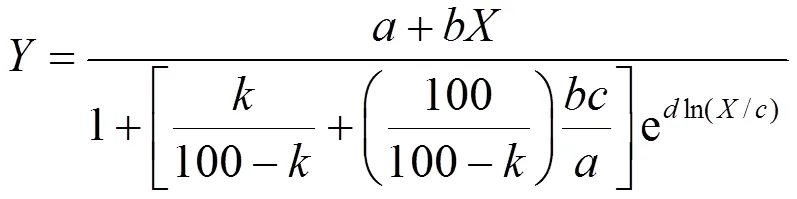
式中:為大麥相對根伸長;為Mehlich-3浸提態鎳的濃度,mg/kg;、、和是曲線擬合參數,是與EC相關的變量,當分別等于10、20或50時,參數分別定義為EC10、C20和EC50.關于低劑量毒物刺激作用的詳細描述可參考文獻[19,24].
1.4 數據處理
采用Excel 2010做數據規劃求解處理,結合土壤性質,建立土壤中Mehlich-3浸提態鎳濃度和總外源添加鎳濃度之間的關系.
采用SPSS 19.0進行逐步回歸分析,建立基于Mehlich-3浸提態鎳對大麥根伸長的毒性閾值和土壤性質之間的關系.
2 結果與討論
2.1 土壤中可浸提態鎳與外源添加鎳的關系
采用Mehlich-3可浸提態鎳占外源添加鎳的百分數來表示Mehlich-3對土壤中鎳的浸提率.對淋洗和非淋洗土壤而言,1次Mehlich-3浸提率平均分別為36%和40%;3次Mehlich-3浸提率平均分別為64%和75%.浸提率隨著pH值的升高而降低,在pH<7的土壤中浸提率平均最高為92%,而在pH>8的土壤中浸提率平均最高為67%.
為了進一步量化總外源添加鎳濃度和Mehlich-3可浸提態鎳濃度之間的關系,以及土壤性質的影響,本研究結合土壤理化性質,建立了總外源添加鎳濃度和Mehlich-3可浸提態鎳濃度之間的線性回歸模型,其中,總外源添加鎳濃度分為0~300mg/ kg和0~2000mg/kg 2個濃度梯度(表2).1次Mehlich-3浸提量每提高1個單位,外源添加總量在非淋洗和淋洗土壤中分別提高了2.238和3.355個單位;3次Mehlich-3浸提量每提高1個單位,外源添加總量在非淋洗和淋洗土壤中分別提高了1.596和1.967個單位.當總外源添加鎳濃度在0~300mg/kg時,基于1次Mehlich-3可浸提態鎳濃度與外源添加鎳濃度的線性回歸方程的決定系數(2)在非淋洗和淋洗土壤中可以達到0.65和0.80,而基于3次Mehlich-3可浸提態鎳濃度與外源添加鎳濃度的線性回歸方程的2可以分別提高到0.86和0.90.當總外源添加鎳的濃度在0~2000mg/kg時,在非淋洗和淋洗土壤中,1次Mehlich-3可浸提態鎳濃度可以解釋線性回歸模型中總外源添加鎳的濃度變異的68%和76%,3次Mehlich-3可浸提態鎳濃度可以解釋線性回歸模型中總外源添加鎳濃度變異的92%和93%.在擬合的線性回歸方程中加入pH值作為影響因子,線性回歸方程的2有較小提高,而其他的土壤理化性質,如陽離子交換量(CEC)和有機質(OC)等,則沒有起到提高線性回歸模型擬合效果的作用.基于1次或3次Mehlich-3可浸提態鎳和pH值建立線性回歸模型預測土壤中總外源添加鎳,結果見圖1.結果顯示在非淋洗和淋洗土壤中,基于3次Mehlich-3浸提建立的線性回歸模型2更高,模型擬合程度更好.
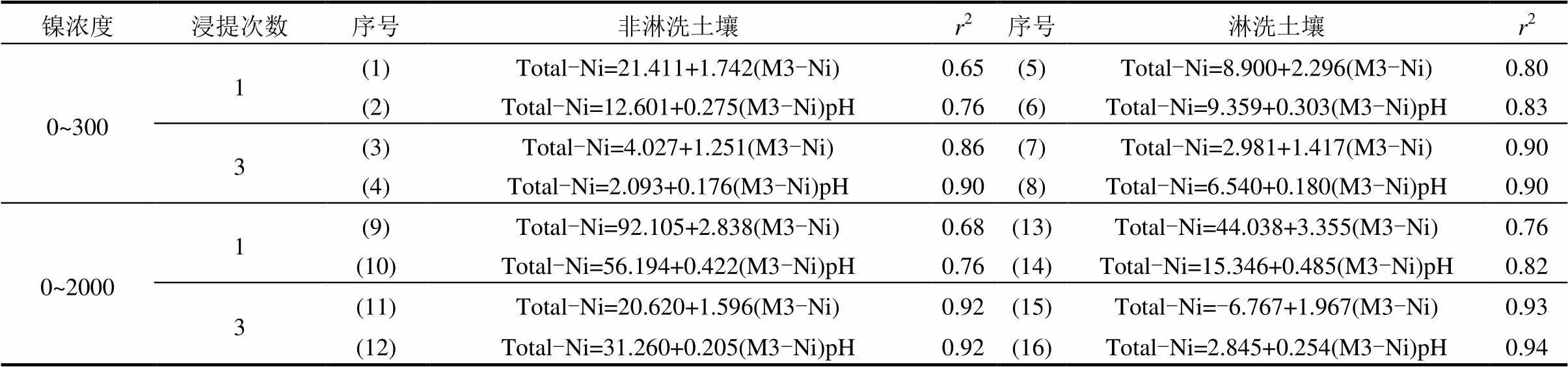
表2 土壤總外源添加鎳的濃度和Mehlich-3浸提態鎳的濃度的線性回歸關系
注: Total-Ni: 總外源添加鎳的濃度(mg/kg),M3-Ni: Mehlich-3浸提態鎳的濃度(mg/kg),r: 決定系數.
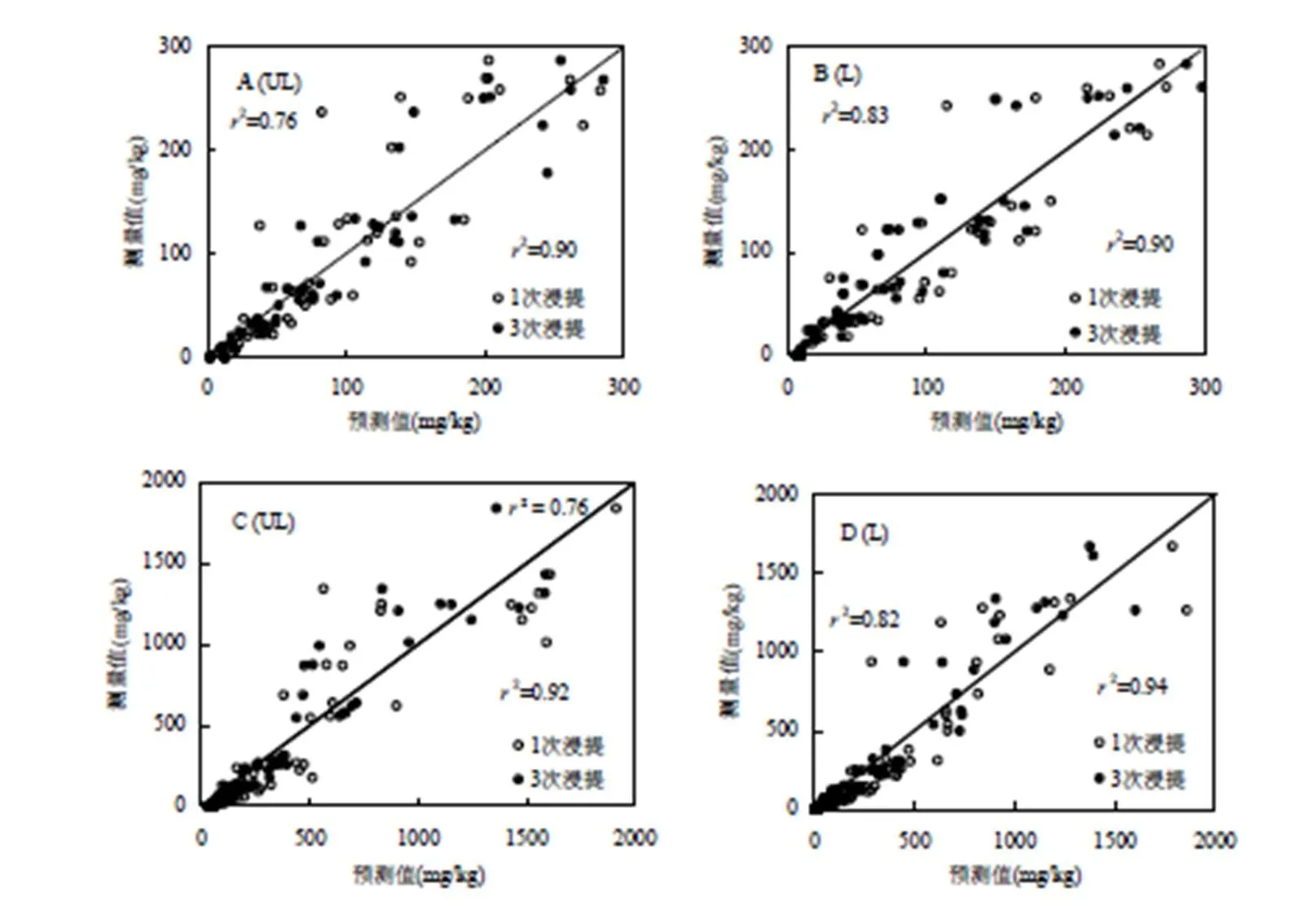
圖1 土壤中總外源添加鎳濃度的預測值和測量值
(A)由表2的方程2和方程4計算得出;(B)由表2的方程6和方程8計算得出;(C)由表2的方程10和方程12計算得出;(D)由表2的方程14和方程16計算得出.UL和L分別代表非淋洗和淋洗土壤
在大多數文獻中,土壤中重金屬的總量和植物體中的含量沒有線性關系[25],也就是說,不是所有的重金屬形態都能被植物吸收利用,植物對重金屬的吸收與重金屬的有效態部分顯著相關[26].Zhang等[2]研究發現,植物可吸收利用的重金屬主要來自土壤中的水溶態和可交換態.傳統的以總量作為標準判斷重金屬毒性是存在缺陷的,難以評估背景值高但有效性低或者不同來源重金屬的毒性,會出現高估或者低估重金屬毒性的情況[27].因此,在土壤重金屬生態風險評價中應該更多的關注重金屬的生物有效性.
結合土壤性質的,總外源添加鎳濃度和Mehlich-3可浸提態鎳濃度之間存在顯著的數量關系為土壤中鎳的可浸提態替代總外源添加鎳濃度作為重金屬風險評價的依據提供理論基礎.為了保證線性回歸模型的穩定性和準確性,基于3次Mehlich-3可浸提態鎳濃度建立線性回歸模型更加合理.
2.2 基于可浸提態鎳對大麥的毒性
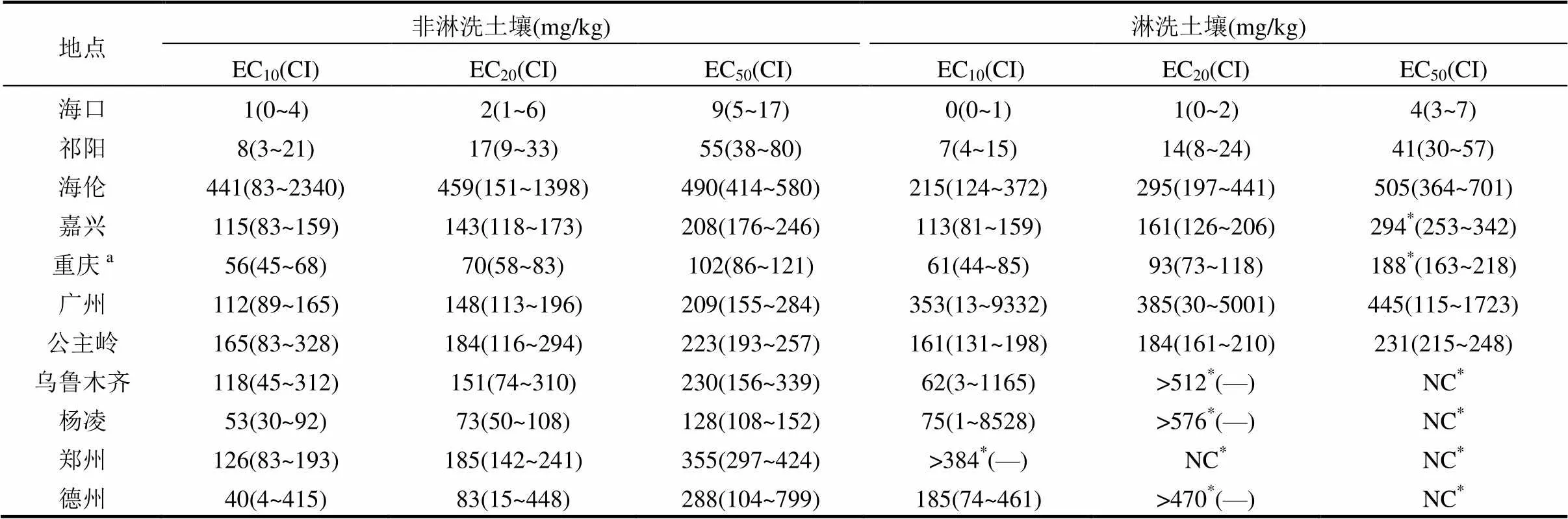
表3 基于1次Mehlich-3浸提態的鎳對大麥根伸長的毒性閾值
注: EC(=10、20、50): 抑制大麥根伸長10%、20%和50%的Mehlich-3浸提態鎳的濃度;CI: ±95%的置信區間;—: CI無法確定;NC: 毒性閾值無法確定;a低劑量毒物刺激作用;*淋洗前后的毒性閾值有顯著性差異,<0.05.
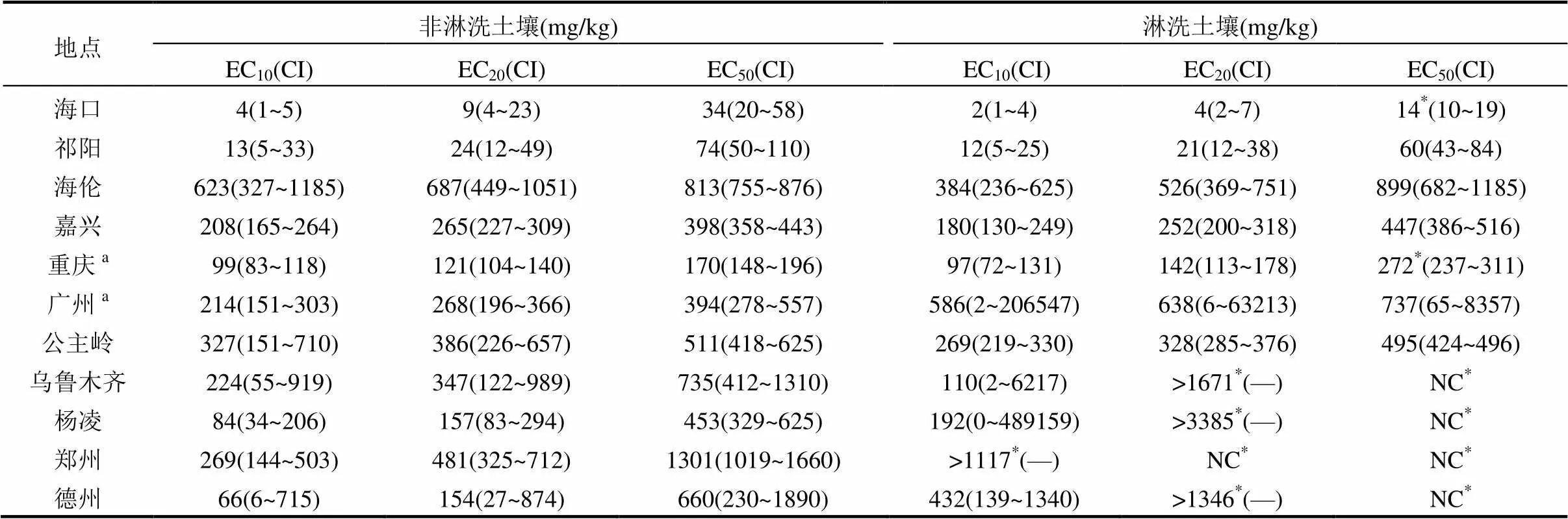
表4 基于3次Mehlich-3浸提態的鎳對大麥根伸長的毒性閾值
注: EC(=10、20、50): 抑制大麥根伸長10%、20%和50%的Mehlich-3浸提態鎳的濃度;CI: ±95%的置信區間;—: CI無法確定;NC: 毒性閾值無法確定;a低劑量毒物刺激作用;*淋洗前后的毒性閾值有顯著性差異,<0.05.
2.2.1 毒性閾值 1次和3次Mehlich-3可浸提態鎳濃度分別作為劑量,計算大麥根伸長作為效應的毒性閾值及其95%的置信區間(表3和4).在非淋洗土壤中,基于1次Mehlich-3可浸提態鎳濃度的EC10、EC20、EC50的變化范圍分別是1~441mg/ kg,2~459mg/kg,9~490mg/kg,毒性閾值變化及其范圍倍數如下: EC10(441倍)>EC20(230倍)>EC50(54倍);在淋洗土壤中,基于1次Mehlich-3可浸提態鎳濃度的EC10從0.42mg/kg增加到384mg/kg,EC20從1mg/ kg增加到576mg/kg,EC50從4mg/kg增加到505mg/ kg,毒性閾值變化及其范圍倍數EC20(576倍)>EC10(384倍)> EC50(126倍).在非淋洗的重慶土壤和淋洗后的廣州土壤中出現低劑量毒物刺激作用.淋洗土壤中,鄭州土壤的EC20,烏魯木齊、楊凌、鄭州和德州土壤的EC50無法計算得到,為淋洗降低鎳毒性,盡管1次Mehlich-3可浸提態鎳濃度為16~409mg/kg.淋洗降低鎳毒性也出現在基于總外源添加鎳濃度的毒性閾值[19],后面將進一步討論.基于3次Mehlich-3可浸提態鎳濃度的EC10、EC20、EC50相比基于1次Mehlich-3可浸提態鎳濃度的EC10、EC20、EC50在非淋洗土壤中分別增加101%、114%、147%;在淋洗土壤中分別增加117%、158%、87%,同樣存在閾值變化范圍大的情況.在Li等[19]以總量表示鎳毒性時出現相似的閾值變化范圍大的情況,其中pH值作為單一影響因子可以解釋EC50變異的70%以上.Rooney等[29]基于歐洲土壤(pH 3.3~8.7)建立鎳毒性模型時發現土壤pH值、有效陽離子交換量、粘粒含量和有機碳含量是解釋毒性閾值變化范圍大的主要因子.結果說明,無論是以重金屬的總量還是浸提態表示毒性都不能忽略土壤性質的影響.
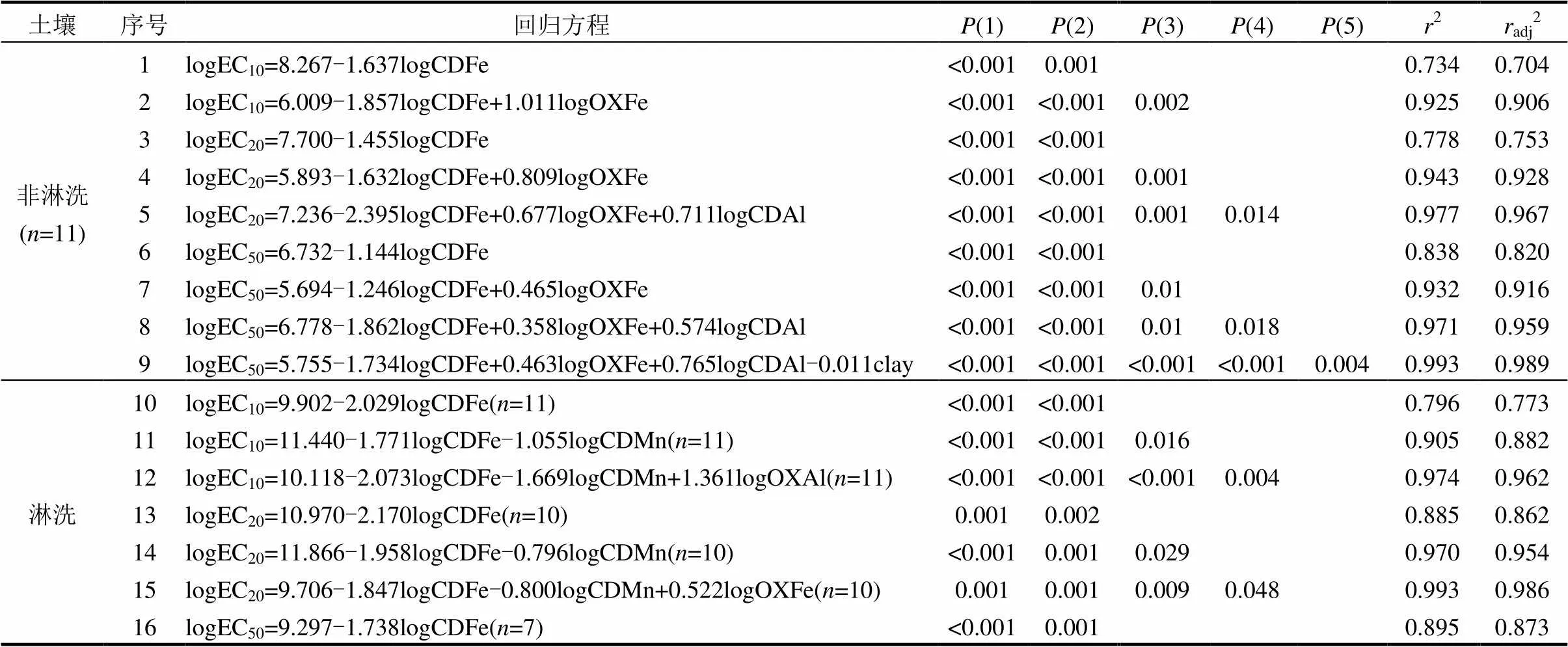
表5 基于1次Mehlich-3浸提的大麥根伸長的毒性閾值與土壤性質之間的線性回歸關系
注:(1),(2),(3),(4),(5)分別代表方程中從左到右的影響因子的顯著性水平;2:決定系數;adj2:調整決定系數.
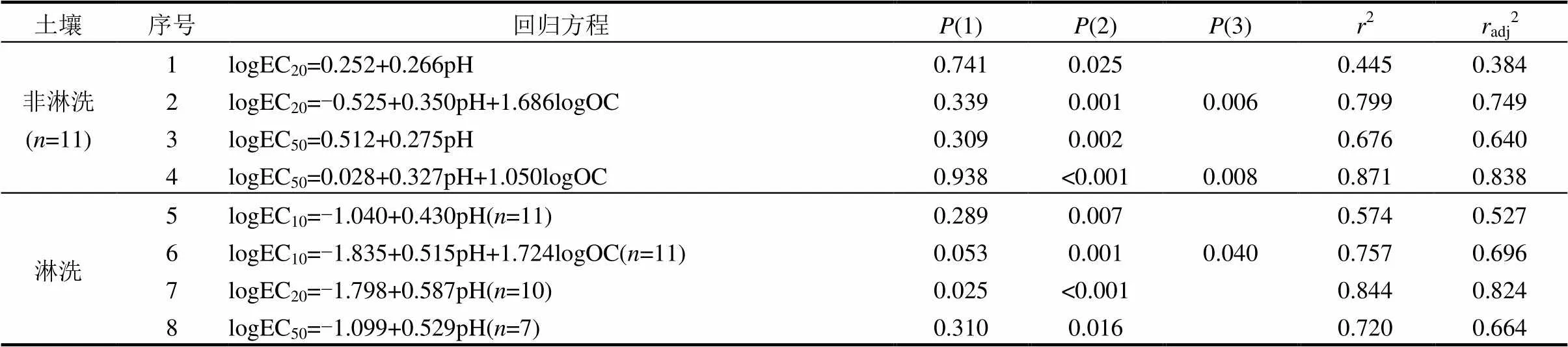
表6 基于3次Mehlich-3浸提的大麥根伸長的毒性閾值與土壤性質之間的線性回歸關系
注:(1),(2),(3)分別代表方程中從左到右的影響因子的顯著性水平;2:決定系數;adj2:調整決定系數.
2.2 淋洗對鎳毒性的影響 本研究中,基于1次或者3次Mehlich-3可浸提態鎳濃度表示鎳毒性時,淋洗處理降低鎳毒性(表3和表4),9%的EC10值、36%的EC20值和55%的EC50值在淋洗處理后顯著提高.
淋洗處理對鎳毒性的影響與土壤理化性質有關,淋洗處理降低鎳毒性多出現在堿性土壤中,在酸性和中性土壤中并不顯著.淋洗作用在堿性或石灰性土壤,和在酸性或中性土壤中不同的原因可能是可溶性鎳的釋放過程不同.Ponizovsky等[29]研究發現,在非石灰性土壤中鎳的釋放可以用吸附方程表示,在石灰性土壤中鎳的釋放可能受土壤表面沉淀的影響.當鎳毒性以總量濃度表達時,Oorts等[30]發現,相比在酸性和中性土壤中(pH 4.6~6.1),淋洗處理顯著降低了堿性土壤中鎳對微生物潛在硝化率和玉米殘渣礦化的毒害.Li等[19]在pH38.2的土壤中發現淋洗處理降低鎳對大麥根伸長的毒害.這些結論與本研究的結果相似.金屬的分配系數是指恒溫下固相溶質濃度與液相溶質濃度達到平衡時的比值[31],與土壤pH值密切相關,隨著pH值的升高而增大[32].也就是說,在高pH值的土壤中,淋洗處理很大程度上降低了土壤溶液中鎳的含量.淋洗處理降低鎳毒性的原因可能還有淋洗降低了土壤的pH值和鹽度,增加金屬鹽含量導致鎳在固液界面重新分配[19].同時,淋洗降低重金屬毒性與土壤性質,重金屬種類和生態毒性終點都有關系[33].
2.3 基于可浸提態鎳的植物毒性模型
基于1次Mehlich-3可浸提態鎳對大麥根伸長的毒性閾值和土壤性質的簡單和多元線性回歸模型(表5)中Fe(Al和Mn)氧化物含量、黏粒含量(clay)是植物毒性模型的主要參數.在非淋洗土壤中,當檸檬酸鹽提取態鐵(CDFe)作為單一影響因子能夠解釋EC10變異的70.4%,EC20變異的75.3%和EC50變異的82.0%.當線性回歸模型中加入其他影響因子時決定系數(2)有所提高.擬合效果最好的是CDFe、草酸提取態鐵(OXFe)、檸檬酸鹽提取態鋁(CDAl)和clay作為影響因子構建的多元線性回歸模型,能夠解釋EC50變異的98.9%.在淋洗土壤中,以CDFe作為影響因子的線性回歸模型分別解釋了EC10變異的77.3%、EC20變異的86.2%和EC50變異的87.3%.
基于3次Mehlich-3可浸提態鎳對大麥根伸長的毒性閾值和土壤性質的簡單和多元線性回歸模型(表6)中pH值和OC是主要參數.在非淋洗土壤中,pH值作為單一影響因子能夠解釋EC20變異的38.4%,EC50變異的64.0%.當線性回歸模型中加入OC因子時2分別提高到0.749(EC20)和0.838(EC50).在淋洗土壤中,以pH值作為影響因子的線性回歸模型分別解釋了EC10變異的52.7%、EC20變異的82.4%和EC50變異的66.4%.
大量的研究表明,pH值是影響鎳毒性和鎳在土壤中分配最主要的因子[33-36].Li等[19]基于土壤中總外源添加鎳對大麥根伸長的毒性閾值和土壤性質構建經驗預測模型時發現,土壤pH值是預測鎳毒性最重要的影響因子.在銅鎳對西紅柿和小白菜生物量毒性的研究中發現,pH值對鎳毒性的影響要比對銅的強烈[33].pH值影響鎳在固液界面的分配[31],鎳在土壤中的老化過程也受pH值影響[37].無論是從化學行為,還是鎳毒性來說,pH值都是影響鎳毒性最重要的因子.而基于1次Mehlich-3可浸提態鎳對大麥根伸長的毒性閾值和土壤性質建立生物有效性模型時,pH值不是最主要的影響因子,可能是基于1次Mehlich-3浸提態鎳建立有效性模型時,相比pH來說,土壤組分的影響更大.
3 結論
3.1 土壤pH值是影響土壤Mehlich-3可浸提鎳與外源添加鎳二者關系最主要的影響因子;結合土壤pH值,其二者存在顯著的數量關系.
3.2 土壤性質對Mehlich-3浸提鎳的生物毒性的影響與Mehlich-3浸提次數有關.1次Mehlich-3浸提態鎳時,檸檬酸鹽提取態鐵、鋁和錳以及粘粒含量是預測鎳毒性的主要影響因子;3次Mehlich-3浸提時,土壤pH值和有機質是預測鎳毒性的主要影響因子.
3.3 為保證預測模型的穩定性和準確性,3次Mehlich-3浸提比1次Mehlich-3浸提更為合理.
[1] Janssen C R, Schamphelaere K D, Heijerick D, et al. Uncertainties in the Environmental Risk Assessment of Metals [J]. Human and Ecological Risk Assessment An International Journal, 2000,6(6):1003-1018.
[2] Zhang M K, Liu Z Y, Wang H. Use of Single Extraction Methods to Predict Bioavailability of Heavy Metals in Polluted Soils to Rice [J]. Communications in Soil Science and Plant Analysis, 2010,41(7):820-831.
[3] Weng L P, Wolthoorn A, Lexmond T M, et al. Understanding the effects of soil characteristics on phytotoxicity and bioavailability of nickel using speciation models [J]. Environmental Science and Technology, 2004,38(1):156-162.
[4] Peijnenburg W J, Jager T. Monitoring approaches to assess bioaccessibility and bioavailability of metals: matrix issues [J]. Ecotoxicology and Environmental Safety, 2003,56(1):63-77.
[5] Zhou Y, Ning X A, Liao X, et al. Characterization and environmental risk assessment of heavy metals found in fly ashes from waste filter bags obtained from a Chinese steel plant [J]. Ecotoxicology and Environmental Safety, 2013,95(1):130-136.
[6] Nannoni F, Protano G. Chemical and biological methods to evaluate the availability of heavy metals in soils of the Siena urban area (Italy) [J]. Science of the Total Environment, 2016,568(15):1-10.
[7] Mehlich A. Mehlich 3soil test extractant: A modification of Mehlich 2extractant [J]. Communications in Soil Science and Plant Analysis, 1984,15(12):1409-1416.
[8] 劉 肅,李酉開. Mehlich 3通用浸提劑的研究[J]. 土壤學報, 1995,32(2):132-141.
[9] Sims J T. Comparison of mehlich 1and mehlich 3extractants for P, K, Ca, Mg, Mn, Cu and Zn in atlantic coastal plain soils1 [J]. Communications in Soil Science and Plant Analysis, 1989,20 (17/18):1707-1726.
[10] Monterroso C, Alvarez E, Fernández Marcos M L. Evaluation of Mehlich 3reagent as a multielement extractant in mine soils [J]. Land Degradation and Development, 2015,10(1):35-47.
[11] 楊 潔,瞿 攀,王金生,等.土壤中重金屬的生物有效性分析方法及其影響因素綜述[J]. 環境污染與防治, 2017,39(2):217-223.
[12] Rayment G E, Higginson F R. Australian laboratory handbook of soil and water chemical methods [M]. Melbourne, Australia: Inkata Press Pty Ltd, 1992:5-7.
[13] Igor M. Determination of carbon and nitrogen in samples of various soils by the dry combustion [J]. Communications in Soil Science and Plant Analysis, 1997,28(17/18):1499-1511.
[14] Sherrod L A, Dunn G, Peterson G A, et al. Inorganic Carbon Analysis by Modified Pressure-Calcimeter Method [J]. Soil Science Society of America Journal, 2002,66(1):299-305.
[15] McKeague J A, Day J H. Differenzierung- and Oxalate-extractable Fe and Al as aids in differentiating various classes of soils [J]. Canadian Journal of Soil Science, 1966,46(1):13-22.
[16] Schwertmann U. Dissolution Kinetics of Nickel Surface Precipitates on Clay Mineral and Oxide Surfaces [J]. Soil Science Society of America Journal, 2010,65(3):685-694.
[17] Mehra O P, Jackson M L. Iron oxide removal from soils and clays by a dithionite-citrate system buffered with sodium bicarbonate [J]. Clays and Clay Minerals, 1960,7(1):317-327.
[18] Jackson M L, Lim C H, Zelazny L W, et al. Oxides, hydroxides, and aluminosilicates. In Methods of Soil Analysis. Part 1. Physical and Mineralogical Methods [M]. USA: American Society of Agronomy, 1986:101-150.
[19] Li B, Zhang H, Ma Y B, et al. Influences of soil properties and leaching on nickel toxicity to barley root elongation [J]. Ecotoxicology and environmental safety, 2011,74(3):459-466.
[20] Oorts K, Ghesquiere U E. Leaching and aging decrease nickel toxicity to soil microbial processes in soils freshly spiked with nickel chloride [J]. Environmental Toxicology and Chemistry, 2010,26(6):1130-1138.
[21] Soil-Quality - Determination of Effects of Pollutants on Soil Flora - Part 1: Method for the Measuredment of Inhibition of Root Growth [S]. International Organization for Standardization (ISO): Geneva, Switzerland, 1993.
[22] Haanstra L, Doelman P, Voshaar J H O. The use of sigmoidal dose response curve in soil ecotoxicological research [J]. Plant Soil., 1985, 84(2):293-297.
[23] Schabenberger O, Tharp B E, Kells J J, et al. Statistical tests for hormesis and effective dosages in herbicide dose response [J]. Agronomy Journal, 1999,91(1):713-721.
[24] 郭雪雁,馬義兵,李 波.陸地生態系統中低劑量毒物刺激作用及擬合模型研究進展[J]. 生態學報, 2009,29(8):4408-4419.
[25] Chojnacka K, Chojnacki A, Górecka H, et al. Bioavailability of heavy metals from polluted soils to plants [J]. Science of the Total Environment, 2005,337(1/3):175-182.
[26] Xiao L, Guan D, Peart M R, et al. The influence of bioavailable heavy metals and microbial parameters of soil on the metal accumulation in rice grain [J]. Chemosphere, 2017,185:868-878.
[27] Wang X Q, Wei D P, Ma Y B, et al. Soil ecological criteria for nickel as a function of soil properties [J]. Environmental Science and Pollution Research, 2018,25(3):2137-2146.
[28] Rooney C P, Zhao F J, McGrath S P. Phytotoxicity of nickel in a range of European soils: Influence of soil properties, Ni solubility and speciation [J]. Environmental Pollution, 2007,145(2):596-605.
[29] Ackerman A J. Effect of field aging on nickel concentration in soil solutions [J]. Communications in Soil Science and Plant Analysis, 2008,39(3/4):510-523.
[30] Oorts K, Ghesquiere U E. Leaching and aging decrease nickel toxicity to soil microbial processes in soils freshly spiked with nickel chloride [J]. Environmental Toxicology and Chemistry, 2007,26(6):1130-1138.
[31] Sébastien Sauvé, William Hendershot, Allen H E. Solid-Solution Partitioning of Metals in Contaminated Soils: Dependence on pH, Total Metal Burden, and Organic Matter [J]. Environmental Science and Technology, 2000,34(7):1125-1131.
[32] Tipping E, Rieuwerts J, Pan G, et al. The solid-solution partitioning of heavy metals (Cu, Zn, Cd, Pb) in upland soils of England and Wales [J]. Environmental Pollution, 2003,125(2):213-225.
[33] Li B, Zhang H T, Ma Y B, et al. Relationships between soil properties and toxicity of copper and nickel to bok choy and tomato in Chinese soils [J]. Environmental Toxicology and Chemistry, 2013,32(10):2372-2378.
[34] Weng L, Lexmond T M, Wolthoorn A, et al. Phytotoxicity and bioavailability of nickel: chemical speciation and bioaccumulation [J]. Environmental Toxicology and Chemistry, 2003,22(9):2180-2187.
[35] Echevarria G, Massoura S T, Sterckeman T, et al. Assessment and control of the bioavailability of nickel in soils [J]. Environmental Toxicology and Chemistry, 2006,25(6):643-651.
[36] Everhart J L, Jr M N D, Peltier E, et al. Assessing nickel bioavailability in smelter-contaminated soils [J]. Science of the Total Environment, 2006,367(2/3):732-744.
[37] Ma Y B, Lombi E, McLaughlin M J, et al. Aging of nickel added to soils as predicted by soil pH and time [J]. Chemosphere, 2013,92(8):962-968.
Toxicity thresholds based on Mehlich-3 extractable nickel to barley root elongation.
ZHU Guang-yun1,2, JIANG Bao2, LI Ju-mei2, LI He-lian1, MA Yi-bing3*
(1.School of Resources and Environment, University of Jinan, Jinan 250022, China;2.Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences, Beijing 100081, China;3.Guangdong Institute of Eco-environmental Science & Technology, Guangzhou 510650, China)., 2018,38(8):3143~3150
After water-soluble nickel salt (NiCl2) was spiked to 11representative Chinese soil samples, the spiked soil samples were incubated and treated with or without artificial rainwater leaching in order to simulate field conditions. The toxicity of these soil samples to barley root elongation was studied by a bioassay method, and the extractability of the added Ni in the soils was evaluated using single or sequential three Mehlich-3extractions. The results showed that the extractability of Ni added to soil was affected by soil pH, and Mehlich-3extractable Ni is as a function of total added Ni in soils and soil pH significantly. The phytotoxicity thresholds based on Mehlich-3extractable Ni were significantly affected by soil properties. In other words, the effective concentration causing 50% inhibition based on Mehlich-3extractable Ni varied with338-fold difference among soils. Regression analysis indicated that the soil citrate dithionate extractable Fe, Al and Mn, and clay content in soils were the most important factors to affect the phytotoxicity based on single Mehlich-3extractable Ni, and that soil pH and organic content were the most important factors to affect the phytotoxicity based on sequential three Mehlich-3extractable Ni. The influence of soil properties on the phytotoxicity based on Mehlich-3extractable Ni was associated with the number of extraction times. Finally, the predictive models for phytotoxicity thresholds based on Mehlich-3extractable Ni to barley root elongation were developed. The results indicated that the extractable Ni in soil can be used as criteria in order to improve the accuracy and scientificity of Ni ecological risk assessment in soil.
nickel;Mehlich-3;extractable;soil;bioavailability
X171.5
A
1000-6923(2018)08-3143-08
朱廣云(1992-),女,山東臨沂人,濟南大學碩士研究生,主要從事土壤修復技術方面的研究.發表論文3篇.
2017-12-19
廣東省科學院引進高層次領軍人才專項資金項目(2016GDASRC-0210)和國家重點研發計劃《農田系統重金屬遷移轉化和安全閾值研究》項目(2016YFD0800400)
* 責任作者, 研究員, mayibing@caas.ac.cn

