腹腔鏡下直腸低位前切除經肛門取標本手術八例
史云天 胡清林
腹腔鏡應用于直腸癌的手術治療經20多年的發展已非常成熟,因其具有創傷小、對機體免疫功能影響小、并發癥少、恢復快、住院時間短、痛苦輕的優勢而普遍應用于臨床。但是傳統的腹腔鏡下直腸切除需要在腹部切開一條5 cm左右的輔助切口用于標本取出,再置入吻合器抵釘座。從而增加了切口相關并發癥,比如術后切口疼痛、切口感染、切口疝等。為了減少腹壁切口的創傷,外科醫生追求更高的“無疤手術”境界,提出經自然腔道內鏡手術(natural orif i ce transluminal extraction surgery,NOTES)的概念[1]。它主要指利用內鏡經口、陰道、肛門、尿道等自然腔道進入體內,在胃、子宮、結直腸、膀胱等器官處人為切開一小口進入胸腹腔并進行相應操作,以體內器官小切口代替了體表切口。但是NOTES手術操作復雜,在一些手術切除方面可行性較差,從而限制了其發展。此時,NOTES與腹腔鏡相結合的經自然腔道取標本手術(natural orifice specimen extraction surgery,NOSES)應運而生[2]。NOSES結合了腹腔鏡良好的操作性和可行性優勢以及NOTES手術的“無疤”理念,將切除標本經陰道、肛門取出,避免了腹部小切口。
本研究回顧2015年4月至2017年3月成都醫學院第一附屬醫院胃腸外科開展的腹腔鏡下直腸低位前切除經肛門取標本手術8例患者的臨床和病理資料,探討腹腔鏡下直腸低位前切除經肛門取標本手術的安全性和可行性。
資料和方法
一、一般情況
8例患者中男性6例,女性2例;平均年齡(66.9±11.7)歲(46~83歲),BMI平均為(22.2±4.3)Kg/m2(17.3~30.9 Kg/m2)。2例患者合并高血壓,1例合并2型糖尿病,1例合并慢性阻塞性肺疾病。術前均行電子纖維腸鏡并取活組織病檢確診為直腸癌,術前檢查無遠處轉移,無手術禁忌證。患者及家屬均同意手術,見表1。
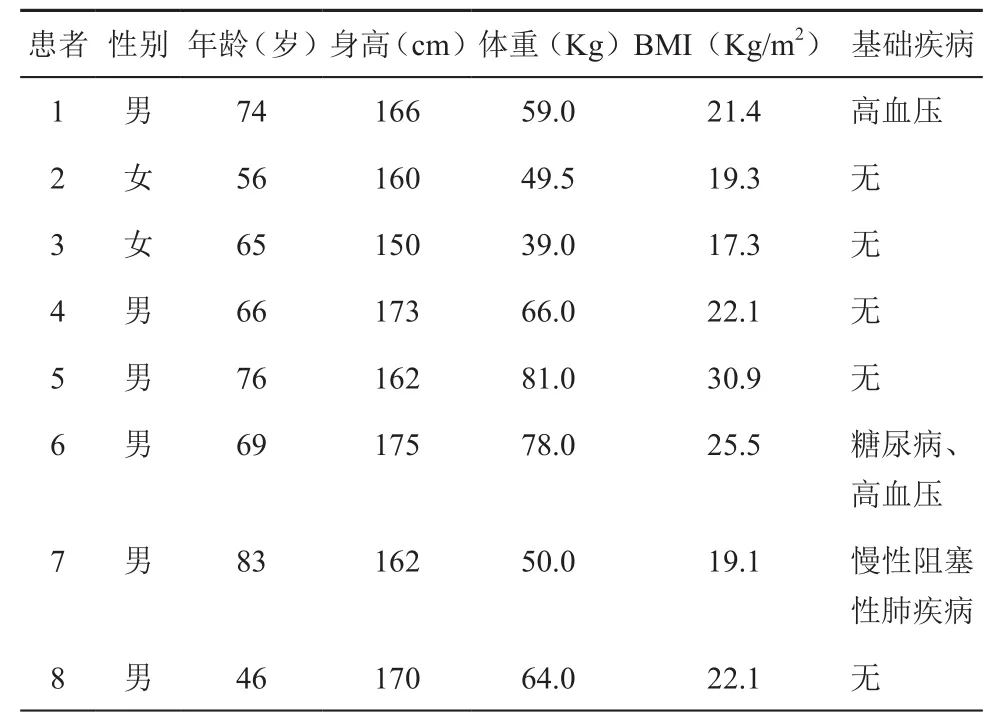
表1 患者的基本信息
二、圍術期管理
患者于術前一天口服2 000 ml腸內營養液,術前一天20點飲500 ml 10% GS(1例合并糖尿病患者飲溫開水);術前一天14點口服磷酸鈉鹽口服溶液清潔腸道;手術開始前常規備皮,于麻醉后導尿。術后前三天應用抗生素預防感染;術后根據患者情況早期進食、早期活動。8例患者均未留置胃管,腹腔引流管和尿管于術后第三天拔出,其中一例患者因術后吻合口漏,腹腔引流管放置至術后2周;術后控制患者液體總入量<35 ml/kg?d,根據患者血壓、心率進行目標導向液體治療。
三、手術過程
在腹腔鏡下完成結直腸游離以及淋巴結清掃。(1)從肛門置入31號吻合器抵釘座于預定切除線之上,用一次性腹腔鏡切割閉合器于距離腫瘤上緣10 cm處切斷腸管并封閉;(2)用手指逐漸擴展肛門括約肌,并用大量碘伏水沖洗腸管腔,將卵圓鉗從肛門進入,鉗夾直腸上段殘端將遠端直腸由肛門反拖出體外;(3)在直視下用直線切割閉合器于腫瘤下緣切除標本,遠端殘余腸管復位,再次用碘伏水沖洗殘余腸管;(4)用超聲刀將乙狀結腸末端切開一小口,將預先放置入腸管的31號吻合器抵釘座在腔鏡系統下由乙狀結腸遠端拉出;(5)從肛門置入31吻合器槍身,與吻合器抵釘座對接,完成乙狀結腸——直腸端端吻合;(6)檢查吻合口滿意后用滅菌注射用水沖洗盆底;(7)檢查無出血,置多孔橡膠引流管于盆底引流,并自右下腹穿刺孔引出固定;(8)檢查無活動性出血后解除氣腹并關閉腹壁戳孔完成手術。
四、隨訪情況
術后前2年,每3個月復查一次,2年后每半年一次,隨訪內容包括病史、體檢、CEA、CA19-9監測;胸腹部CT每年1次,術后1年行電子纖維腸鏡。隨訪時間為3~26個月。8例患者術后3個月隨訪均采用Wexner incontinence score評估肛門功能。
五、統計學分析
應用SPSS22.0統計軟件分析,計量資料以均數±標準差(范圍)表示。
結 果
8例患者均未行預防性造口,手術平均用時(247.5±66.3)min(150~320 min),平均出血(22.5±3.8)ml(20~30 ml);術后首次排氣時間平均為(56.6±11.7)h(36~76 h),術后首次進流食時間平均為(36.6±7.6)h(28~48 h);8例標本中,肉眼下腫瘤直徑最大為4 cm,最小為2 cm;6例患者腫瘤距齒狀線的距離≤5 cm,2例>5 cm,但小于10 cm;腫瘤病理報告顯示4例為浸潤型,3例為隆起型,1例為潰瘍型,平均清掃淋巴結總數14.3±2.2個(12~18個),2例患者有淋巴結轉移,術后病理分期:3例為T1N0M0,1例為T2N0M0,1例為 T2N1M0,2例為 T4aN0M0,1例為T4aN1M0,8例患者均無神經、血管侵犯;其中4例患者術后4周開始行化療,方案為mFOLFOX6。其中一例患者術后5天出現吻合口漏,通過腹腔引流管引流、加強腸外營養支持、抗感染等保守治療痊愈,于術后24天出院,其余患者均順利出院,術后平均住院時間為15.5±5.1 d(9~24 d)。8例患者術后3個月隨訪均采用Wexner incontinence score評估肛門功能,其中2例患者評分為1分,其余評分為0。8例患者CEA、CA19-9均在正常范圍之內,胸腹部CT及腸鏡復查未見腫瘤復發和轉移,見表2和表3。
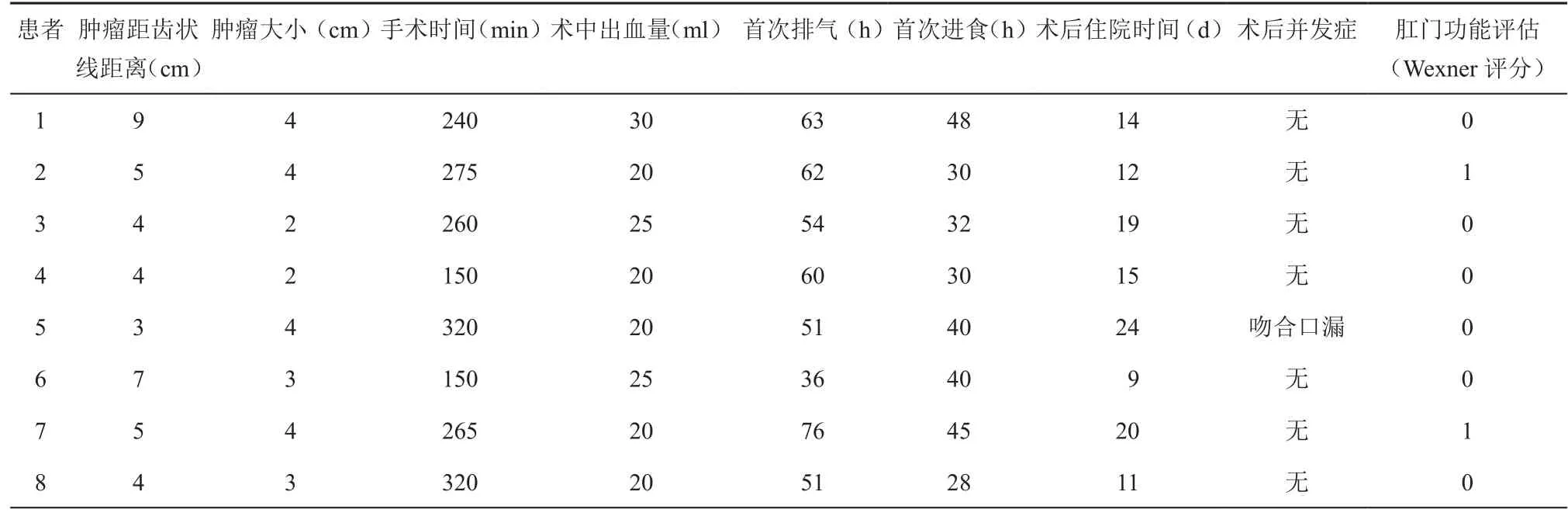
表2 術中及術后情況
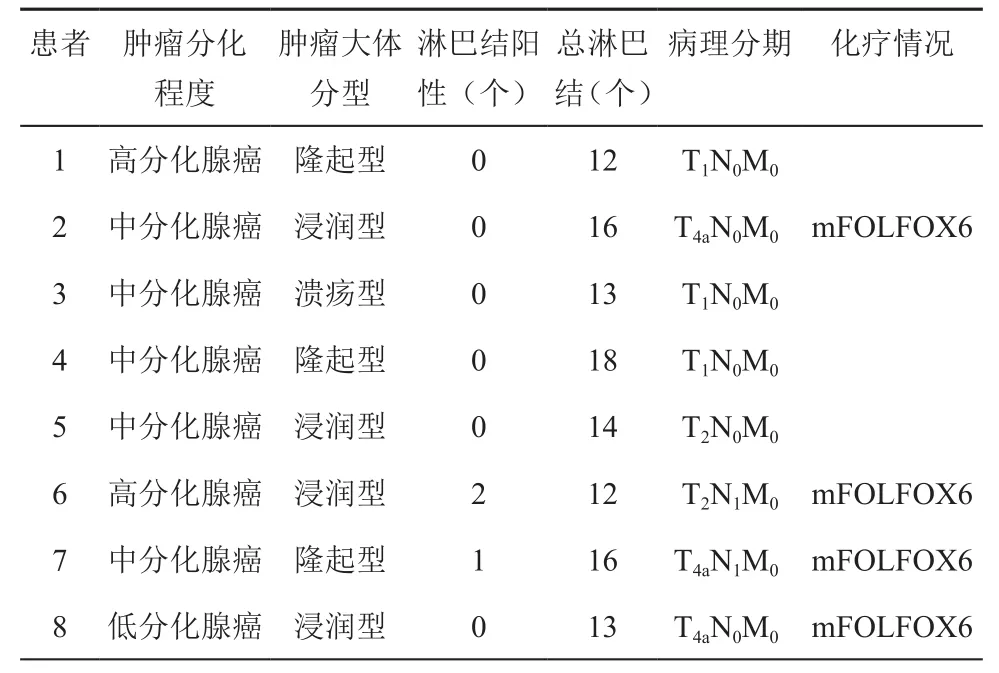
表3 腫瘤術后病理信息
討 論
腹腔鏡下直腸切除NOSES方式有很多種,主要是經肛門和經陰道取出標本。NOSES專家共識[3]統一了十種不同的手術方式,并將其統一命名,使得NOSES手術的開展更加規范。十種不同的手術方式都需要按照TME的原則充分進行直腸系膜游離,主要區別在于吻合器抵釘座的置入方式、標本切除的方式和取標本的途徑不同。為了降低腫瘤細胞脫落、種植、局部復發風險,術前應充分評估腫瘤大小,選取合適的手術方式,在操作過程中應動作輕柔,避免擠壓。由于陰道組織延展性強,愈合較快,腫瘤較大且經肛門取出有困難的患者可選擇經陰道取出標本。另外,對于直腸腫瘤侵及子宮或者卵巢需要一并切除時,也可選擇此方式。Jr等[4]報道了26例經陰道取標本手術的經驗:道格拉斯窩的狹窄解剖部位使手術操作變得更加困難,手術醫師很難準確地從陰道切口將標本鉗夾并拉出體外,從而容易造成乙狀結腸等鄰近器官的副損傷,帶來的后果即是結腸造口。經陰道取標本額外增加健康器官的損傷,加之目前也沒有充足的循證醫學證據證實陰道切口是否影響女性生育能力,因此不建議對有生育要求的女性開展經陰道取標本手術。由于傳統觀念以及倫理學的限制,部分女性患者難以接受經陰道取出標本。所以,經肛門取標本手術仍然作為NOSES手術的首選。
吻合器抵釘座從肛門置入直腸至預定切除線之上必然經過腫瘤,這無疑違反了“無瘤”原則,增加了腫瘤種植轉移的風險。另外,在腹腔內打開腸管,顯露出吻合器抵釘座,完成消化道重建,這一步驟也有違反“無菌”原則之嫌。目前,有報道[5]用不同方法來防止以上風險:(1)直視下從肛門噴灑醫用膠,在腫瘤表面形成一道人為屏障后,再置入吻合器抵釘座;(2)用塑料保護套將吻合器抵釘座送入至預定位置,避免吻合器抵釘座與腫瘤直接接觸;(3)術前避免清潔灌腸,口服瀉劑充分排空腸道,術中用碘伏水沖洗腸管;術中合理利用吸引器,用碘伏紗條將腹腔內可疑污染區域蘸凈、沖洗;(4)術后常規預防應用抗生素。新加坡醫師[6]用標本取物袋取出標本,在腹腔沖洗液中未發現惡性腫瘤脫落細胞,細菌學培養結果顯示20%為陽性,但是所有患者均未出現細菌感染帶來的并發癥。證明腹腔細菌污染是潛在的,但其帶來的后果是可控的。眾多報道[7-8]較一致的觀點是利用不同的取物裝置取出標本,避免標本與周圍組織直接接觸可有效防止致病菌感染和腫瘤細胞脫落種植。比如:蔡氏套管器[9],塑料標本取物袋等。
經肛門外翻切除并取出標本有損傷肛門括約肌的風險,影響肛門功能,對患者術后生活質量造成嚴重影響,如何保護患者肛門功能成為結直腸外科醫師不得不考慮的課題。本研究中8例患者術后肛門功能評分均正常。8例患者術前均常規行直腸指檢,充分評估腫瘤大小、部位以及浸潤情況;術中充分擴展肛門括約肌,從一根手指逐漸擴肛至四指,操作過程應輕柔、緩慢;術后指導患者收縮鍛煉肛門括約肌,這些都是保護肛門括約肌功能的有效措施。
加速康復外科(enhanced recovery after surgery,ERAS)越來越受到外科醫師的重視,通過一系列優化的圍術期管理措施減輕患者應激,降低患者術后并發癥,促進患者快速康復[10]。8例患者圍術期按照ERAS的理念管理,避免插胃管、清潔灌腸等措施,鼓勵患者早期活動、早期進食,減輕了患者的應激反應。張煥標等[11]將90例直腸癌患者隨機分為NOSES+ERAS組、腹腔鏡+ERAS組和傳統腹腔鏡組,結果顯示NOSES+ERAS組疼痛程度明顯低于其他兩組,術后首次排氣、排便時間、術后住院時間、平均住院費用均低于其他兩組。ERAS理念推薦微創手術,與NOSES的概念不謀而合,兩者有機結合更有利于提高手術舒適度,加快術后康復。國外有隨機對照試驗[12]顯示直腸癌行NOSES手術組患者術后止痛劑的應用次數少于傳統腹腔鏡手術組。NOSES手術由于腹壁創傷小,患者疼痛明顯減輕,也為患者早期下床活動提供有利條件,促進患者術后胃腸道功能恢復,并且減少因長期臥床帶來的相關并發癥發生率。同時也使患者的心理創傷進一步降低。
目前NOSES尚無明確統一的手術適應證,各個單位根據患者的具體情況選擇不同的手術方式,其遠期并發癥和安全性還需要更多高質量、多中心的隨機對照試驗來證實。評估NOSES手術的適應證主要包括:腫瘤的位置、環周直徑、浸潤深度,以及患者腸系膜的肥厚程度等。Hisada等[13]提出經肛門取標本的直腸癌手術適應證:1.腫瘤主要位于乙狀結腸末段至直腸上段;2.CT評估腫瘤直徑小于5 cm,并且無漿膜暴露;3.術前評估無淋巴結轉移;4.無肥厚的直腸系膜,BMI≤35 Kg/m2。國內王錫山[14]認為腫瘤直徑大于5 cm、BMI>35 Kg/m2、腫瘤浸出漿膜層的直腸癌患者,應該作為NOSES手術的禁忌證。
NOSES手術作為繼腹腔鏡手術之后的又一次外科領域革命,目前正處于起步階段。它不可否認的正成為一種潮流,越來越受到外科醫師和結直腸腫瘤患者的青睞,同時它也為微創外科的發展指明了方向。在開展NOSES手術的過程中要充分評估,嚴格掌握手術指征,并不斷進行更多高質量的隨機對照試驗,為NOSES手術的遠期療效提供循證醫學證據。NOSES手術是NOTES手術的過渡階段,人們追求的微創外科最高境界——“無疤”手術終將實現。

