經自然腔道取出標本的全腹腔鏡遠端胃癌根治術(Uncut Roux-en-Y吻合)七例報告
劉金超 于剛 榮震
隨著腹腔鏡技術的發展和微創外科理念的完善,腹腔鏡已經作為一種常規的手術方式用于早期胃癌的外科治療,并且因其具有良好的預后效果和顯著的優勢,得到了廣泛的認可和全面的推廣[1],相應的腹腔鏡胃癌操作指南(2016版)得到制定及更新[2]。與此同時,在外科醫生不斷地探索中,一系列全新的手術方式應運而生。經自然腔道取標本手術(natural orif i ce specimen extraction surgery,NOSES)是將腹腔鏡技術與經自然腔道內鏡手術(natural orifice transluminal endoscopic surgery,NOTES)概念相結合的一種手術[3]。除了取標本途徑和消化道重建方式與傳統腹腔鏡手術有所區別之外,其他手術步驟,包括胃腸道切除、淋巴結的清掃范圍、手術的游離層次等,均與傳統腹腔鏡手術一致。NOSES手術多應用于結直腸,劉正等[4]報道應用NOSES技術完成腹部無切口經直腸肛門拖出標本的腹腔鏡下直腸癌根治術,效果良好。在胃腫瘤中未見相關報道。本科室于近期完成了7例腹部無輔助切口經陰道或直腸取出標本的腹腔鏡下胃癌根治術,現報告如下。
資料與方法
一、一般資料
對2017年01月至2017年05月淄博市臨淄區人民醫院共7例胃竇癌患者施行全腹腔鏡下遠端胃癌根治術(非離斷式Roux-en-Y吻合);其中5例女性患者經陰道取出切除標本,2例男性病例經直腸前壁切開,經肛取出標本。患者術前均行胃鏡、腹部CT等檢查診斷為胃竇癌。中位年齡68(38~82)歲。體重指數(BMI)(25.1±2.3)Kg/m2。術前常規通過胃鏡判斷腫瘤上緣距離賁門距離,病變范圍,并常規通過CT對胃癌進行術前分期,術前評估均無遠處轉移,患者及家屬均知情并同意手術方案。2例男性患者術前口服聚乙二醇充分行腸道準備。
二、手術方法
所有病例均由同一組手術醫師施行手術,患者的體位、手術室設備布置均與傳統腹腔鏡胃癌手術相同,患者取頭高足低,分腿仰臥位。術者站位:淋巴結清掃時主刀位于患者的左側,第一助手站立于患者右側,消化道重建時主刀與第一助手位置互換;扶鏡助手站在患者兩腿之間。trocar的布置采用五孔法。臍孔下10 mm戳孔放置鏡頭,左側腋前線肋緣下2 cm置入12 mm trocar為淋巴結清掃主操作孔A,左側鎖骨中線平臍上2 cm、右側腋前線肋緣下置入5 mm trocar為輔助操作孔,右側鎖骨中線平臍置入12 mm trocar為消化道重建主操作孔B。
根據術前分期完成遠端胃癌D2淋巴結清掃,經主操作孔A,以腔內直線切割閉合器于幽門下方2 cm切斷十二指腸(圖1A),于腫瘤近端4~5 cm切斷胃(圖1B)。距Treitz韌帶25 cm空腸對系膜緣和殘胃大彎遠端各自戳孔后,應用腔內直線切割吻合器完成結腸前殘胃——空腸側側吻合(圖1C),使用4-0可吸收縫線間斷縫合共同開口(圖1D);然后距此吻合口10 cm的輸入袢與距此30 cm的輸出袢空腸再次以直線切割吻合器行側側吻合,共同開口仍以4-0的可吸收縫線間斷縫合關閉(圖1E)。輸入襻阻斷位置位于胃腸吻合口與空腸空腸吻合口之間的近端空腸,距胃腸吻合口約3 cm處,使用7號絲線結扎完成空腸阻斷。整個Uncut Roux-en-Y吻合完成情況如圖(1F)所示。
完成上述操作后,改變患者體位為單腿抬高,暴露并消毒會陰部,直腸及陰道腔碘伏紗布條充分消毒。5例女性病例經陰道后穹窿作3 cm小切口(圖2A),自該切口置入切口保護套取出標本。2例男性病例經直腸上段前壁縱行切開約4 cm,同樣方式放置切口保護套完成標本取出(圖2B~2D);術后腹部情況見圖2E,消化道造影情況見圖2F。
三、觀察指標
觀察并記錄術中及術后情況,包括手術操作時間、術中出血量、術后排氣時間和住院天數等,術后第5天左右行上消化道造影。術后3個月隨訪,復查胃鏡及胃腸道造影,詳細記錄相關并發癥發生情況。
結 果
7例病例均在全腹腔鏡下成功完成,經自然腔道(陰道或直腸)取標本,無中轉開腹,無術中并發癥,無手術相關死亡。手術中位時間為280(260~320)min,其中消化道重建時間為45(35~55)min,術中中位失血為 90(30~120)ml。術后中位排氣時間2(1~3)d,手術后中位住院天數8(7~13)d。無胃排空障礙、吻合口漏、Roux滯留綜合征(Roux-Y stasis syndrome after gastrectomy,RSS),無直腸腸瘺、陰道后穹窿疝等相關并發癥發生。
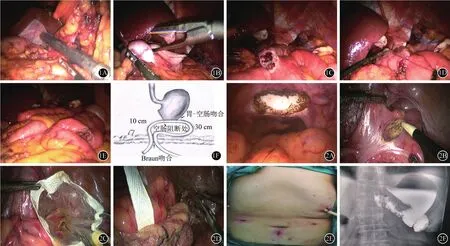
圖1 非離斷式Roux-en-Y 吻合示意圖 1A幽門下方2 cm切斷十二指腸;1B于腫瘤近端4~5 cm切斷胃;1C殘胃-空腸側側吻合;1D使用4-0可吸收縫線間斷縫合共同開口;1E可吸收縫線間斷縫合關閉(圖1e);1F整個Uncut Roux-en-Y吻合完成情況 圖2 標本取出示意圖及術后情況:2A經陰道后穹窿作3 cm小切口;2B直腸上段縱行切開圖;2C置入切口保護套;2D經保護套標本取出;2E術后腹部情況;2F術后消化道造影情況
術后病理學檢查結果顯示:7例均為中分化腺癌。其中IA 期4例,IB期3例。所有標本均為R0切除,鏡下切緣均陰性。中位淋巴結清掃數36 (24~45)枚。4例患者術后達3個月隨訪,復查胃鏡無堿性反流性胃炎,胃腸道造影無空腸阻斷處再通;2例男性患者術后隨訪無直腸狹窄、腸黏膜脫垂,排便習慣改變等異常。
討 論
胃癌是我國常見的消化道腫瘤之一,腹腔鏡技術治療早期胃癌已被證實是一種安全、有效的微創手術方式。腹腔鏡輔助遠端胃癌根治術技術上已經成熟,全腹腔鏡下遠端胃癌根治方興未艾[1],完全腹腔鏡遠端胃癌根治術后消化道的重建包括Billroth-Ⅰ式三角吻合、Billroth-Ⅱ式吻合和Roux-en-Y吻合。Billroth-Ⅰ式操作簡單,最符合生理解剖結構,但全腹腔鏡下的三角吻合法僅適用于早期胃下部癌且距離幽門>2 cm的患者[2];Billroth-Ⅱ式操作亦簡便,但術后易出現反流性胃炎,即使在Billroth-Ⅱ式吻合基礎上加做Braun吻合,亦難避免部分患者膽胰液反流至胃腸吻合口。Roux-en-Y方法的優勢在于:吻合口無張力、有效避免膽汁反流,殘胃炎、吻合口漏、狹窄發生率低,但術后Roux滯留綜合征發生率高達30%,目前多認為滯留綜合征的發病機制與離斷空腸造成的神經沖動下傳障礙有關[5-6]。2000年,Mon等[7]率先開展了一項回顧性隊列研究,對比了胃大部切除術后Uncut Roux-en-Y吻合與標準Roux-en-Y吻合的早期預后,結果表明Uncut Roux-en-Y吻合術后早期并發癥發生率更低。此后大量臨床研究證實,Uncut Roux-en-Y吻合可以借助較為寬大的Braun吻合口及輸入襻空腸管的束扎,將十二指腸液完全轉流到遠端輸出襻中,既避免了吻合口狹窄和輸入襻梗阻,又保證了膽汁胰液不向殘胃反流。與BillrothⅠ式、BillrothⅡ式、標準Roux-en-Y吻合相比,Uncut Roux-en-Y吻合在術后反流性胃炎、吻合口潰瘍發生率方面均具有明顯優勢,尤其可有效減少RSS的發生。
Uncut Roux-en-Y吻合技術方面,開腹胃癌根治術中主要采用直視下管狀吻合器消化道重建,絲線或U形釘阻斷輸入襻。腹腔鏡手術中主要采用小切口輔助消化道重建或完全腹腔鏡下消化道重建。隨著腔鏡下器械的不斷優化,2005年,日本學者Uyama等[8]首次報道了借助無刀直線切割吻合器完成的腹腔鏡輔助下遠端胃癌根治術Uncut Roux-en-Y吻合,改善了傳統Roux-en-Y吻合RSS的發生率,且Uncut Roux-en-Y吻合因其無需切斷系膜及關閉系膜裂孔,手術操作簡化,手術時間和術中出血量明顯減少。楊力等[5]在國內率先開展此項技術并加以改良,完成的18例腹腔鏡下Uncut Roux-en-Y吻合,均未出現吻合口漏、吻合口狹窄和RSS,近年來國內多中心開展此手術[9-10],提示腹腔鏡下Uncut Roux-en-Y吻合在遠端胃癌根治術中安全可行,創傷更小、恢復更快。
本組完全腹腔鏡下的消化道重建時間為45(35~55)min,與已有文獻報道中小切口輔助完成的Billroth-Ⅱ加Braun吻合口相比,重建時間亦無延長。筆者體會,經自然腔道取標本的全腹腔鏡胃空腸Uncut Roux-en-Y吻合操作簡便,容易實施,且具有下列優點:從患者的角度來說,避免了腹壁的輔助切口,造成體神經的損傷,最大程度地保留了腹壁的功能,減少術后疼痛,便于患者早期離床活動,縮短康復時間,降低切口的感染和腫瘤種植發生的可能,并且具備了一定的美容效果。從外科醫生角度來講,全腔鏡下Uncut Roux-en-Y吻合胃癌根治術具有三大優勢:(1)腹腔鏡下完成消化道重建,操作視野更加廣闊,更容易判斷腸管遠近端方向,可有效避免小切口輔助下吻合后腸管扭轉、吻合口張力過大等失誤,在手術的安全性方面優勢明顯;(2)避免了膽汁反流,在降低術后反流性胃炎、吻合口潰瘍發生率方面均具有明顯優勢;(3)有效解決了困擾臨床的Roux-en-Y滯留綜合征難題。
NOSES為類經自然腔道手術(like-NOTES)的一種,有兩大優勢:(1)消除了腹部的輔助切口,美容效果好,術后疼痛輕,恢復快。(2)對患者的生理、心理影響小,更符合生物-心理-社會醫學模式的理念。陰道作為女性患者特有的具有良好延展性的自然腔道,非常適用于手術切除標本取出,腹腔鏡下很容易就可以暴露及切開陰道后穹窿,且該處組織愈合能力好,縫合關閉也較容易,并發癥少。切開直腸經肛取手術標本,可能會有增加直腸及肛門相關并發癥的風險,我們的體會是只要在術前充分的腸道準備,術中縫合確切的情況下完全不必擔心直腸壁的愈合能力;2例男性病例隨訪也無直腸脫垂、排便習慣改變等情況出現。術中注意碘伏紗布條消毒,注意用切口保護套保護下實施標本的拖出,完全可以避免出現腹腔感染、腸瘺和腫瘤細胞的局部播散。對于NOSES手術應用于胃癌選擇的適應證,我們的體會是:腫瘤未侵透漿膜層的早期胃癌,取出標本組織橫徑不宜過大,經直腸取出標本的最大橫徑不超過4 cm,經陰道取標本的最大橫徑以不超過5 cm為宜。
在微創外科和功能外科時代,外科手術的原則是在確保安全、準確和徹底清除病變組織的前提下,通過優化手術入路、改進手術操作以及應用先進器械設備等措施,更注重患者的心理、社會、生理和生活質量的改善與康復,最大程度地減輕病人的痛苦[11]。NOSES的全腹腔鏡下胃癌手術雖無法達到腹壁完全無疤的效果,但由于其盡可能保留正常組織器官的結構與功能,減少手術創傷,使患者在最短的時間恢復正常生活與工作,更符合生物-心理-社會醫學模式的理念,實現了腫瘤根治、功能保護、生活質量的和諧統一。

