免疫磁珠法陰性富集循環腫瘤細胞方法的建立
張 磊, 黃慧玲, 楊 昂, 張 茜, 鄭春紅, 朱玉華, 劉松麟, 李印淑
(亞能生物實驗室,廣東 深圳 518102)
循環腫瘤細胞(circulating tumor cell,CTC)檢測對于腫瘤的早期發現、臨床診斷、病情監測等具有重要意義,但CTC在腫瘤患者外周血中極為稀少,約為1~10個/mL,而正常成人外周血中血細胞數量為109個/mL,白細胞的數量是(4~10)×106個/mL[1-2]。CTC遠低于血液中其他類型的細胞,數量的稀少使得血液CTC檢測極具挑戰性,加上CTC產生的復雜性、異質性,更增加了其檢測的難度[3-4]。因此,如何從數量龐大的背景血液細胞中準確地富集出幾個CTC,是CTC檢測技術需要解決的關鍵問題。本研究利用免疫磁珠和免疫熒光技術,建立一種高效、不依賴腫瘤細胞表面標志物、不依賴于腫瘤細胞大小的CTC陰性富集方法和免疫熒光鑒定方法。
1 材料和方法
1.1 材料和儀器
宮頸癌細胞系SiHa(中國科學院細胞庫),活細胞熒光染料Celltracker CMFDA(美國Thermo Fisher公司)、Hoechst33342[生工生物工程(上海)有限公司],熒光顯微鏡(日本尼康公司)。CTC陰性富集與免疫熒光鑒定試劑由亞能生物技術(深圳)有限公司自主研發,其中試劑A主要包括緩沖液、白細胞去除磁珠;試劑B主要包括細胞固定液、細胞透化液、封閉液、抗體稀釋液、抗體濃縮液Ⅰ(含CK-異硫氰酸熒光素)和Ⅱ(含CD45-藻紅蛋白)、含DAPI抗淬滅封片劑等。
1.2 方法
1.2.1 細胞計數與摻入 將SiHa細胞加入Celltracker CMFDA染色,用血球計數板精確計數至固定體積內含有6、9、15、30、90、300個不同數量梯度的細胞,并摻入3 mL全血中,每組設6個組內平行。
1.2.2 CTC陰性富集及免疫熒光鑒定 按照CTC陰性富集與免疫熒光鑒定試劑盒說明書進行操作。
1.2.3 細胞回收率統計 制片后2 d內直接觀察計數,7 d后進行熒光染色,CTC表示為細胞核型完整,CK+CD45-Hoechst33342+。CTC富集回收率=染色CTC數量/摻入CTC總數×100%。
2 結果
2.1 CTC陰性富集回收率
在3 mL健康人全血中分別摻入6、9、15、30、90、300個Celltracker CMFDA標記的SiHa細胞,然后進行免疫磁珠陰性富集并進行Celltracker+Hoechst33342+染色、計數,設6批獨立試驗。富集效率為58.33%~87.22%,平均為76.70%±14.79%,見表1。以3 mL血液中摻入的CTC數量為X,以CTC富集回收數量為Y,線性方程為Y=0.746 4X(r2=0.998 7),說明線性關系良好,見圖1。
2.2 CTC檢測效率
免疫熒光鑒定后的CTC呈現典型的CK+CD45- Hoechst33342+形態特征見圖2。
因Celltracker熒光減弱、淬滅等原因,免疫熒光后CTC平均回收率比免疫熒光前高2.1%~12.6%,7 d后對免疫熒光試劑的影響減到最小,因此于7 d后進行熒光染色。結果顯示,CTC回收率為62.50%~95.00%,平均回收率為83.05%,見表2。富集效率和染色回收效率結果對比顯示,免疫熒光操作不會減少富集后的CTC數量。
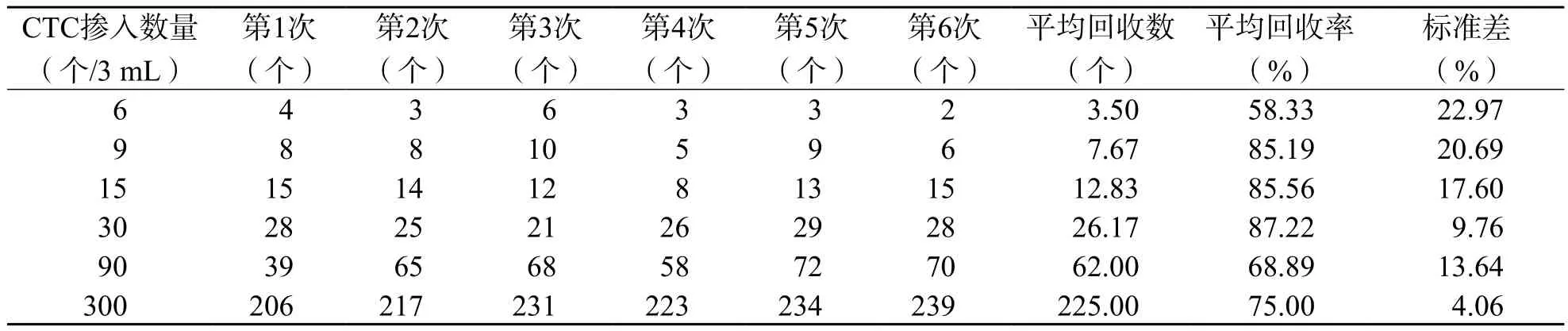
表1 CTC富集數及富集效率

圖1 CTC富集平均回收數量線性關系
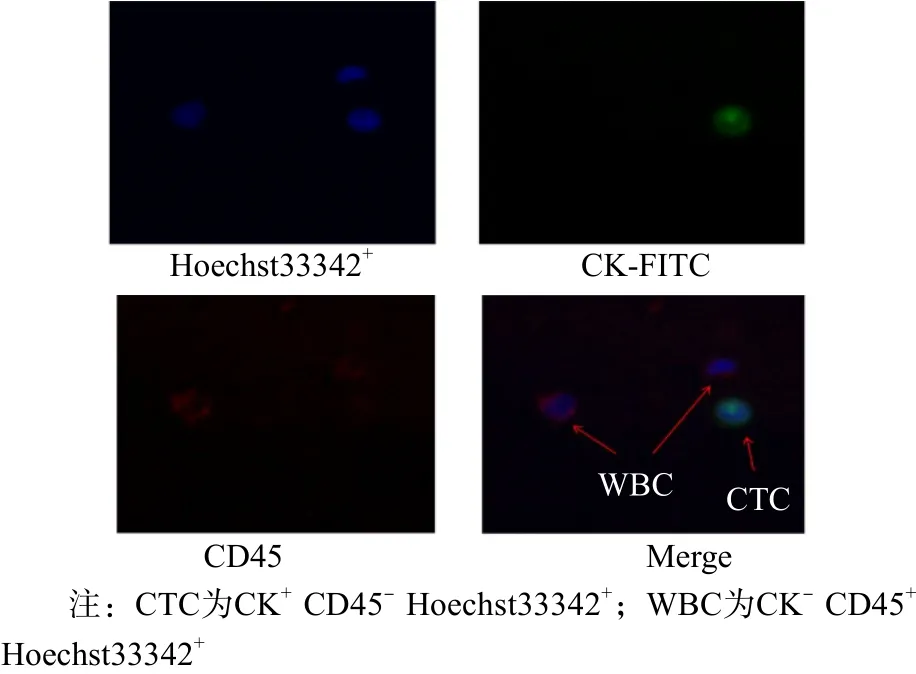
圖2 CTC免疫熒光鑒定
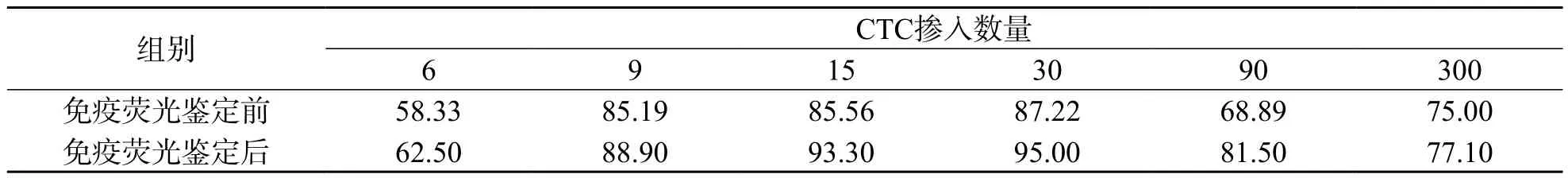
表2 摻入不同數量CTC免疫熒光鑒定前后平均回收率比較 (%)
3 討論
目前,以上皮細胞黏附分子為腫瘤標志物的CTC分離方法存在漏檢丟失上皮性抗原CTC的可能性[3-4]。以美國強生公司Cellsearch為代表的第1代CTC檢測技術平臺早在2004年就通過美國食品和藥品管理局認證,然而由于Cellsearch技術平臺捕獲CTC數量少、敏感性差、系統封閉,只能用于晚期惡性腫瘤患者,不適用于早、中期腫瘤及治療后患者,且臨床只用于轉移性乳腺癌、結直腸癌、前列腺癌,運用范圍窄[5]。因此,開發不依賴于CTC表面標記物、敏感性高、系統開放性強的陰性富集方法對于CTC檢測技術具有重要意義。
本研究建立的CTC陰性富集法具有免疫熒光染色效果佳、無非特異性染色等特點,能有效富集血液中極少數量的CTC(3 mL血液中摻入6個細胞,平均能回收3.5個)。這預示著在外周血中含量較低的CTC可被檢測出來,更適用于早期診斷、療效監測及預后判斷。且該方法不依賴于CTC表面標志物,可運用于不同類型的腫瘤患者,應用范圍更廣,但仍需進行大量樣本的臨床樣本研究證實,并且手工操作流程仍有待優化。

