電離輻射誘導肺上皮細胞發生上皮間質轉化
梁 鑫, 潘秀頡, 李雪萍,3, 孫澤文,4, 楊陟華, 顧永清,5, 朱茂祥,5
電離輻射誘發的放射性肺纖維化(radiation-induced pulmonary fibrosis, RPF)是胸部腫瘤放射治療的常見并發癥,成纖維細胞是肺纖維化中的關鍵效應細胞,有研究[1]顯示受損的肺泡Ⅱ型上皮細胞(alveolar epithelial cells type Ⅱ, AECⅡ)能通過上皮間充質轉化 (epithelial mesenchymal transition, EMT)的方式間接轉化為成纖維細胞。EMT是指完全分化的上皮細胞失去極性、細胞間的黏附等上皮細胞的特征,獲得遷移、分化等間質細胞特征,轉化成完全分化的間質細胞的過程[2]。EMT在胚胎的形成與發育、腫瘤的侵襲與轉移,以及組織愈合和器官纖維化等生理和病理過程中起著重要的作用[3]。然而電離輻射誘導肺上皮細胞發生EMT的機制,及EMT在RPF發生中的作用尚不清楚。該研究首先對小鼠AECⅡ進行了分離、純化及鑒定,確定提純方法后,采用60Coγ射線照射小鼠提取AECⅡ,檢測其EMT發生情況。隨后γ射線照射幾種人源的上皮細胞系并檢測EMT發生情況,從而為進一步研究電離輻射誘導的EMT在RPF發生中的作用及機制奠定基礎。
1 材料與方法
1.1材料
1.1.1實驗動物及細胞 SPF級雄性C57BL/6小鼠,12只,8周齡,購自北京維通利華生物科技有限公司,動物許可證號:SCKK(京)2012-0001,完全隨機分為對照組(0 Gy)和照射組(20 Gy),飼養于軍事科學院軍事醫學研究院輻射醫學研究所實驗動物中心。A549細胞、Beas-2B細胞和BEP-2D細胞均為本實驗室保存。
1.1.2主要試劑 DMEM培養基、胎牛血清(美國Gibico公司);表面活性蛋白C(prosurfactant protein C,SPC)抗體(ab40879)、緊密連接蛋白ZO-1(tight junction protein ZO-1,ZO-1)抗體(ab150266)(美國abcam公司);E-鈣黏蛋白(E-cadherin)抗體(562526)(美國BD Pharmingen公司);N-鈣黏蛋白(N-cadherin)抗體(17-3259,美國Ebioscience公司);PE標記的羊抗兔抗體(GM200G-40C,天津三箭公司)。
1.2方法
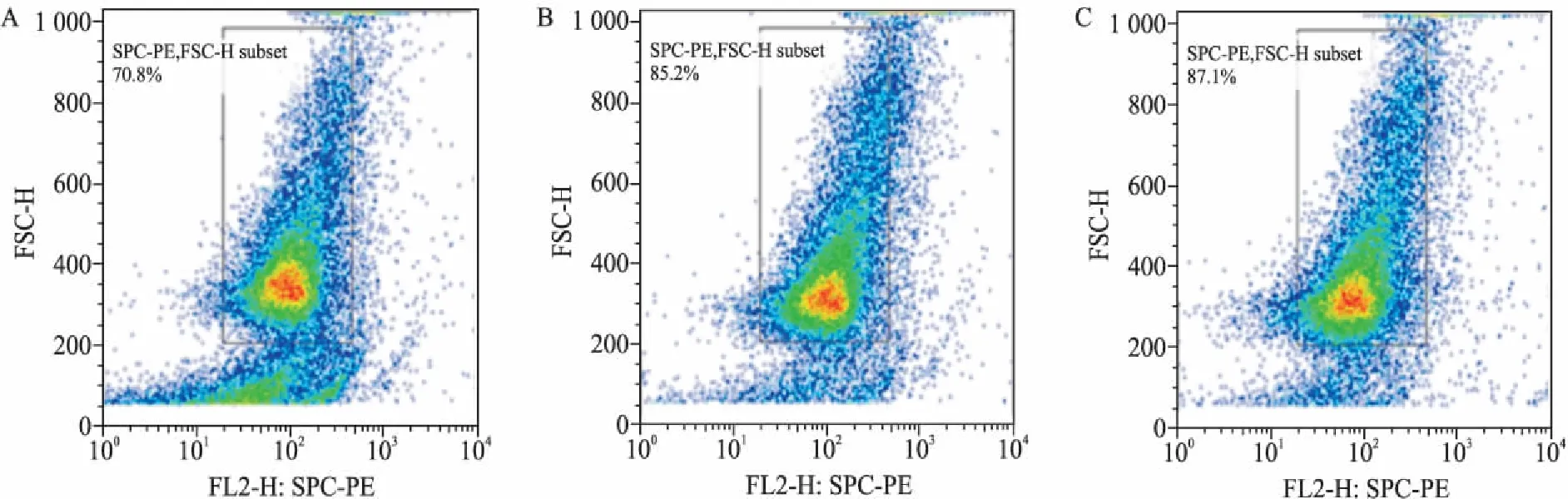
圖1 小鼠AECⅡ的分離與純化
1.2.1小鼠AECⅡ的分離與純化 小鼠經脫頸處死后于75%乙醇中浸泡5 min,在超凈臺中取下完整肺組織,PBS漂洗至上清液清亮;移肺入無菌50 ml離心管,剪成 1 mm3大小,按 2 ml/只小鼠加入 0.1% 的胰酶 37 ℃孵育 10 min,用等量的含10% FBS的DMEM培養液終止消化;4 ℃、1 500 r/min離心5 min,去除上清液后按 2 ml/只小鼠加入0.1% 膠原酶吹打混勻,37 ℃孵育15 min后4 ℃、3 000 r/min,離心5 min,培養液重懸后于200目篩網過濾,4 ℃、1 500 r/min離心5 min,離心重懸后取出一部分細胞待測,之后通過800 r/min離心2次,每次5 min、40 μm篩網過濾等方法對細胞進行純化,離心重懸后各取出一部分細胞用于流式檢測。
1.2.2小鼠ACEⅡ的鑒定 流式細胞術檢測提取的AECⅡ中SPC陽性的比率以確定純度,透射電子顯微鏡觀察細胞結構。
1.2.3輻射誘導小鼠AECⅡ發生EMT的檢測 小鼠用1%的戊巴比妥鈉麻醉(麻醉劑量50 mg/kg)后固定于照射裝置上,10 cm厚鉛磚屏蔽除胸部以外的其他部位,采用60Coγ射線20 Gy單次照射全胸,劑量率215 cGy/min。照射14 d后,取對照、照射小鼠各3只,提取AECⅡ,標記E-cadherin、ZO-1和N-cadherin抗體,流式細胞儀檢測。
1.2.4輻射誘導A549細胞、Beas-2B細胞和BEP-2D細胞發生EMT的檢測 采用60Coγ射線8 Gy照射A549細胞、Beas-2B細胞和BEP-2D細胞,培養48 h后A549細胞用0.25%胰酶消化2 min,BEP-2D細胞用0.25%胰酶在37 ℃孵箱消化5 min,Beas-2B細胞用0.05%胰酶消化30 s,分別加入含10% FBS的DMEM培養液終止消化,4 ℃、1 500 r/min離心5 min,PBS清洗重懸后分別標記E-cadherin、ZO-1和N-cadherin抗體,流式細胞儀檢測。
2 結果
2.1小鼠AECⅡ的分離與純化為了探究電離輻射是否能誘導小鼠AECⅡ發生EMT,首先對小鼠AECⅡ進行了分離,經過胰酶消化、離心等步驟得到AECⅡ,將獲得的AECⅡ標記SPC抗體進行流式檢測,得到SPC陽性表達率為70.8%(圖1A)。隨后經過800 r/min離心和40 μm篩網過濾等步驟對AECⅡ進行純化,流式檢測SPC表達陽性的細胞所占比例逐步增加,分別達到 85.2%和87.1%(圖1B、1C)。提示通過該方法能夠得到純度較高的小鼠AECⅡ。
2.2小鼠AECⅡ的電鏡觀察鑒定為了對小鼠AECⅡ進行進一步的鑒定,將經過純化的AECⅡ培養48 h,之后進行電鏡觀察,電鏡下可觀察到小鼠AECⅡ外側有微絨毛,細胞核明顯,細胞質較多,并能觀察到特征性的板層小體結構(圖2)。
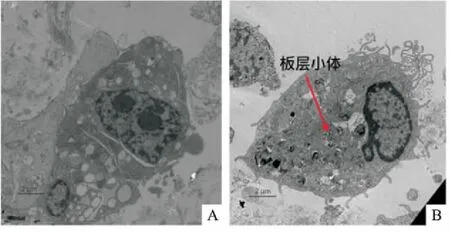
圖2 電鏡觀察小鼠AECⅡ形態 ×3 200
A:小鼠AECⅡ整體形態;B:小鼠AECⅡ特征性板層小體結構
2.3電離輻射對小鼠AECⅡ的影響經過上述方法,能夠得到純度較高的小鼠AECⅡ。為了進一步研究電離輻射是否能使小鼠AECⅡ發生EMT,從對照組小鼠與照射14 d的小鼠的肺組織中提取AECⅡ并進行流式檢測。以上皮標志E-cadherin和ZO-1的表達率為橫坐標,N-cadherin的表達率為縱坐標,以上皮標志和間質標志共同表達于同一細胞,即第一象限(E-cadherin+N-cadherin+的象限和ZO-1+N-cadherin+的象限)表示正在發生EMT的細胞(圖3)。流式細胞儀檢測E-cadherin+N-cadherin+AECⅡ比例及ZO-1+N-cadherin+AECⅡ比例,結果顯示照射后的小鼠AECⅡ中E-cadherin+N-cadherin+AECⅡ比例及ZO-1+N-cadherin+AECⅡ比例明顯升高(P<0.05)(表1),表明正在發生EMT的細胞增多,提示輻射能夠誘導小鼠AECⅡ發生EMT。
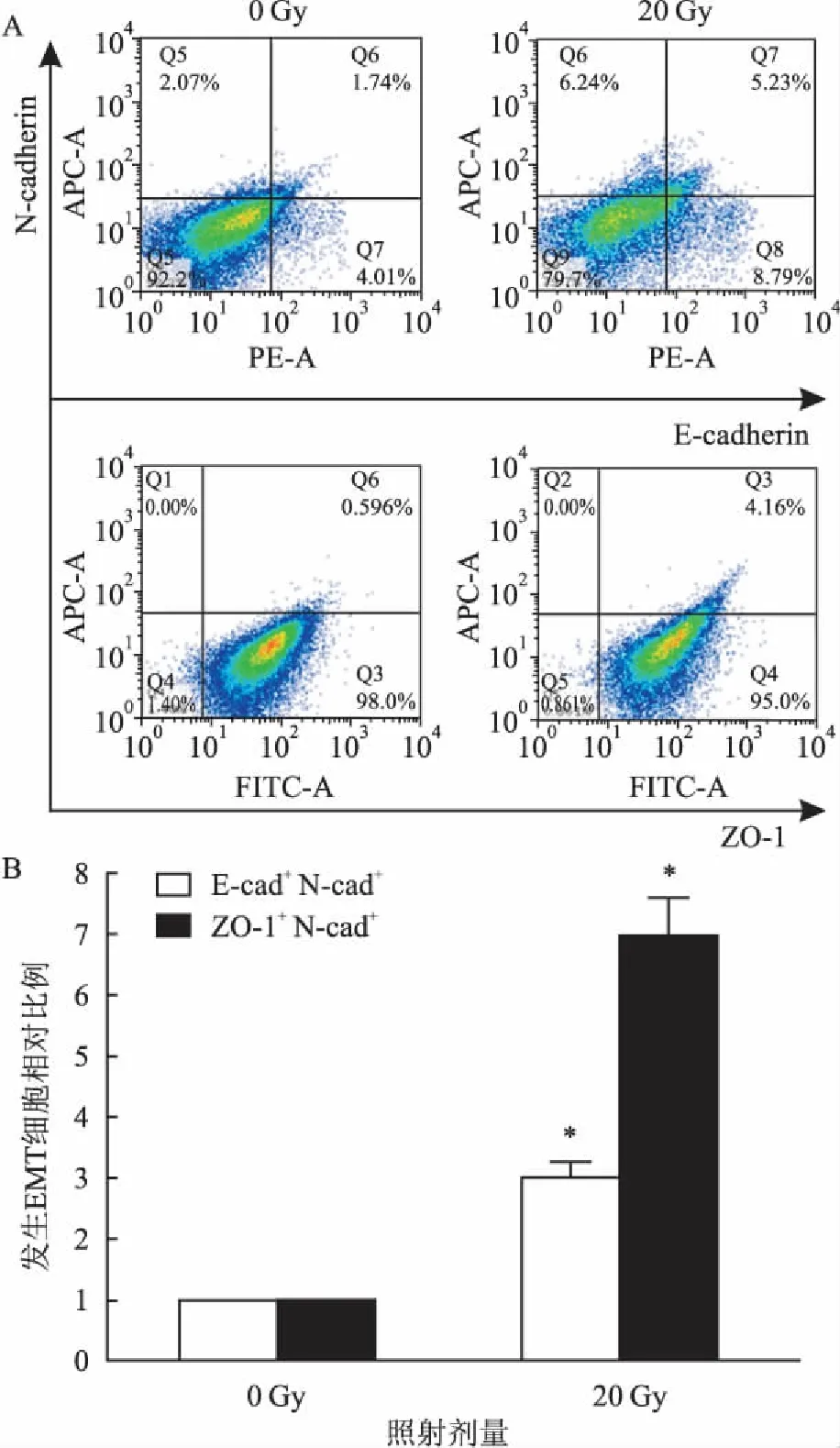
圖3 電離輻射對小鼠AECⅡ形態及上皮、間質標志物的影響
A:流式檢測EMT相關蛋白;B:照射前后發生EMT細胞相對比例(照射20 Gy組正在發生EMT的細胞/0 Gy組正在發生EMT的細胞)柱形圖;與0 Gy組比較:*P<0.05
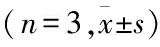
表1 流式細胞術檢測電離輻射對不同細胞發生EMT的影響
2.4電離輻射對人上皮細胞系的影響
2.4.1電離輻射對人肺腺癌細胞系A549細胞的影響 根據上述實驗結果,證實電離輻射能夠誘導小鼠AECⅡ發生EMT,但其對人上皮細胞系的作用尚未證實,因此采用60Coγ射線8 Gy照射人肺腺癌細胞系A549細胞以及人支氣管上皮細胞Beas-2B細胞和BEP-2D細胞,以探究電離輻射是否能夠誘導人上皮細胞系發生EMT。
首先觀察了人肺腺癌細胞系A549細胞,A549細胞照射后繼續培養48 h,于光鏡下觀察,對照組細胞形態呈立方形或小鵝卵石形,具有上皮細胞典型的鋪路石樣特征;照射組與對照組相比細胞間隙增大,極性消失,形態有長梭形改變(圖4A)。流式細胞儀檢測E-cadherin+N-cadherin+細胞比例及ZO-1+N-cadherin+細胞比例。結果顯示照射后E-cadherin+N-cadherin+細胞比例及ZO-1+N-cadherin+細胞比例明顯升高(P<0.05)(圖4B、4C)。表明電離輻射能夠誘導人肺腺癌細胞系A549細胞發生EMT。
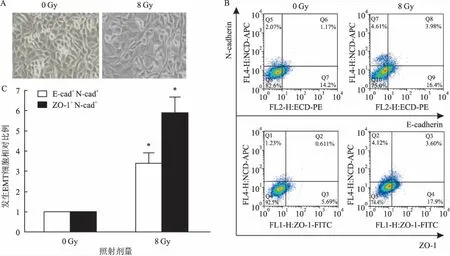
圖4 電離輻射對A549細胞形態及上皮、間質標志物的影響
A:光鏡下檢測A549細胞形態×400;B:流式檢測EMT相關蛋白;C:照射前后發生EMT細胞相對比例柱形圖;與0 Gy組比較:*P<0.05
2.4.2電離輻射對人支氣管上皮細胞的影響 光鏡下觀察Beas-2B細胞和BEP-2D細胞,細胞形態呈立方形鋪路石樣特征;照射48 h后,細胞間隙均增大,形態逐漸向紡錘樣細胞形態轉變(圖5A、5D)。流式細胞儀分別檢測到照射后的兩種細胞E-cadherin+N-cadherin+細胞比例及ZO-1+N-cadherin+細胞比例與對照組相比均有明顯升高(P<0.05)(圖5B、5C、5E、5F)。表明電離輻射能夠誘導人支氣管上皮細胞Beas-2B細胞和BEP-2D細胞發生EMT。
3 討論
肺纖維化是以多種原因引起的上皮細胞受損、修復障礙,從而導致大量細胞因子釋放、細胞外基質沉積、異常間質細胞活化和增生為特征的疾病[4]。大量間質細胞(成纖維細胞、肌成纖維細胞)積聚及增殖是肺纖維化發生的重要原因[5]。肺泡上皮細胞是多種原因導致的肺損傷的主要受損靶細胞,當損傷的肺組織進行正常修復時,殘存的AECⅡ可通過自身增殖或者因具有部分干細胞特性而分化為AECI,或通過上皮間質轉化機制向成纖維細胞特性分化,若其轉化過多的成纖維細胞,則組織病理表現為肺纖維化[6]。
EMT是指具有極性的上皮細胞在某些生理或病理因子的刺激下,經過多重生化改變,最終呈現出間質細胞表型的生物學過程[7]。EMT分為三型,Ⅰ型EMT與胚胎的形成以及器官的發育密切相關,Ⅱ型 EMT與傷口愈合、組織再生和器官纖維化有關,Ⅲ型 EMT與腫瘤的侵襲與轉移相關。本研究重點關注Ⅱ型 EMT即 EMT與器官纖維化的關系。
近年來的研究[8-9]表明小鼠肺纖維化模型中超過30%的成纖維細胞來自于EMT過程,EMT在肺纖維化中扮演著重要的角色。高燁 等[10]的實驗結果表明EMT在百草枯誘導的肺纖維化中起著重要作用。還有研究[11]顯示EMT過程出現在博萊霉素誘導的肺纖維化中。電離輻射誘導的肺損傷和肺纖維化是接受胸部放射治療、骨髓移植或參與核事故的患者常見且嚴重的并發癥[12-14],也是導致這些患者治療后期死亡的主要原因之一。由于RPF的機制尚不清楚,目前還缺乏有效的治療方法。因此,對RPF形成機制的研究尤為重要。然而,盡管EMT與多種因素引起的肺纖維化密切相關,電離輻射誘導EMT發生及其在RPF中的作用卻鮮有報道。同時大部分關于EMT與肺纖維化的研究主要采用A549 細胞和Beas-2B細胞建立細胞模型,基于AECⅡ在參與肺纖維化形成過程中的重要作用,本研究首次將小鼠原代AECⅡ分離、純化并用于電離輻射誘導EMT的研究。EMT發生時,上皮細胞向間充質細胞轉移,失去細胞間E-cadherin和ZO-1的表達,獲得N-cadherin的表達[3,15]。很多情況下,細胞發生不完全的間質化,同一細胞同時表現出上皮和間充質特性[16],因此主要對這部分細胞進行了檢測。檢測的方法主要采用流式細胞術,這種方法能夠高速分析上萬個細胞,并能同時從一個細胞中測得多個參數,能夠高效地對所得數據進行定量分析。本研究結果表明電離輻射確實能夠在多種肺上皮細胞中誘導EMT的發生,使肺上皮細胞向成纖維細胞特性分化,進而增加引起RPF的可能性。同時,以ZO-1+N-cadherin+表示的發生EMT的AECⅡ細胞在電離輻射誘導后較對照組增加了7倍之多,這一比例高于其他幾種細胞系,表明小鼠原代AECⅡ是用于RPF研究的較為理想的細胞。本研究為探討AECⅡ在放射性肺纖維化中的作用提供了新的方法,并為進一步研究EMT在放射性肺纖維化中的調控機制以及尋找RPF的有效的治療靶點提供了新的思路。
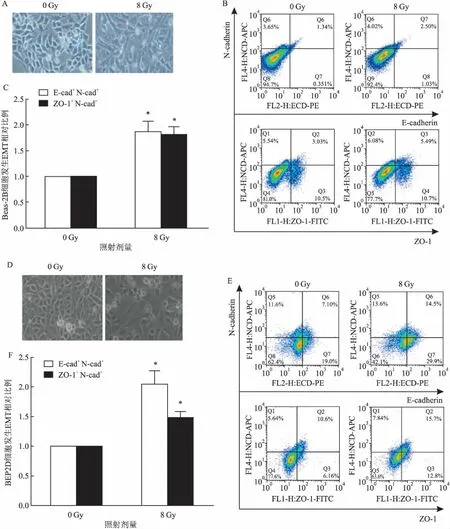
圖5 電離輻射對Beas-2B細胞和BEP-2D細胞形態及上皮、間質標志物的影響
A:光鏡下檢測Beas-2B細胞形態×400;B:流式檢測Beas-2B細胞EMT相關蛋白; C:照射前后Beas-2B細胞發生EMT細胞相對比例柱形圖;與0 Gy組比較:*P<0.05;D:光鏡下檢測BEP-2D細胞形態×400;E:流式檢測BEP-2D細胞EMT相關蛋白;F:照射前后BEP-2D細胞發生EMT細胞相對比例柱形圖;與0 Gy組比較:*P<0.05

