β-TCP作用T淋巴細胞后調控BMSCs成骨分化的研究
許 敏,吳婷婷,何家才
免疫系統和骨骼系統緊密相關,免疫細胞直接或間接參與調控骨組織再生過程。T 淋巴細胞能夠影響破骨細胞的增殖和分化。其中 Th17細胞及其分泌的白介素(interleukin,IL)-17A 在成骨與破骨平衡過程中的作用得到越來越多的研究。同時,研究[1]報道免疫細胞可介導生物材料的骨免疫反應過程。β-TCP 生物材料已被廣泛研究應用于臨床骨再生。研究[2]表明巨噬細胞參與β-TCP 介導的成骨分化。目前還沒有研究報道T 淋巴細胞是否也參與了 β-TCP介導的骨組織再生過程。因此,該研究以β-TCP材料對T淋巴細胞的免疫調節作用作為切入點,探討其對 Th17 細胞亞群分化的影響,同時檢測 Th17 細胞分泌的IL-17A 對小鼠骨髓間充質干細胞 (bone marrow mesenchymal stem cells, BMSCs) 成骨分化的調控作用,旨在為后期進一步的體內實驗奠定基礎。
1 材料與方法
1.1材料
1.1.1實驗動物 SPF 級雄性 C57BL/6 小鼠,4 周齡,體質量(20±5) g,購自安徽醫科大學實驗動物中心。整個實驗過程對動物的處置均符合醫學倫理學標準。
1.1.2主要試劑和儀器 DMEM培養基、RPMI培養基、胰酶細胞消化液(美國Hyclone 公司) ;胎牛血清 (FBS) (美國Corning公司) ;Concanavalin A、PMA、茜素紅染色劑 (美國Sigma公司) ;紅細胞裂解液、鈣離子霉素(北京Solarbio公司) ;autoMACS (德國Miltenyi Biotec公司) ;二氧化碳孵箱 (美國Thermo公司) ;CCK8試劑 (日本同仁公司);臺盼藍染色劑、堿性磷酸酶 (alkaline phosphatase, ALP) 試劑盒(上海碧云天公司) ;酶標儀 (美國Bio-tek公司) ;流式細胞檢測儀 (美國Beckman Coulter公司) ;BFA (美國Selleck公司) ;倒置激光共聚焦顯微鏡 (日本Olymbus公司) ;PCR引物 (上海生工生物工程股份有限公司) ;實時熒光定量PCR儀 (美國Stratagene公司);PVDF 膜(美國Invitrogen公司)。
1.2方法
1.2.1C57BL/6小鼠BMSCs的分離與培養 健康4周齡雄性 C57BL/6 小鼠,按照 Maniatopoulos et al[3]的方法,在無菌條件下去除表皮及肌肉等軟組織,分離小鼠后肢股骨,剪去兩端骨骺,采用注射器從骨髓腔兩端將骨髓沖出,DMEM 完全培養基 (含10% FBS) 制成細胞混懸液,接種至培養皿中,在37 ℃、5 % CO2條件下進行培養,原代細胞生長7 d后待細胞融合達 80%~90%時使用0.25%胰蛋白酶消化傳代。
1.2.2C57BL/6小鼠脾淋巴細胞的分離與培養 小鼠脫頸處死,取右側臥位,剪開表皮和皮下軟組織,取出脾臟置于70 μm濾網上,加入適量紅細胞裂解液研磨,3~5 min后加入4倍體積PBS緩沖液終止,1 500 r/min 離心5 min棄上清液,RPMI完全培養基 (含10% FBS) 重懸,conA (5 μg/ml) 刺激活化48~72 h。
1.2.3梯度濃度β-TCP 浸提液的制備 以 Ca(NO3)24H2O和 (NH4)2HPO4(均為上海國藥集團) 為原始材料,采用化學沉淀法合成 β-TCP 粉末,方法如文獻[4]所述。β-TCP 粉劑加入不含血清RPMI培養基,充分混勻,37 ℃搖床孵育24 h。1 500 r/min 離心10 min,取上清液,0.22 mm 濾網過濾除菌。根據文獻[2]報道,將上清液依次對半稀釋獲得梯度濃度 β-TCP 浸提液 (200、100、50、25、12.5、6.25 mg/ml)。4 ℃保存。
1.2.4細胞活性檢測 刺激活化48~72 h的T淋巴細胞5×103/孔接種于96孔板,每孔分別加入100 μl β-TCP浸提液 (0~200 mg/ml)。每組做3個重復孔,培養12、24、48、72 h,每孔分別加入10 μl CCK8 buffer,37 ℃孵育3 h,使用酶標儀在450 nm處讀取吸光度值,所有定量檢測重復測定3次。
1.2.5Th17亞群分化檢測 autoMACS直接法免疫磁珠分選出CD4+T 細胞,接種于預先包被anti-CD3 (10 μg/ml) 4 ℃過夜的培養皿,同時加入anti-CD28 (5 μg/ml) 和IL-2 (20 μg/ml) 活化48~72 h。
CD4+T細胞2×106每孔,每孔分別加入2 ml β-TCP浸提液 (0~50 mg/ml) ,培養4 d。加入 PMA、BFA和鈣離子霉素封閉4~6 h后,收集細胞進行流式細胞術或激光共聚焦檢測,所有檢測重復3次。
1.2.6上清液中IL-17A分泌量檢測 按1.2.5方法培養4 d,收集孔內上清液,ELISA法檢測上清液中IL-17A的分泌量,每組做3個重復孔,酶標儀450 nm波長處檢測,所有定量檢測重復3次。
1.2.7BMSCs成骨分化檢測 小鼠 BMSCs 3×105每孔鋪板,分別加入 β-TCP浸提液對T淋巴細胞作用后的上清液和同濃度的單獨的β-TCP 浸提液,每3 d 換液一次,在第14天和第21天采用 qRT-PCR 實驗檢測ALP和骨鈣素 (osteocalcin, OCN) 的基因表達水平,PCR引物委托上海生工生物工程公司設計,引物序列見表1。第21 天分別進行ALP 染色和茜素紅鈣結節染色,同時Western blot法檢測ALP和OCN的蛋白表達,所有測定重復3次。
1.2.8IL-17A中和實驗 在 β-TCP 浸提液對T淋巴細胞作用后的上清液中加入anti-IL-17A (10 μg/ml) 中和抗體,與小鼠BMSCs培養時加入,培養方法同1.2.7。此后每3 d換液一次,在第21天通過qRT-PCR技術檢測 β-actin、ALP 和 OCN 的基因表達水平,第21天分別進行 ALP 染色和茜素紅鈣結節染色,同時Western blot實驗檢測ALP和OCN蛋白表達水平。所有測定重復3次。
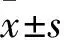
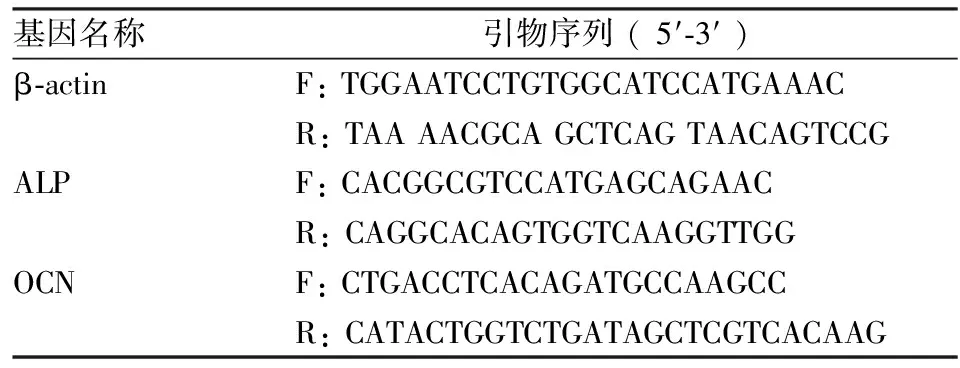
表1 PCR引物列表
2 結果
2.1T淋巴細胞活性檢測CCK8檢測結果顯示,培養72 h內,0~50 mg/ml的 β-TCP材料浸提液促進T淋巴細胞緩慢生長,100和200 mg/ml組明顯抑制T淋巴細胞增殖;培養72 h,臺盼藍染色結果顯示,與0 mg/ml組比較,濃度為100和200 mg/ml的 β-TCP材料浸提液組活細胞/死細胞比率接近零,細胞幾乎全部死亡,具有明顯細胞毒性,差異有統計學意義(F=105.042,P<0.05),見圖1。
2.2β-TCP浸提液誘導Th17細胞分化流式細胞術結果表明,0~50 mg/ml的 β-TCP浸提液能夠誘導Th17亞群分化,具有濃度依賴性,濃度為25 mg/ml時誘導產生Th17細胞比例最高,差異有統計學意義 (F=134.76,P<0.05)。細胞激光共聚焦結果表明,25 mg/ml組IL-17A熒光信號最強。ELISA結果表明,β-TCP浸提液濃度為25 mg/ml時上清液IL-17A分泌量最高,差異有統計學意義 (F=50.98,P<0.05) ,見圖2。
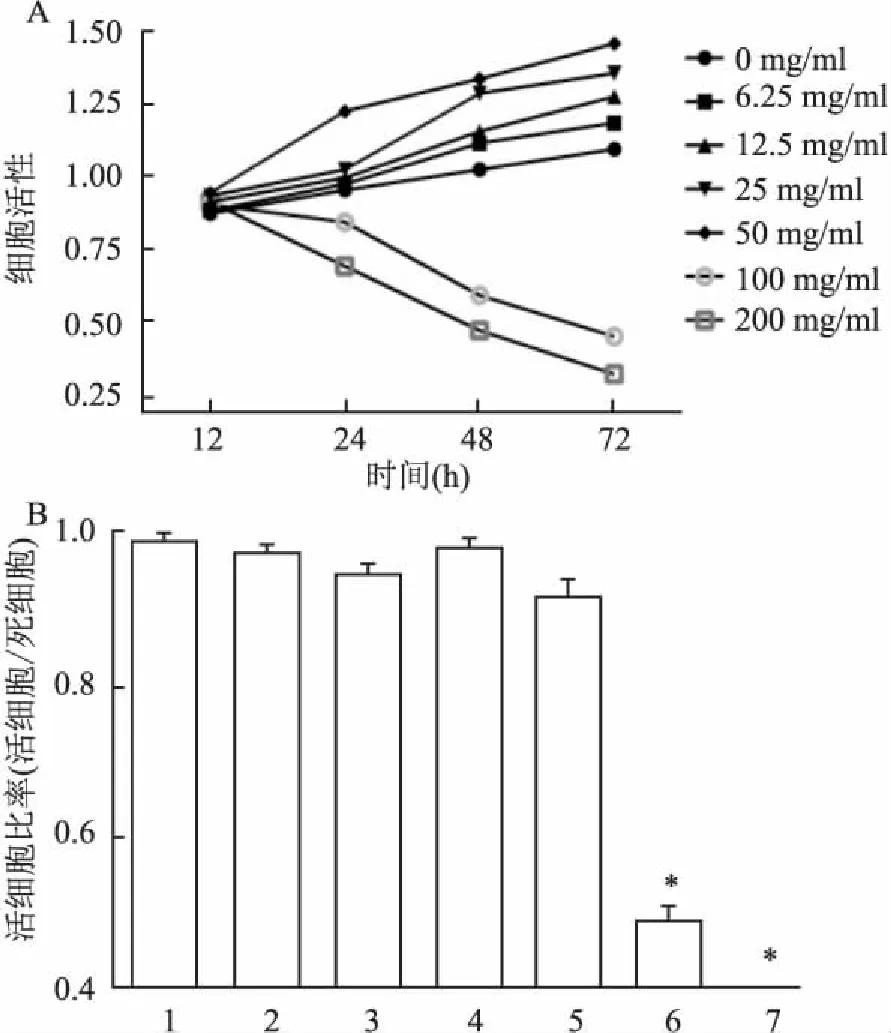
圖1 β-TCP浸提液對T淋巴細胞的細胞活性影響
A:CCK8實驗;B:臺盼藍染色后活細胞/死細胞比率;1: 0 mg/ml;2: 6.25 mg/ml;3: 12.5 mg/ml;4: 25 mg/ml;5: 50 mg/ml;6: 100 mg/ml;7: 200 mg/ml;與0 mg/ml組比較:*P<0.05
2.3β-TCP浸提液對T淋巴細胞作用后上清液調控BMSCs成骨分化qRT-PCR實驗結果表明,與陰性對照組比較,培養第14 天,0~25 mg/ml的上清液組ALP和OCN基因表達水平逐漸上升,其中25 mg/ml組ALP和OCN基因的相對表達水平分別為(3.07±0.22)(F=72.43,P<0.05)、(3.52±0.69)(F=196.76,P<0.05);在第21天,25 mg/ml組的ALP (F=15.39,P<0.05) 和OCN (F=495.34,P<0.05)基因表達上調明顯,差異有統計學意義。與同濃度的單獨 β-TCP浸提液組比較,25 mg/ml誘導T細胞后上清液組分別在14 d 上調表達ALP (F=573.91,P<0.05) 和OCN (F=1 608.25,P<0.05)、第21天上調表達ALP (F=436.73,P<0.05) 和OCN (F=792.96,P<0.05),差異具有統計學意義,表明 β-TCP浸提液對T淋巴細胞作用后調控BMSCs成骨分化效果更佳。與此同時,21 d的ALP染色和茜素紅鈣結節染色結果也表明相同結果。第21天的Western blot實驗結果顯示,陰性對照組ALP和OCN蛋白表達水平較低,在 β-TCP 浸提液作用于T淋巴細胞后,12.5~50 mg/ml上清液組ALP和OCN蛋白表達水平隨濃度增加而上升,均在25 mg/ml時達到最大。見圖3。
2.4IL-17A中和實驗降低BMSCs骨向分化qRT-PCR結果顯示第21天,與未中和上清液組比較,12.5~50 mg/ml IL-17A中和組ALP和OCN的基因表達水平下調,ALP和OCN基因的相對表達量為(1.803±0.639)(F=58.988,P<0.05)、(1.617±0.782)(F=77.682,P<0.05),差異有統計學意義。第21天ALP染色、茜素紅染色結果表明,25 mg/ml 時,與未中和上清液組和 β-TCP 浸提液組比較,IL-17A中和組陽性染色減弱。Western blot實驗也表明,IL-17A中和組ALP和OCN 蛋白表達水平相對下降。見圖4。
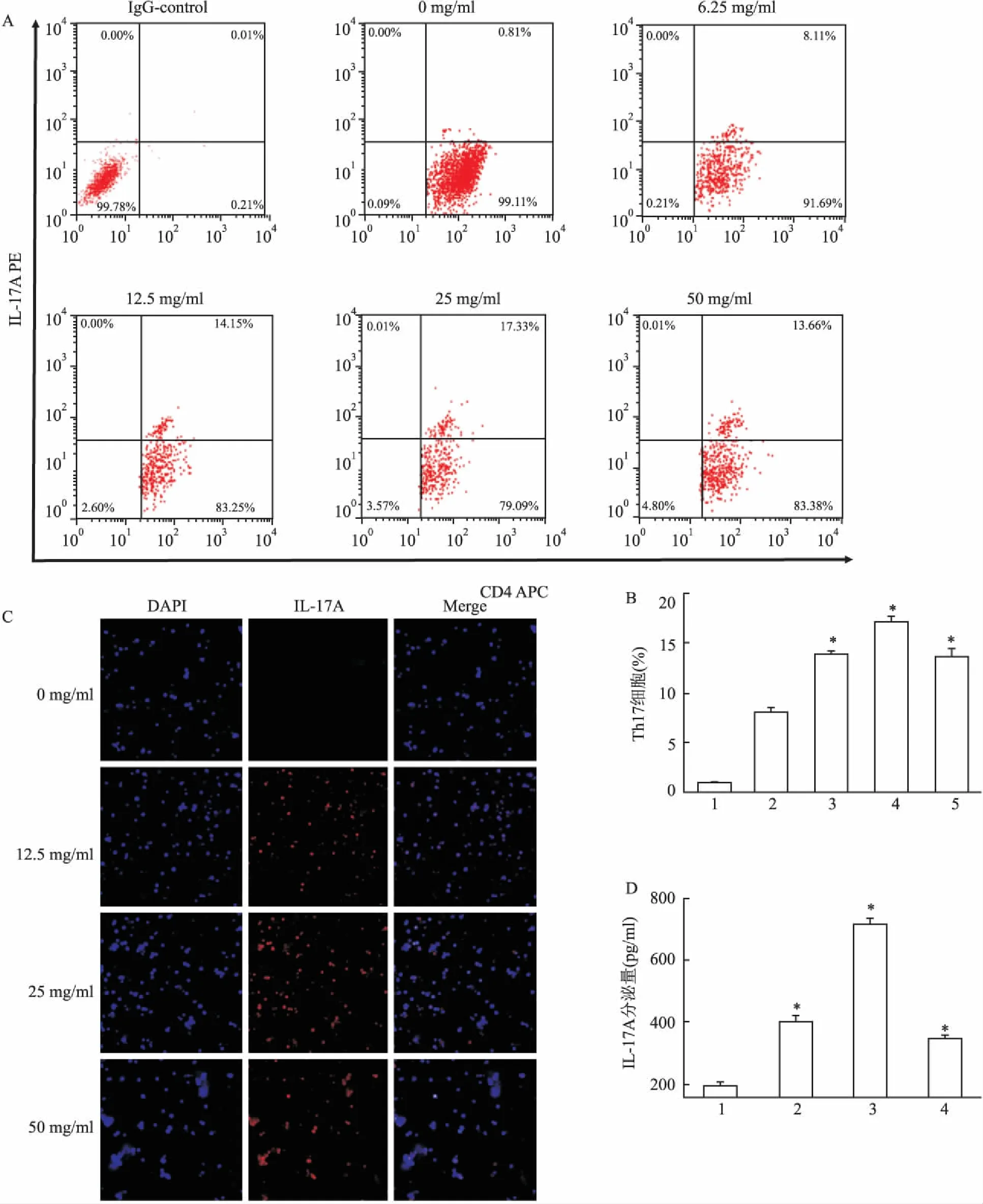
圖2 β-TCP材料浸提液對T淋巴細胞的亞群分化作用
A:流式細胞技術檢測細胞表面標志物CD4和IL-17A陽性表達情況;B:流式結果統計分析;1:0 mg/ml;2: 6.25 mg/ml; 3: 12.5 mg/ml; 4: 25 mg/ml; 5:50 mg/ml;C:細胞共聚焦檢測細胞表面標志物CD4和IL-17A陽性表達情況 ×60;D:ELISA法檢測共培養上清液中IL-17A分泌量;IgG- control: IL-17A抗體同源對照;1: 0 mg/ml;2:12.5 mg/ml;3:25 mg/ml;4:50 mg/ml;與0 mg/ml比較:*P<0.05
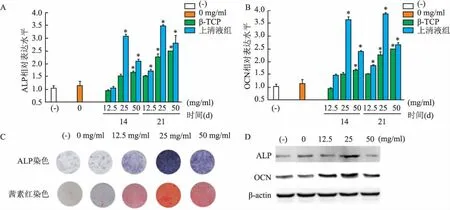
圖3 β-TCP浸提液與T淋巴細胞作用后上清液對小鼠BMSCs成骨分化的影響
A、B:qRT-PCR技術檢測ALP和OCN基因的表達;C:ALP染色和茜素紅染色;D:Western blot法檢測ALP、OCN蛋白表達;(-):陰性對照組;與陰性對照組比較:*P<0.05
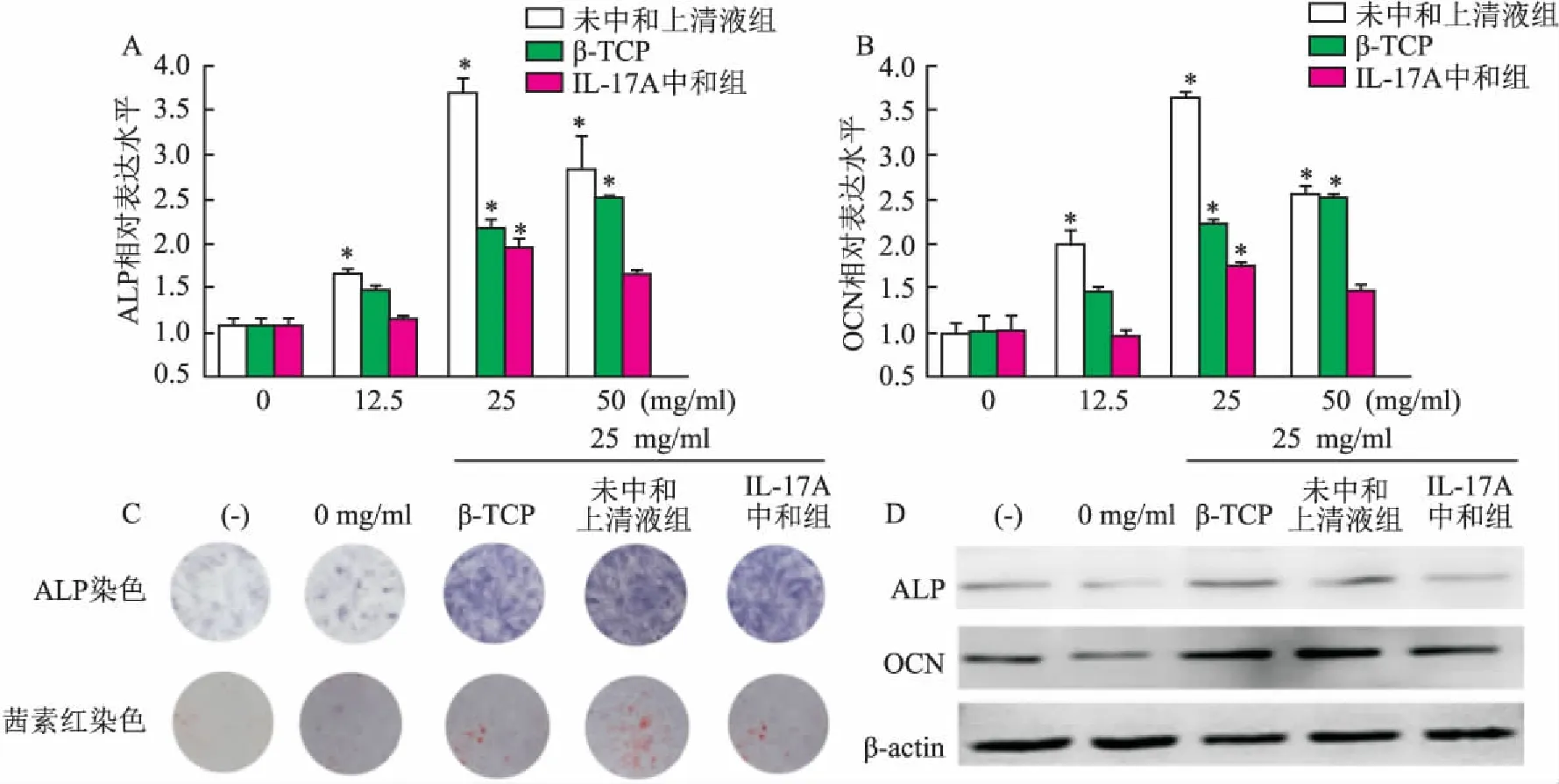
圖4 IL-17A中和實驗對小鼠BMSCs成骨分化能力的影響
A、B:qRT-PCR法檢測ALP、OCN基因表達;C:ALP和茜素紅染色;D:Western blot法檢測ALP、OCN蛋白表達;(-):陰性對照組;與陰性對照組比較:*P<0.05
3 討論
β-TCP是一種具有良好生物安全性和降解性能的骨替代生物材料,被廣泛用于臨床骨缺損的再生修復治療。2005年,Zerbo et al[5]將β-TCP用于臨床上頜竇底提升術,由于植入材料后局部炎癥反應和部分材料降解,臨床療效不理想。與炎癥反應和生物材料的降解吸收有關的T淋巴細胞在宿主與骨替代生物材料的相互作用中發揮著重要作用。因此,研究骨替代材料對免疫細胞的調節作用,有利于開發“智能”骨替代生物材料[6],創造促進成骨的免疫環境。本實驗研究結果表明,6.25~25 mg/ml的 β-TCP浸提液能夠誘導產生Th17亞群,具有濃度依賴性,表明 β-TCP浸提液對T淋巴細胞產生免疫調節作用,誘導促進Th17細胞分化。
眾所周知,BMSCs是來源于骨髓的多能間充質干細胞,具有營養、抗炎作用和免疫調節、促進組織再生和抗凋亡等特性[7]。研究[8]顯示,HIF-1α 介導的BMSCs在修復大鼠顱骨標準骨缺損中取得理想效果。然而Nauta et al[9]將BMSCs作為種子細胞,以羥基磷灰石磷酸鈣作為支架材料體內成骨失敗。因此,一定濃度的炎癥細胞因子對于骨替代生物材料啟動和促進BMSCs成骨分化是必需的。
IL-17A是Th17細胞分泌的主要炎性細胞因子。有研究[10]表明正畸誘導的牙髓炎癥微環境中的IL-17A提高牙髓干細胞的自我更新和分化,也有學者稱IL-17A能夠促進人間充質干細胞的增殖分化能力[11]。本研究顯示,β-TCP材料浸提液對T淋巴細胞免疫調節作用后的上清液中IL-17A濃度與小鼠BMSCs的成骨分化效果相關。上清液中的IL-17A調控小鼠BMSCs的成骨分化,刺激BMSCs釋放成骨相關因子,ALP和OCN均呈現高水平上調,且能夠持續高水平表達。其中,ALP是成骨分化的早期標志物,是骨礦化過程中發揮重要作用的酶[12]。OCN是成骨分化的關鍵基因。β-TCP作為公認的能夠促進成骨分化的骨替代材料,已被證明具有明顯的促進BMSCs成骨分化的能力。本研究為排除 β-TCP浸提液本身對成骨過程的影響,實驗中設置了同等濃度的 β-TCP浸提液組和β-TCP浸提液作用于T淋巴細胞后的上清液組。通過圖3的誘導實驗及圖4的抗體中和實驗,均說明了β-TCP浸提液作用于T淋巴細胞后可增強 β-TCP成骨誘導效果。同時,IL-17A抗體中和實驗后的小鼠BMSCs的成骨分化能力明顯下降,表明IL-17A在提高小鼠BMSCs成骨分化能力中發揮著重要作用。
綜上所述,β-TCP浸提液通過對T淋巴細胞的免疫調節作用,促進Th17亞群分化,呈濃度依賴性;Th17細胞分泌IL-17A介導小鼠BMSCs的成骨分化,為將來體內實驗奠定基礎。但目前為止,β-TCP材料誘導T淋巴細胞Th17細胞方向分化的具體分子作用機制尚不明確,且在體內β-TCP誘導成骨的機制是否依賴于對T細胞的調控,仍需要進一步研究。

