弗氏佐劑誘導大鼠腹腔巨噬細胞分泌IL-10降低的機制研究
宋 陽,李 俊, 解 丹,周德喜,林 珍
類風濕關節炎(rheumatoid arthritis, RA)其主要病理特征是關節滑膜的慢性、進行性、侵襲性炎癥,促使血管翳的形成以及軟骨與骨組織的破壞,致關節病變,是人類致殘的主要原因之一。作為炎癥相關性疾病,RA發病機制還未完全闡明,研究[1]報道RA發病過程中,炎性細胞包括腹腔巨噬細胞(peritoneal macrophages, PMΦ)的激活,引起細胞因子分泌不平衡,如白細胞介素-1(interleukin-1)、 IL-6、腫瘤壞死因子-α(tumor necrosis factor-α, TNF-α)明顯增多,IL-10顯著減少,是RA形成的主要機制之一。 Xie et al[2]研究報道,IL-10可抑制單核巨噬細胞的激活、相關炎癥因子的合成、分泌,減輕全身及關節局部炎癥反應。但在RA發病過程中IL-10分泌減少機制尚不清楚。Karouzakis et al[3]研究RA患者的滑膜細胞發現,基因啟動子甲基化異常參與了RA的病程。Cifuentes-Zuniga et al[4]研究發現,巨噬細胞中IL-10的表達變化可能與DNMT密切相關。上述研究提示,DNMT促進IL-10甲基化沉默,可能是RA發病機制之一。該實驗以完全弗氏佐劑(complete Freund adjuvant,CFA)誘導大鼠 PMΦ為研究對象,探討IL-10表達降低的可能機制,為RA防治提供思路。
1 材料與方法
1.1實驗動物Sprague Dawley (SD)大鼠,安徽醫科大學實驗動物中心提供,清潔級,雌性,體質量 (230±20)g,動物合格證號:皖醫實動準字01號。動物飼養環境模擬自然晝夜條件,自由飲水、進食,室溫18~22 ℃,濕度40%~60%。
1.2主要藥物與試劑CFA、5-氮雜胞苷(5-azaC)、脂多糖(lipopolysaccharide, LPS)購自美國Sigma公司;IL-10、甲基轉移酶1(DNMT1)、β-actin引物序列由中國上海生工生物工程技術服務有限公司合成;甲基化特異性PCR(MSP)引物序列由中國上海希匹吉生物工程公司合成;MSP轉化試劑盒購自德國QIAGEN公司;DNMT1、β-actin抗體購自美國Santa Cruz公司;辣根酶兔抗山羊IgG(H+L)、辣根酶山羊抗小鼠IgG(H+L)購自北京中杉公司。
1.3實驗方法
1.3.1佐劑性關節炎(AA)模型大鼠建立 SD大鼠使用足趾容積儀測定左、右后踝關節以下容積(ml)后,隨機分為正常組、模型組。模型組使用CFA(0.1 ml)注射于左后足趾皮內,正常組注射相同劑量PBS。
1.3.2AA模型大鼠鑒定
1.3.2.1足爪腫脹度變化的測定 致炎第17天、第21天、第24天、第28天后,檢測繼發側大鼠關節足腫脹度程度(Δml=致炎后容積-致炎前容積)。
1.3.2.2多發性關節炎指數(polyarthritis index,PI)評分 記錄第17天、第21天、第24天、第28天大鼠全身關節病變程度,按5級評分法計算PI。0:無變化;1:足小趾關節紅腫;2:趾關節、足跖出現紅腫;3:踝關節以下出現紅腫;4:包括踝關節均呈現紅腫狀態。根據大鼠關節紅腫程度(不包括左后足)累計積分,計算出各只大鼠關節炎指數評分。
1.3.2.3大鼠膝關節滑膜組織病理檢查 注射CFA 28 d后,取大鼠膝關節進行常規石蠟包埋切片,HE染色觀察。
1.3.3PMΦ的提取 大鼠常規麻醉后,股動脈放血法處死,用新潔爾滅溶液浸泡消毒5 min,腹腔注射PBS(10 ml,4 ℃),仰臥、平放、輕揉大鼠腹部。靜置5 min后吸取腹腔中液體。4 ℃、1 000 r/min 離心10 min,棄上清液; PBS清洗, DMED培養液重懸,加入6孔板,每孔1 ml(2×106/ml),于37 ℃、5% CO2培養箱中培養2 h,棄上清液,PBS清洗,巨噬細胞為貼壁細胞。
1.3.45-azaC作用濃度與時間的確 將正常組與模型組細胞接種于24孔板后,進行細胞實驗分組。正常組:對照組大鼠PMΦ,加無血清培養基;模型組:AA大鼠PMΦ加LPS(2 μg/ml)刺激;5-azaC作用模型組細胞24 h與48 h濃度梯度組:AA大鼠PMΦ加LPS(2 μg/ml)刺激,同時給予5-azaC(1、5、10 μmol/L)作用24 h與48 h;體積(1 ml/孔),平行孔(3個/組),ELISA法檢測各組細胞上清液IL-10的表達,分析5-azaC作用的最佳濃度和時間。
1.3.5RT-PCR法分析大鼠PMΦ中IL-10、DNMT1 基因表達情況 TRIzol法提取各組細胞總RNA,參照試劑盒說明逆轉錄合成cDNA,引物序列見表1。PCR反應產物由1.5%瓊脂糖凝膠電泳檢測,各擴增產物對β-actin光密度值的比值表示目的基因的相對表達量。
1.3.6Western blot法檢測DNMT1蛋白水平 各瓶細胞加入含PMSF的細胞裂解液400 μl于冰上裂解30 min,后4 ℃、12 000 r/min 離心30 min。BCA法測定蛋白濃度,以含30 μg 蛋白的溶液體積為上樣量(濃縮膠電泳80 V,分離膠電泳120 V),轉膜250 mA,4 h,封閉,漂洗后加入一抗,4 ℃過夜,加入二抗, 60 min輕搖,顯影,分析條帶吸光值(以β-actin為內參)。
1.3.7MSP檢測IL-10啟動子區甲基化狀態 按試劑盒說明提取DNA,亞硫酸氫鈉處理,進行MSP檢測,引物序列見表2。1.5%瓊脂糖凝膠電泳PCR產物混合上樣緩沖液(恒壓160 V、60 min),凝膠圖像分析系統進行圖像分析。

表1 引物序列和PCR產物長度

表2 MSP引物序列和產物長度
2 結果
2.1AA模型大鼠的建立及評價
2.1.1AA模型大鼠整體評價 正常組大鼠四肢狀態正常,食飲如常,皮毛光澤。模型組大鼠體重降低,因關節紅腫不便爬行,輕度脫毛且毛色黯淡無光。注射CFA后第14天,觀察到關節紅腫,部分大鼠耳、尾可見炎性結節和紅斑;第17天,部分大鼠關節負重能力減弱;第24天~第28天左右,部分大鼠關節出現畸形,嚴重影響四肢活動及進食,關節炎腫脹達到高峰。
2.1.2AA模型大鼠繼發性足腫脹變化 大鼠造模第17天后,可見關節腫脹度顯著增加,并日趨嚴重,在第28天腫脹最為顯著,與正常組比較,差異具有統計學意義(表3)。

表3 大鼠足腫脹度變化情況
與正常組比較:**P<0.01
2.1.3AA大鼠多發性關節炎足爪評分 造模第17天后,實驗通過多發性關節炎足爪評分顯示, AA模型大鼠未注射CFA的其余3個肢體關節,出現了紅腫、變形、行動不便;第28天達到最高峰,結果見圖1。后期實驗以造模28 d為研究對象。
2.1.4AA模型大鼠膝關節組織病理學檢查 病理檢查顯示,正常組大鼠關節囊滑膜細胞有2~3層,且細胞排列規則,未見滑膜組織增生和形成的血管翳 (圖2A)。與正常大鼠比較,模型組大鼠發生炎性細胞浸潤,可見滑膜層變厚,與滑膜細胞呈乳頭狀突起增生,且細胞排列紊亂有關,亦可見滑膜下層纖維組織增生,血管翳形成 (圖2B、2C)。

圖1 大鼠PI評分
2.2AA模型大鼠PMΦ中IL-10表達的變化及機制
2.2.15-azaC對AA模型大鼠PMΦ分泌IL-10的影響 ELISA檢測顯示,與正常組PMΦ分泌IL-10比較,AA組PMΦ IL-10含量明顯降低,差異有統計學意義(P<0.05);與AA組比較,用濃度分別為1、5、10 μmol/L的5-azaC刺激AA組PMΦ細胞24 h和48 h,可不同程度提高IL-10的含量;5 μmol/L作用48 h促進IL-10升高最為顯著(P<0.01)(表4)。5 μmol/L、48 h作為后期實驗濃度和時間。

圖2 大鼠膝關節組織學檢查 ×10

圖3 RT-PCR法檢測AA大鼠PMΦ中IL-10基因表達情況

圖4 MSP法分析AA大鼠PMΦ中IL-10啟動子甲基化狀態

圖5 RT-PCR法檢測AA大鼠PMΦ中DNMT1基因表達情況
2.2.25-azaC對AA模型大鼠PMΦ產生IL-10 mRNA的影響 應用RT-PCR檢測大鼠PMΦ中IL-10 基因表達變化顯示,與正常組比較,模型組大鼠PMΦ細胞中IL-10的mRNA表達明顯降低;給予5-azaC(5 μmol/L)干預后,與模型組比較,IL-10的mRNA表達明顯升高(圖3)。提示模型組大鼠PMΦ細胞中IL-10表達降低可能與甲基化有關。
2.2.35-azaC對AA模型大鼠PMΦ的IL-10啟動子甲基化的影響 實驗進一步通過MSP檢測,在AA模型大鼠PMΦ中,IL-10啟動子區發生高甲基化改變,而正常組大鼠 PMΦ中,IL-10啟動子區則處于低甲基化狀態;應用5-azaC處理可降低AA模型大鼠PMΦ中IL-10啟動子區高甲基化狀態(圖4)。提示AA模型大鼠PMΦ中IL-10表達降低與其啟動子發生甲基化有關。
2.3AA模型大鼠PMΦ的DNMT1的mRNA變化為了進一步探討IL-10發生甲基化的機制,應用RT-PCR檢測DNMT1的基因表達變化。結果顯示,與正常組比較,模型組大鼠PMΦ中DNMT1的mRNA表達明顯上升,差異有統計學意義;給予5-azaC(5 μmol/L)干預顯示,與模型組比較,5-azaC可明顯降低DNMT1的mRNA表達(圖5)。
2.4AA大鼠PMΦ的DNMT1的蛋白表達變化應用Western blot檢測AA大鼠PMΦ中DNMT1的蛋白表達變化,結果顯示模型組大鼠PMΦ中DNMT1蛋白的表達明顯上升,與正常組比較差異有統計學意義;與模型組比較,5-azaC(5 μmol/L)刺激后DNMT1蛋白表達明顯降低(圖6)。上述結果表明IL-10發生甲基化的同時, DNMT1的表達同樣呈現顯著性變化,IL-10的甲基化可能與DNMT1相關。
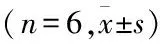
表4 5-azaC在不同濃度和時間刺激細胞后的IL-10的表達變化
與正常組比較:**P<0.01 ; 與模型組比較:#P<0.05,##P<0.01

圖6 Western blot法檢測AA大鼠PMΦDNMT1蛋白表達情況
與正常組比較:**P<0.01;與模型組比較:##P<0.01
3 討論
RA的主要病理特征是炎性細胞浸潤促進了滑膜組織增生,引起骨和軟骨破壞。RA是影響關節功能的主要疾病之一,探討其發病機制,為臨床尋找可能的作用靶點,是亟待解決的問題。合適的動物模型是研究RA發病機制的重要參考。以CFA誘導大鼠,炎性細胞浸潤、滑膜增厚、足腫脹顯著、骨及軟骨的侵蝕等病理特征與RA相似[5],已作為研究RA發病的主要的動物模型。本實驗通過注射CFA誘導AA模型,結果顯示,與正常組比較,AA大鼠膝關節顯著紅腫、爬行困難,且大鼠足腫脹度、PI顯著高于正常組;病理檢查顯示,大鼠膝關節滑膜組織存在明顯的炎性細胞浸潤及血管翳形成,關節囊滑膜增生呈乳頭狀突起,滑膜下層纖維組織明顯增厚,提示AA模型建立成功。
RA發病機制復雜,研究[3, 6]報道,在RA的病理過程中,巨噬細胞作為參與炎癥反應的始動細胞,釋放多種炎癥因子,使得細胞因子平衡被打破,促進了RA的發生和發展。調節RA發病過程中紊亂的細胞因子可能為防治RA提供思路。抑炎因子IL-10具有廣泛的生物學活性,參與炎癥性腸病、系統性紅斑狼瘡(SLE)等多種疾病病程。文獻[7-8]報道,IL-10亦參與了RA的病程,在RA患者中,存在著IL-10表達降低。本實驗以大鼠PMΦ為研究對象,結果亦顯示,大鼠PMΦ中IL-10 mRNA及其分泌的IL-10蛋白表達顯著減少,表明IL-10的缺失可能是細胞因子網絡功能紊亂的一個重要原因。但IL-10表達減少其機制還不明確。
近期有研究[9-10]證實,表觀遺傳修飾參與了炎癥免疫性疾病(包括RA)的發生發展過程。DNA甲基化作為表觀遺傳修飾方式的一種, S-腺苷甲硫氨酸是其甲基供體,由DNA甲基轉移酶(DNMT)將的甲基化基團催化轉移到DNA分子中,形成5-甲基胞嘧啶(5-mC),從而引起相關基因突變和轉錄沉默。多種的疾病的發病過程中均出現IL-10發生甲基化[11]。為了探明IL-10表達減少機制,實驗應用去甲基化試劑5-azaC處理大鼠PMΦ,結果顯示,5-azaC可明顯增加IL-10的mRNA表達與蛋白分泌,提示AA大鼠PMΦ中IL-10降低,可能與其啟動子區域發生甲基化有關。進一步應用MSP研究顯示,在AA大鼠PMΦ中IL-10啟動子區域發生了高甲基化。表明IL-10表達降低與其啟動子區域高甲基化密切相關。 DNMT1為催化并維持DNA甲基化的重要蛋白。本實驗亦觀察了其表達變化,結果顯示,AA大鼠PMΦ中,與正常組比較,伴隨著IL-10下降,DNMT1 mRNA和蛋白表達明顯升高,表明在AA大鼠中IL-10表達降低與其啟動子甲基化有關,而DNMT1可能是促進其發生甲基化的原因之一。
以上實驗結果提示,IL-10可能參與RA發病過程中炎癥因子失衡,IL-10表達的降低與其啟動子區域高甲基化狀態有關,DNMT1可能參與了IL-10的高甲基化形成。

