D896N突變型EGFR穩(wěn)轉(zhuǎn)細胞株的構(gòu)建及其對吉非替尼敏感性的研究
潘 婧,彭 佳,潘躍銀
表皮生長因子受體(epidermal growth factor receptor,EGFR)是一種多結(jié)構(gòu)域的跨膜酪氨酸激酶受體,由胞外配位區(qū)、跨膜區(qū)以及在胞內(nèi)帶有調(diào)控羧基末端的酪氨酸激酶區(qū)組成。EGFR激活后可以激活其下游多種信號通路,在細胞的增殖、分化以及血管形成等方面發(fā)揮重要作用[1]。EGFR突變與多種腫瘤的發(fā)生發(fā)展相關(guān),研究[2]表明,約40%的非小細胞肺癌(non-small cell lung cancer,NSCLC)患者攜帶EGFR的陽性突變。EGFR酪氨酸激酶抑制劑(EGFR tyrosine kinase inhibitors,EGFR-TKI)在EGFR突變陽性患者中的治療效果顯著[3]。第一代EGFR-TKI(代表藥物為吉非替尼、厄羅替尼)通過結(jié)合EGFR酪氨酸激酶,阻斷EGFR的活化及下游信號傳導(dǎo)從而發(fā)揮作用[4]。雖然有相當(dāng)一部分EGFR陽性突變的NSCLC患者靶向治療療效良好,但是,并不是所有EGFR激酶區(qū)的突變都有驅(qū)動作用或是對藥物敏感[5]。在臨床工作中,一位NSCLC患者的淋巴組織中檢測到了EGFR罕見突變D896N。根據(jù)NCBI上EGFR基因的序列,D896N是EGFR的酪氨酸激酶功能區(qū)(EGFR的18~24外顯子為酪氨酸激酶功能區(qū))第896位密碼子的點突變,導(dǎo)致天冬氨酸變?yōu)樘於0贰T摶颊咴跈z測出突變位點后,采取厄羅替尼治療,經(jīng)檢查淋巴結(jié)有縮小。該位點至今尚無相關(guān)報道,意義不明,因此需要通過構(gòu)建新的細胞株實驗來判斷該位點EGFR突變對于藥物的敏感性。
1 材料與方法
1.1材料Tel-EGFR N端質(zhì)粒、C端質(zhì)粒、MLV、VSVG四種質(zhì)粒和293T細胞、Ba/F3細胞、宿主菌DH5α均由中國科學(xué)院合肥物質(zhì)研究院強磁場中心劉青松實驗室保存,其中N端質(zhì)粒為包含有Tel基因及野生型EGFR N端部分序列的MSCV質(zhì)粒,C端質(zhì)粒則為野生型EGFR的C端部分序列。293T細胞培養(yǎng)于含有10%胎牛血清的RPMI 1640培養(yǎng)基中,BA/F3細胞培養(yǎng)于含有10%胎牛血清、10 ng/ml IL-3、100 U/ml 鏈霉素和100 U/ml青霉素的RPMI 1640培養(yǎng)基中。
1.2主要試劑限制性內(nèi)切酶EcoR I、BamH I,PCR用DNA聚合酶Prime Star和蛋白質(zhì)預(yù)染Marker,核酸提取純化試劑盒(美國Thermo公司);轉(zhuǎn)染試劑TransIn EL,Polybrene(美國Sigma公司);Opti-MEM(Minimal Esential Medium)(美國Gibco公司);兔抗EGFR抗體、兔抗p-EGFR抗體、鼠抗β-actin、兔二抗、鼠二抗(美國CST公司);
1.3MSCV-Tel-EGFRD896N重組質(zhì)粒構(gòu)建及鑒定
1.3.1PCR獲得D896N點突變的Tel-EGFR序列 根據(jù)NCBI上EGFR基因的序列,進行引物設(shè)計。上游引物:5′-TATACCCACCAGAGTAACGTCTGGAGCTACGGG-3′,下游引物:5′-CCCGTAGCTCCAGACGTTACTCTGGTGGGTATA-3′。模板為已有的Tel-EGFR C端質(zhì)粒,普通PCR進行點突變。PCR反應(yīng)體系總共20 μl,包括Tel-EGFR C端質(zhì)粒模板0.5 μl,上下游引物各0.5 μl,PrimeStar 10 μl,ddH2O 8.5 μl。PCR反應(yīng)體系:95 ℃預(yù)變性3 min、95 ℃變性30 s、61℃退火20 s、72 ℃延伸70 s,此過程共25個循環(huán);之后72 ℃ 5 min。產(chǎn)物經(jīng)1%瓊脂糖電泳,驗證后普通PCR將突變前后序列連接,以前述所得突變位點前后序列為模板。PCR反應(yīng)體系總共20 μl,包括稀釋模板0.5 μl,上下游引物各0.5 μl,Prime Star 10 μl,ddH2O 8.5 μl。PCR反應(yīng)體系:95 ℃預(yù)變性3 min、95 ℃變性30 s、61 ℃退火20 s、72 ℃延伸2 min,此過程共5個循環(huán);之后95 ℃變性30 s、72 ℃退火20 s、72 ℃延伸2 min;最后72 ℃ 5 min。產(chǎn)物經(jīng)1%瓊脂糖電泳,驗證后純化。
1.3.2質(zhì)粒的重組與鑒定 用限制性內(nèi)切酶EcoR I和BamH I雙酶切帶有Tel-EGFR N端序列的載體,于37 ℃酶切2 h后純化。將產(chǎn)物及前述步驟純化所得產(chǎn)物經(jīng)1%瓊脂糖電泳,驗證后以1 ∶1的比例進行PCR連接重組。重組體系共10 μl,包括前述所得產(chǎn)物各3.5 μl,重組酶1 μl,5×CE Buffer 2 μl,于PCR儀中37 ℃ 30 min。重組質(zhì)粒構(gòu)建后,宿主菌DH5α感受態(tài)細胞進行轉(zhuǎn)化,均勻涂布于含有氨芐青霉素的固體培養(yǎng)基表面,37 ℃培養(yǎng)18~24 h后挑取陽性克隆,置于37 ℃溫箱搖床,搖菌過夜后,質(zhì)粒抽提,37 ℃下酶切驗證,之后測序鑒定。
1.4構(gòu)建穩(wěn)定轉(zhuǎn)染的細胞株
1.4.1慢病毒的包裝 轉(zhuǎn)染前將293T細胞調(diào)整密度為2×105/ml加入6孔板中培養(yǎng),次日觀察細胞密度達到80%時進行轉(zhuǎn)染。慢病毒包裝過程如下:1.5 ml離心管中加入250 μl Opti-MEM培養(yǎng)基,依次加入重組質(zhì)粒2 μg, VSVG 0.5 μg,MLV 0.5 μg,輕柔震蕩混勻后加入TransIn EL 9 μl,再次輕柔震蕩混勻后室溫靜置20 min,形成復(fù)合物。靜置期間6孔板換液。20 min后將復(fù)合物均勻加入到6孔板中,輕微搖晃6孔板使復(fù)合物分布均勻。將細胞置于37 ℃、5% CO2孵箱中培養(yǎng)48 h后,收集上清液,經(jīng)0.45 μm針式濾器過濾后獲得病毒液,4 ℃冷藏待用。
1.4.2病毒轉(zhuǎn)染Ba/F3細胞 細胞計數(shù)后取約1×106個細胞,離心后棄去上清液,用包裝好的病毒液將細胞重懸,加入濃度0.1%的Polybrene,2 300 r/min離心90 min,離心結(jié)束后移入6孔板。對照孔中鋪1×106個Ba/F3細胞,普通培養(yǎng)液培養(yǎng)。將細胞置于37 ℃、5% CO2孵箱中培養(yǎng)48 h后,換液,兩孔均換為含有0.1% Puromycin的普通培養(yǎng)液培養(yǎng),進行抗生素篩選,48 h后觀察細胞。
1.4.3Western blot法檢測EGFR及p-EGFR蛋白的表達 將轉(zhuǎn)染了D896N突變型EGFR質(zhì)粒的Ba/F3細胞裂解,離心后取蛋白上清液,制樣。濃縮膠120 V電泳30 min后,分離膠80 V電泳1 h,100 V恒壓轉(zhuǎn)膜,5%濃度的脫脂牛奶封閉1 h,以EGFR、p-EGFR抗體為一抗,4 ℃孵育過夜。次日TBST洗膜3遍,加兔二抗,室溫孵育1 h,再次TBST洗膜3遍后曝光顯影。
1.4.4觀察撤除培養(yǎng)基中IL-3后對細胞的影響 將Ba/F3-Tel-EGFR D896N細胞培養(yǎng)液中的IL-3濃度每隔48 h按1 ∶2的梯度降低,直至撤除IL-3。以不加IL-3培養(yǎng)的Ba/F3-Tel-EGFR L858R細胞為對照,觀察細胞生長情況。
1.4.5Western blot法檢測藥物對磷酸化影響 Ba/F3-Tel-EGFR D896N和Ba/F3-Tel-EGFR L858R細胞計數(shù)后,各取1×106個/孔6孔板鋪板,均加入吉非替尼,濃度梯度設(shè)置為0、50、100、250、500、1 000 nmol/L。加藥后將細胞置于37 ℃、5% CO2孵箱中培養(yǎng)0.5 h后,收集細胞裂解,離心后收集蛋白上清液,制樣。濃縮膠120 V電泳30 min后,分離膠80 V電泳1 h,100 V恒壓轉(zhuǎn)膜,5%濃度的脫脂牛奶封閉1 h,以EGFR、p-EGFR抗體為一抗,4 ℃孵育過夜。次日TBST洗膜3遍,加兔二抗,室溫孵育1 h,再次TBST洗膜3遍后曝光顯影。ImageJ處理條帶后,通過GraphPad計算獲得各組半數(shù)抑制濃度(50% inhibitory concentration,IC50)值。
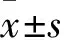
2 結(jié)果
2.1重組慢病毒載體構(gòu)建與鑒定酶切驗證后對重組質(zhì)粒進行測序,并與NCBI基因庫中的EGFR基因序列比對,突變位點正確無誤,質(zhì)粒構(gòu)建成功(圖1)。
2.2Ba/F3-Tel-EGFRD896N細胞株構(gòu)建與驗證提取總蛋白,Western blot 結(jié)果顯示穩(wěn)定轉(zhuǎn)染的細胞中有明顯的EGFR及p-EGFR蛋白的表達,對照組Ba/F3細胞中則無EGFR及p-EGFR蛋白的表達,Ba/F3-Tel-EGFR D896N細胞株轉(zhuǎn)染構(gòu)建成功(圖2)。

圖1 重組質(zhì)粒點突變測序報告

圖2 Western blot檢測穩(wěn)轉(zhuǎn)細胞內(nèi)EGFR和P-EGFR的表達A:對照組BA/F3細胞中EGFR、P-EGFR蛋白的表達;B:BA/F3-Tel-EGFR D896N細胞中EGFR、P-EGFR蛋白的表達
2.3撤除IL-3培養(yǎng)Ba/F3-Tel-EGFRL858R及Ba/F3-Tel-EGFRD896N細胞撤除IL-3后Ba/F3-Tel-EGFR D896N細胞無法正常生長,而對照組Ba/F3-Tel-EGFR L858R在不含IL-3的培養(yǎng)液中依然正常生長(圖3)。
2.4吉非替尼處理后Ba/F3-Tel-EGFRL858R和Ba/F3-Tel-EGFRD896N細胞中p-EGFR的表達按梯度將濃度為0、50、100、250、500、1 000 nmol/L的吉非替尼依次加入培養(yǎng)基對細胞進行處理后,兩種細胞中EGFR磷酸化程度均隨吉非替尼濃度增高逐漸降低(圖4)。用ImageJ處理后,通過GraphPad計算獲得各組IC50值,吉非替尼對Ba/F3-Tel-EGFR L858R和Ba/F3-Tel-EGFR D896N的IC50值分別為60.29 nmol/L和48.03 nmol/L,差異無統(tǒng)計學(xué)意義(P=0.076)。見圖5。

圖3 光學(xué)顯微鏡觀察細胞撤除IL-3后的生長情況 ×100A:BA/F3-Tel-EGFR D896N細胞IL-3培養(yǎng)及撤除IL-3培養(yǎng)后4 d細胞生長變化;B:BA/F3-Tel-EGFR L858R細胞IL-3培養(yǎng)及撤除IL-3培養(yǎng)后4 d細胞生長變化

圖4 Western blot檢測吉非替尼處理后Ba/F3-Tel-EGFRL858R和BA/F3-Tel-EGFR D896N細胞中P-EGFR的表達A:BA/F3-Tel-EGFR L858R細胞中EGFR磷酸化程度隨吉非替尼濃度增高發(fā)生的變化;B:BA/F3-Tel-EGFR D896N細胞中EGFR磷酸化程度隨吉非替尼濃度增高發(fā)生的變化;1:0 nmol/L;2:50 nmol/L;3:100 nmol/L;4:250 nmol/L;5:500 nmol/L;6:1 000 nmol/L
3 討論
與傳統(tǒng)的脂質(zhì)體相比,慢病毒載體需要和輔助質(zhì)粒共轉(zhuǎn)染進行病毒包裝后來感染宿主細胞,以達到實驗?zāi)康摹1M管操作上相對復(fù)雜,但是慢病毒轉(zhuǎn)染可將目的基因整合至細胞的染色體DNA中,從而使細胞株長期穩(wěn)定地表達目的蛋白[6]。本實驗選用的Ba/F3細胞,是一種小鼠B淋巴細胞[7]。選用該細胞,一是由于受體酪氨酸激酶途徑在該細胞系中幾乎不存在,因此為實驗轉(zhuǎn)染突變型EGFR,構(gòu)建穩(wěn)定轉(zhuǎn)染的細胞株提供了一個純凈的背景;二是由于其正常的生長和增殖需要依賴一定濃度的IL-3,便于比較其生長和增殖條件的變化[8]。

圖5 Ba/F3-Tel-EGFR L858R細胞和Ba/F3-Tel-EGFRD896N細胞對于吉非替尼敏感性曲線圖
EGFR為胞膜上的受體,與配體結(jié)合后二聚化,從而磷酸化激活下游通路,在細胞的增殖、遷移以及血管生成等方面發(fā)揮重要作用。在不存在酪氨酸激酶系統(tǒng)的Ba/F3細胞中,即使通過轉(zhuǎn)染使其攜帶野生型的EGFR,因為沒有EGF等配體的刺激,細胞中的EGFR即使成功表達也無法被激活,細胞仍然需要依賴IL-3才能正常生長。在肺癌患者中常見的EGFR突變主要有19外顯子的缺失突變和21外顯子上的L858R突變[9]。突變可使EGFR在不依賴配體的情況下發(fā)生自我磷酸化激活下游通路。將此類突變型的EGFR轉(zhuǎn)入Ba/F3細胞,即使細胞內(nèi)不存在使其發(fā)生二聚的配體,因其突變可使EGFR發(fā)生自我磷酸化,從而激活下游的信號通路[10]。因此攜帶突變型EGFR的BA/F3細胞在撤除IL-3后,仍能依賴EGFR及其下游通路正常生長增殖。
TEL全長約300 kb,是一段與白血病發(fā)生相關(guān)的基因[11]。將其插入帶有EGFR序列的載體克隆得Tel-EGFR,轉(zhuǎn)染Ba/F3細胞并表達,EGFR可在不依賴配體的情況下轉(zhuǎn)化為二聚體從而激活下游通路。Wang et al[12]已經(jīng)用這種方法成功完成了一些突變型EGFR相關(guān)的實驗。Tel基因可使EGFR在不需要配體的情況下發(fā)生磷酸化,激活下游通路,從而使Ba/F3細胞在不依賴IL-3的情況下仍然正常生長。因此通過這種方法構(gòu)建攜帶不同突變型EGFR的細胞株,比較不同細胞株中的EGFR磷酸化程度。本實驗即以此方法成功構(gòu)建質(zhì)粒,轉(zhuǎn)染Ba/F3細胞。從結(jié)果來看,Western blot檢測到Ba/F3-Tel-EGFR D896N細胞中表達的EGFR及p-EGFR蛋白,證明細胞內(nèi)EGFR已成功表達并有明顯的磷酸化發(fā)生,但是細胞在撤除IL-3后無法維持正常的生長。研究[13]表明,EGFR含有28個外顯子,其中,18~24外顯子編碼酪氨酸激酶功能區(qū)。根據(jù)NCBI上的EGFR序列查詢,D896N位于EGFR的22外顯子,屬于酪氨酸激酶功能區(qū)。因此,可以合理地猜測,該突變并非驅(qū)動突變,相反地,甚至在一定程度上破壞了EGFR的功能,雖然EGFR仍然能夠發(fā)生磷酸化,已然不足以維持細胞的正常生長。
氨基端小葉(N-lobe,由18~20外顯子編碼),αC螺旋及羧基端小葉(C-lobe,由21~24外顯子編碼)是EGFR的酪氨酸激酶激活區(qū)內(nèi)的3個重要結(jié)構(gòu)。存在于羧基端小葉內(nèi)的活化環(huán)(A-loop),被證實是酪氨酸激酶的活化中心。DFG序列位于A-loop的起始端,具有高度保守性。DCF序列發(fā)生改變會對激酶的活性產(chǎn)生一定影響。常見的L858R突變位于DFG序列后一位,研究[14]證實該突變增加了A-loop的穩(wěn)定性,從而使EGFR對EGFR-TKI的敏感性增加。Western blot結(jié)果表明,Ba/F3-Tel-EGFR D896N在吉非替尼的刺激下EGFR磷酸化程度明顯降低。而D896N位于EGFR的22外顯子,即與L858R同樣位于羧基端小葉。由此可以推測,D896N突變改變了激酶的活性,使EGFR對吉非替尼的敏感性增加。
由于構(gòu)建的Ba/F3-Tel-EGFR D896N細胞無法在撤除IL-3的培養(yǎng)液中正常生長,故無法進行增殖及凋亡實驗來與Ba/F3-Tel-EGFR L858R細胞對照研究,僅能依靠EGFR的磷酸化情況進行初步推測,還需結(jié)合臨床及動物實驗進一步探究考證。

