肌少癥與類風濕關節炎患者病情間的相關性研究
蔡 靜,徐勝前,童 輝,王欣榮,滕玉竹,縱何香,徐建華
肌少癥是一種肌肉質量減少并可能導致軀體功能降低的綜合征,導致肌少癥的因素很多,慢性炎癥是其中較常見的原因之一。類風濕關節炎(rheumatoid arthritis,RA)是一種以慢性滑膜炎為主要特征的自身免疫性、炎癥性疾病,RA患者中各種炎癥性的細胞因子水平如腫瘤壞死因子-α、白細胞介素-1β等的增高可能成為RA患者發生肌少癥的原因[1]。國外有研究顯示RA患者中肌少癥的發生率增高,但具體數據不盡相同;目前尚無中國RA患者中肌少癥發生率的報道,且肌少癥與RA患者病情間的關系尚不明確。
1 材料與方法
1.1病例資料430例RA患者來自2013年4月~2017年12月安徽醫科大學第一附屬醫院風濕免疫科住院部,診斷均符合2010年美國風濕病學會/歐洲抗風濕聯盟關于RA的分類標準[2],其中男77例,女353例;年齡22~87(57.24±12.39)歲;平均體質量(56.74±10.85)kg,平均身高(1.59±0.07)m。156例正常健康人作為對照組,均來自我院體檢中心,其中男30例,女126例,年齡27~81(56.8±11.6)歲,平均體質量(57.19±11.05)kg,平均身高(1.59±0.08)m。兩組研究對象具有良好的可比性,組間年齡、體質量、身高和性別構成差異均無統計學意義(P>0.05)。本研究得到安徽醫科大學倫理委員會的批準(批準文號:20121090),所有研究對象參與本研究前簽署了書面知情同意書。
1.2臨床資料記錄由風濕免疫科專科醫師詳細檢查并記錄RA患者的一般項目:年齡、性別、病程等;疾病相關的臨床和實驗室指標:關節壓痛數、關節腫脹數、紅細胞沉降率(erythrocyte sedimentation rate,ESR)、C-反應蛋白(C reactive protein,CRP)、類風濕因子(rheumatoid factors,RF)、抗環瓜氨酸肽抗體(cycli-citrullinated peptide,CCP)等,采用酶聯免疫吸附測定346例RA患者血清25-(OH)D水平,計算基于28個關節的疾病活動性積分(disease activity scores 28,DAS28),采用健康評價問卷(health assessment questionnaire,HAQ)積分進行日常生活能力評估,判斷關節功能(分Ⅰ、Ⅱ、Ⅲ、Ⅳ期),攝雙手X線片,并進行分期(分Ⅰ、Ⅱ、Ⅲ、Ⅳ期),同時由兩名放射科醫師采用盲法對雙手X線片進行Sharp評分。
1.3肌肉質量測定及肌少癥判斷標準采用直接節段多頻率生物電阻抗測試法(DSM-BIA法,韓國Inbody720人體成分分析儀)測量所有研究對象各部位和總骨骼肌肉量。計算骨骼肌質量指數(Skeletal muscle mass index,SMI):骨骼肌質量(kg)/身高(m)2,以SMI低于相應族群青年人平均值2個標準差作為診斷肌少癥的標準[3]。
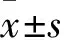
2 結果
2.1RA患者和正常對照組間肌少癥的發生情況RA患者組平均SMI水平明顯低于正常對照組(P<0.000 1),RA組符合肌少癥診斷患者236例,肌少癥發生率為54.9%,明顯高于對照組中肌少癥的發生率9.0%(14/156,P<0.000 1),見表1。
2.2RA患者中有、無肌少癥組間相關疾病指標的比較將RA患者有、無發生肌少癥分為兩組,結果顯示肌少癥RA組患者的年齡、病程、女性占比、HAQ評分、ESR、DAS28、Sharp評分均明顯高于無肌少癥RA組(P<0.05~0.0001),肌少癥RA組患者血清25-(OH)D水平明顯低于無肌少癥RA組(P<0.0001);RA患者中有、無肌少癥組間關節功能和關節X線片分期構成比亦有明顯差異(P<0.05~0.000 1)。見表2。
2.3RA患者中低-中活動度、高活動度組間肌少癥的比較根據疾病活動度DAS28的分類標準將RA分為低-中活動組(DAS28≤5.1)和高活動組(DAS28>5.1)[4];如表3所示:RA患者高活動組SMI、右上肢肌肉量、左上肢肌肉量、軀干肌肉量均明顯低于低-中活動度組(P<0.05~0.000 1),而兩組間骨骼肌量、右下肢肌肉量和左下肢肌肉量水平無明顯差異(P>0.05)。RA患者高活動組肌少癥發生率(59.4%)則明顯高于低-中活動度組(47.8%),差異有統計學意義(χ2=5.256,P=0.022)。

表1 RA患者和正常對照組間SMI和肌少癥發生率的比較

表2 RA患者中有、無肌少癥組間相關疾病指標的比較

表3 RA患者中低-中活動度、高活動度組間肌肉量的比較

表4 RA患者中發生肌少癥的多元回歸分析
2.4RA患者中SMI與各疾病指標間的相關性RA患者中SMI與年齡(rs=-0.180,P<0.000 1)、病程(rs=-0.210,P<0.000 1)、關節功能(rs=-0.172,P<0.000 1)、關節X線片分期(rs=-0.279,P<0.000 1)、HAQ(rs=-0.205,P<0.000 1)、ESR(rs=-0.130,P=0.008)、DAS28(rs=-0.106,P=0.033)和Sharp評分(rs=-0.363,P<0.000 1)均呈負直線相關,SMI與血清25-(OH)D水平呈負直線相關關系(rs=0.163,P<0.000 1),與其他指標間無相關性(P>0.05)。
2.5RA患者發生肌少癥的Logistic回歸分析以年齡、性別(1=男,2=女)、病程、HAQ積分、DAS28積分、血清25-(OH)D水平、關節功能和雙手X線片分期為自變量,以RA患者是否發生肌少癥(0=無,1=有)為應變量,采用Logistic Regression分析RA患者發生肌少癥的影響因素,結果顯示:年齡(P=0.001)、性別(P<0.0001)、DAS28(P=0.018)和X線片分期(P=0.028)均為RA患者發生肌少癥的危險因素,見表4。
3 討論
肌少癥可以理解為肌肉減少癥,2010 年老年肌少癥歐洲工作組 (EWGSOP )[5]和2011年國際肌少癥會議工作組 (ISCCWG )[6]對肌少癥的定義為骨骼肌質量低下或肌肉力量降低或肌肉的功能減退。現階段有關肌少癥的國內外研究主要集中于內分泌代謝病和骨質疏松癥等領域。2013年Verschueren et al[7]研究結果顯示肌少癥患者骨質疏松的發生風險是無肌少癥者的3倍。2016年,吳佳佳 等[8]研究發現:糖尿病組肌少癥發生率(24.2%)高于對照組(11.7%),病程越長的糖尿病患者中肌少癥的發病率越高。可見,肌少癥發生與糖尿病、骨質疏松等有一定聯系。2017年麻璨琛 等[9]研究結果顯示RA患者肌少癥的發生、年齡和病程是RA患者發生骨質疏松的危險因素。但有關RA患者中肌少癥與病情之間的相關性研究,國內尚無相關文獻。


血清25-(OH)D水平是公認的反映體內維生素D狀態的指標, 2014年本課題組的研究顯示:血清25-(OH)D水平與RA患者的疾病活動性指標如關節腫脹數、關節壓痛數、晨僵時間、ESR和HAQ均呈顯著負直線相關[13]。2017年本課題組還報道血清25-(OH)D水平與RA患者的骨質疏松有關[9];且血清25-(OH)D水平降低也與RA患者的骨質疏松性骨折發生有關[14]。血清25-(OH)D水平與RA患者肌少癥間的相關性研究少有報道,本研究顯示伴發肌少癥的RA組患者血清25-(OH)D水平明顯低于無肌少癥RA組,且RA患者SMI水平與血清25-(OH)D水平呈顯著正直線相關;這提示血清25-(OH)D也可能是RA患者發生肌少癥的一個不可忽視的內在原因。
綜上所述,我國RA人群肌少癥患病率明顯增高,除了高齡和長病程與RA患者的肌少癥發生有關外,肌少癥的發生與RA患者的病情是也密切相關的,此外,血清25-(OH)D水平與RA患者肌少癥間的內在聯系也值得進一步深入的研究。在規范而有效地治療RA策略中,應重視關節與骨骼以外的肌肉病變的存在和處理,從而更全面地改善和控制RA的病情,最大限度地改善RA患者的生活質量。

