銅金屬配合物和質(zhì)子酸在可見光下催化喹啉與異喹啉的偶聯(lián)反應
張金相 ,王 琳 ,武可書 ,劉 鯤 ,王 斌
(1.天津師范大學化學學院,天津300387;2.天津師范大學無機-有機雜化功能材料化學教育部重點實驗室,天津300387;3.天津師范大學天津市功能分子結(jié)構(gòu)與性能重點實驗室,天津300387)
喹啉和異喹啉類化合物是很多有生物活性的天然產(chǎn)物和藥物的基本骨架,廣泛應用于治療瘧疾、抗癌藥物等的生產(chǎn)[1-3].因此,合成含有各種取代基的喹啉和異喹啉類化合物對于新藥研發(fā)有重大意義[4-7],也逐漸成為有機化學研究的前沿領(lǐng)域之一[8-10].近年來,可見光誘導下的金屬催化有機反應備受關(guān)注,相對于傳統(tǒng)的有機催化化學反應(如加熱方法),可見光誘導的反應能量來源清潔廉價,裝置簡便,反應條件溫和可控,能夠滿足化學未來發(fā)展趨勢中對于環(huán)境友好型和可持續(xù)利用的要求[11-14].如Condie等[1]報道了一種氧化偶聯(lián)方法,通過可見光作用實現(xiàn)了芳基叔胺和硝基烷烴的反應.在催化劑使用方面,相對于傳統(tǒng)貴金屬(如:銠,釕,鈀,銥等)化合物催化劑,金屬銅配合物具有價格低廉、毒性低、來源豐富等優(yōu)點[15-17],近年來被廣泛應用于有機合成領(lǐng)域.
為了探究可見光誘導下的金屬銅配合物催化有機反應方法在喹啉和異喹啉類化合物合成上的應用,本研究使用 2,9-二甲基-4,7-二苯基-1,10-鄰菲啰啉碳硼烷雙二苯基膦一價銅配合物(Cu1)和質(zhì)子酸作為雙催化劑,在可見光誘導下,成功催化了2-甲基喹啉類化合物和N-苯基四氫異喹啉類化合物的交叉脫氫偶聯(lián)反應.為了得到較高收率,本研究對Cu1的用量、酸的種類及用量、溶劑的種類及用量、反應時間等條件進行了篩選,為喹啉和異喹啉類的偶聯(lián)反應合成新型化合物提供了實驗依據(jù).
1 實驗
1.1 儀器與試劑
儀器:Mercury400MHz型核磁共振儀,美國Varian公司;Yanaco-241型顯微熔點測定儀,北京世紀科信儀器公司.
試劑:1,2-二碳十硼烷,梯希愛(上海)化成工業(yè)發(fā)展有限公司;二苯基氯化膦,天津希恩思生化科技有限公司;2-甲基喹啉類化合物,薩恩化學技術(shù)(上海)有限公司.所有試劑均為分析純.
光催化劑 2,9-二甲基-4,7-二苯基-1,10-鄰菲啰啉碳硼烷雙二苯基膦一價銅配合物(Cu1)按照文獻[18]的方法合成,四氫異喹啉類原料按照文獻[19]的方法制備.
1.2 實驗步驟
1.2.1 2-甲基喹啉和四氫異喹啉合成反應條件的篩選
2-甲基喹啉和四氫異喹啉偶聯(lián)反應的實驗步驟:在50 mL的Schlenk瓶中加入一定量的光催化劑Cu1、間甲基苯甲酸(或其他酸類)、2-甲基喹啉或其衍生物、N-苯基四氫異喹啉或其衍生物、溶劑(甲醇與乙腈或二氯甲烷混合物).反應體系充滿氧氣,距離反應瓶2 cm處放置3.5 W的LED白光燈帶.反應完成后將溶劑去除,通過硅膠柱層析色譜方法進行分離,獲得相應的脫氫偶聯(lián)產(chǎn)物.2-甲基喹啉和N-苯基四氫異喹啉脫氫偶聯(lián)反應方程式如圖1所示.反應體系中,2-甲基喹啉的物質(zhì)的量為0.4 mmol,N-苯基四氫異喹啉為0.2 mmol,對Cu1的用量、溶劑的種類及用量、酸的種類及用量以及反應時間進行篩選,最終得出最佳反應條件.
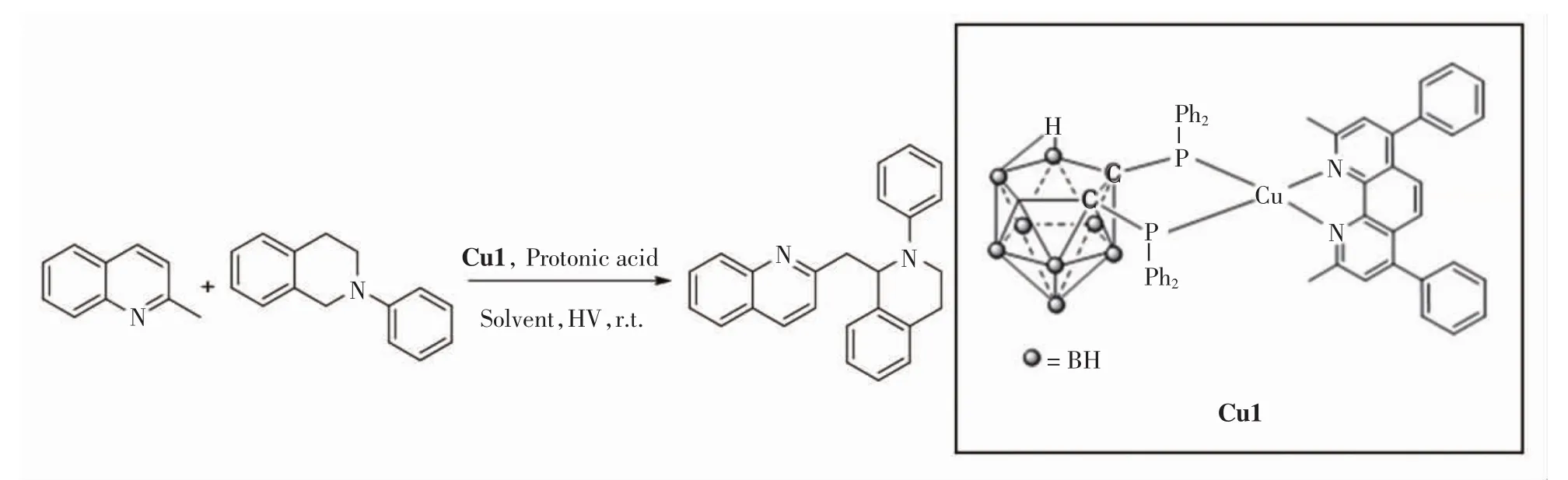
圖1 2-甲基喹啉與對N-苯基四氫異喹啉的化學反應方程式Fig.1 Chemical reaction formula of 2-methylquinoline with N-phenyl-tetrahydroisoquinoline
另外,在其他條件不變的情況下,一方面以空氣為反應氣體環(huán)境,考察氣體環(huán)境對該反應的影響;另一方面,在避光環(huán)境下進行反應,考察光照對該反應的影響.
1.2.2 實驗底物的擴展
選用2-甲基喹啉及衍生物和N-苯基四氫異喹啉及衍生物為底物,使用Cu1和質(zhì)子酸作為雙催化劑,在1.2.1中得到的最佳條件下催化脫氫偶聯(lián)反應,得到不同種類的脫氫偶聯(lián)產(chǎn)物.化學反應通式如圖2所示.
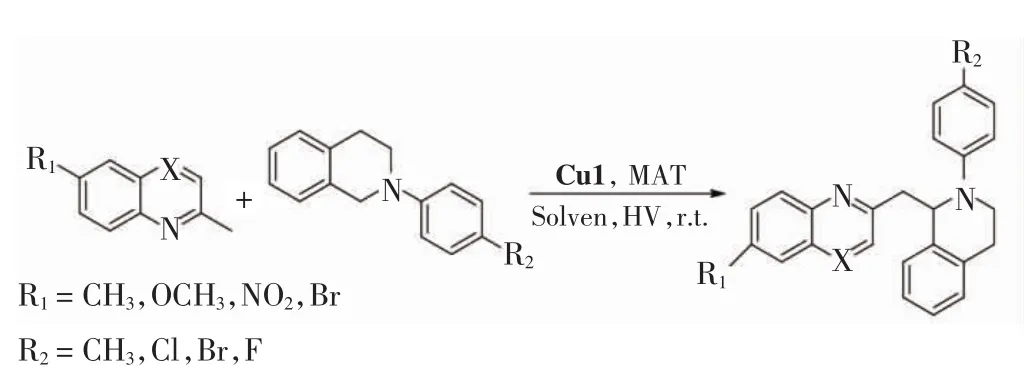
圖2 2-甲基喹啉和N-苯基四氫異喹啉脫氫偶聯(lián)反應通式Fig.2 General dehydrogenation coupling reaction formula of 2-methylquinoline with N-phenyl-tetrahydroisoquinoline
1.2.3 對產(chǎn)物的表征
使用顯微熔點測定儀與核磁共振儀分別對15種反應產(chǎn)物的熔點和1H NMR進行測定,通過對表征數(shù)據(jù)的分析確定產(chǎn)物結(jié)構(gòu).
2 結(jié)果與分析
2.1 Cu1光催化2-甲基喹啉與N-苯基四氫異喹啉偶聯(lián)反應條件的篩選
反應體系中,2-甲基喹啉固定為0.4 mmol,N-苯基四氫異喹啉為0.2 mmol,用氧氣作為氣體氛圍,對Cu1的用量、酸的種類及用量、溶劑的種類及用量以及反應時間進行篩選,不同條件下產(chǎn)物的產(chǎn)率如表1所示.
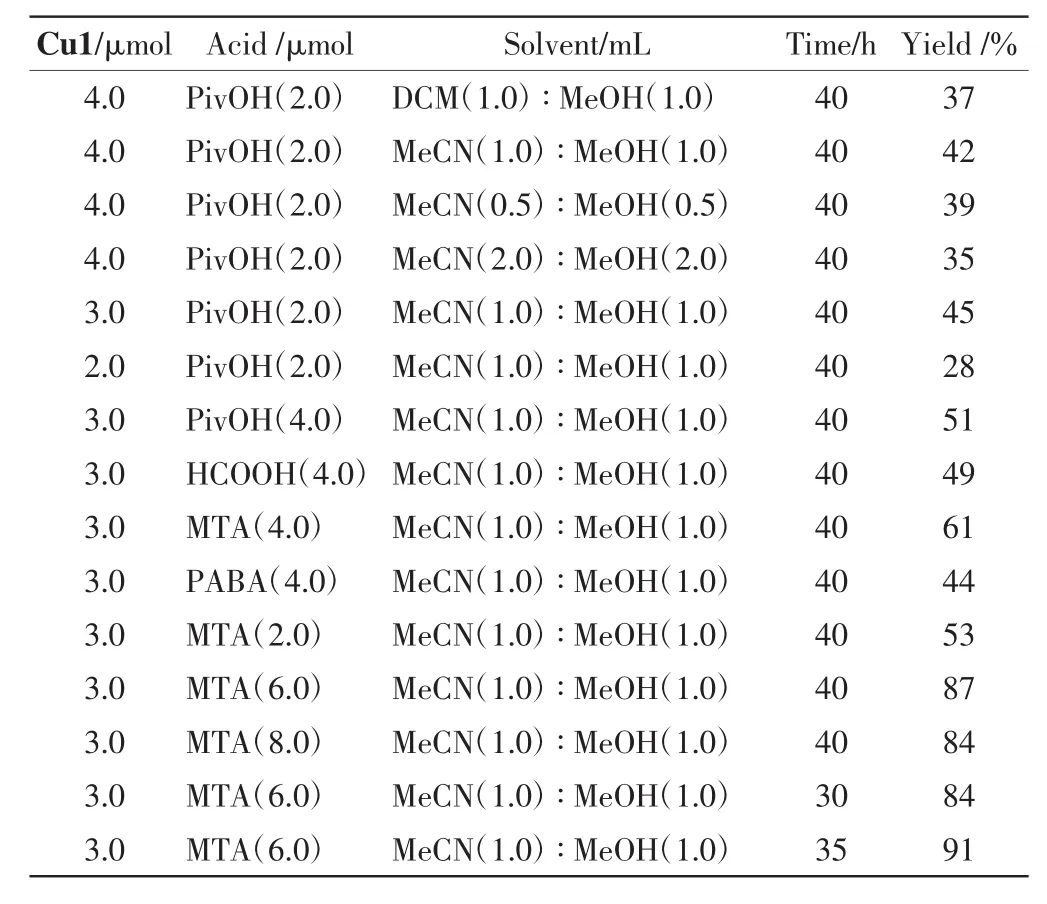
表1 不同條件下2-甲基喹啉與N-苯基四氫異喹啉反應的產(chǎn)率Tab.1 Yield of 2-methylquinolinereacted with N-phenyltetrahydroisoquinoline under different conditions
由表1可以看出,最佳條件:Cu1的物質(zhì)的量為3.0 μmol,酸的種類為間甲基苯甲酸(MTA),其用量為6.0 μmol,溶劑為甲醇(MeOH)與乙腈(MeCN)的等體積混合物(各1.0mL),在氧氣氛圍下,3.5W的LED白光燈光照35 h,產(chǎn)物的產(chǎn)率最大,為91%.
在反應氣體環(huán)境的對照實驗中,當其他反應條件相同、氣體環(huán)境為氧氣時,反應產(chǎn)率為60.9%,而氣體環(huán)境為空氣時,反應產(chǎn)率僅為5.1%,因此氧氣環(huán)境有利于反應進行.反應在避光環(huán)境中進行時,產(chǎn)率僅為20%,因此認為,該反應中可見光源是必不可少的.
2.2 Cu1光催化不同取代基的2-甲基喹啉與N-苯基四氫異喹啉反應
在最優(yōu)條件下,以不同取代基的2-甲基喹啉和N-苯基四氫異喹啉作為反應底物,最終合成了15種化合物,產(chǎn)率如表2所示.

表2 帶有不同取代基的2-甲基喹啉與N-苯基四氫異喹啉反應及產(chǎn)率Tab.2 Products and yield of reactions of 2-methylquinoline with N-phenyl-tetrahydroisoquinoline having different substituents
在連有不同取代基的2-甲基喹啉與N-苯基四氫異喹啉反應結(jié)果中,當R1為供電子基團時(甲基和甲氧基)產(chǎn)率分別為71%與64%(分別對應產(chǎn)物b和e),當R1為受電子基團時(硝基和溴)產(chǎn)率均為57%(分別對應產(chǎn)物c和d),因此當R1為供電子基團時有利于反應進行.當R2分別為甲基、氟、氯、溴時,相應的產(chǎn)率分別為77%、58%、77%和66%(對應產(chǎn)物分別為g、o、k和j),即R2為甲基和氯時反應產(chǎn)率較高.
化合物a:白色固體.m.p.119~121℃.1H NMR(400 MHz,CDCl3,TMS)δ8.14 (d,J=8.3 Hz,1H),7.95(d,J=8.3 Hz,1H),7.78(m,2H),7.51(t,J=7.6 Hz,1H),7.16(m,4H),7.08(d,J=8.0 Hz,1H),7.01(m,1H),6.95(d,J=8.0 Hz,2H),6.88(d,J=7.5 Hz,1H),6.67(t,J=7.2 Hz,1H),5.47(t,J=6.9 Hz,1H),3.82(m,1H),3.72(m,1H),3.36(m,1H),3.15(m,1H),2.95(m,1H).表征結(jié)果與文獻[9]中一致.
化合物b:白色固體.m.p.123~125℃.1H NMR(400 MHz,CDCl3,TMS)δ8.06(d,J=8.5 Hz,1H),7.88(d,J=8.3 Hz,1H),7.58(m,2H),7.20(m,4H),7.05(m,2H),6.96(d,J=8.3 Hz,2H),6.88(d,J=7.5 Hz,1H),6.68(t,J=7.1 Hz,1H),5.47(t,J=6.9 Hz,1H),3.84(m,1H),3.72(m,2H),3.36(m,1H),3.18(m,1H),2.96(m,1H).表征結(jié)果與文獻[9]中一致.
化合物c:白色固體.m.p.131~133℃.1H NMR(400 MHz,CDCl3,TMS)δ8.02 (d,J=8.9 Hz,1H),7.91 (d,J=2.1 Hz,1H),7.85 (d,J=8.4 Hz,1H),7.78(d,J=8.9 Hz,1H),7.18(m,4H),7.08(d,J=8.4 Hz,1H),7.01(m,1H),6.91(d,J=8.1 Hz,2H),6.84(d,J=7.6 Hz,1H),6.69(t,J=7.2 Hz,1H),5.43(t,J=7.0 Hz,1H),3.81(m,1H),3.71(m,2H),3.38(m,1H),3.16(m,1H),2.95(m,1H).表征結(jié)果與文獻[9]中一致.
化合物d:黃色固體.m.p.156~158℃.1H NMR(400 MHz,CDCl3,TMS)δ8.72(s,1H),8.49(d,J=9.2 Hz,1H),8.25(d,J=9.2 Hz,1H),8.11(d,J=8.4 Hz,1H),7.21 (m,5H),7.05 (m,1H),6.92(m,3H),6.70(t,J=7.2 Hz,1H),5.50(t,J=7.0 Hz,1H),3.82(m,1H),3.73(m,2H),3.41(m,1H),3.17(m,1H),2.97(m,1H).表征結(jié)果與文獻[9]中一致.
化合物 e:白色固體.m.p.52~54℃.1H NMR(400 MHz,CDCl3,TMS)δ8.44(s,1H),8.14(d,J=8.3 Hz,1H),8.06(d,J=8.0 Hz,1H),7.78(m,2H),7.18(m,4H),7.07(m,1H),6.92(m,3H),6.70(t,J=7.2 Hz,1H),5.43(t,J=7.0 Hz,1H),3.83(m,1H),3.71(m,2H),3.41(m,1H),3.15(m,1H),2.94(m,1H).表征結(jié)果與文獻[9]中一致.
化合物f:白色固體.m.p.121~123℃.1H NMR(400 MHz,CDCl3,TMS)δ8.05(d,J=9.2 Hz,1H),7.86(d,J=8.4 Hz,1H),7.38(m,1H),7.16(m,4H),7.04(m,3H),6.93(d,J=8.3 Hz,2H),6.87(d,J=7.6 Hz,1H),6.68(t,J=7.2 Hz,1H),5.42(t,J=7.0 Hz,1H),3.92(m,3H),3.82(m,1H),3.72(m,2H),3.33(m,1H),3.16(m,1H),2.95(m,1H).表征結(jié)果與文獻[9]中一致.
化合物g:白色固體.m.p.105~106℃.1H NMR(400 MHz,CDCl3,TMS)δ8.14(d,J=8.4 Hz,1H),7.97(d,J=8.3 Hz,1H),7.77(m,2H),7.52(t,J=7.3 Hz,1H),7.14(m,3H),7.03(m,1H),6.97(d,J=8.4 Hz,2H),6.91(d,J=7.6 Hz,1H),6.84(d,J=8.4 Hz,2H),5.41(t,J=7.0 Hz,1H),3.79(m,1H),3.71(m,2H),3.37(m,1H),3.15(m,1H),2.89(m,1H),2.19(s,3H).表征結(jié)果與文獻[9]中一致.
化合物h:白色固體.m.p.105~107℃.1H NMR(400 MHz,CDCl3,TMS)δ8.03(d,J=8.5 Hz,1H),7.88(d,J=8.4 Hz,1H),7.56(m,2H),7.14(m,2H),7.07(d,J=8.4 Hz,1H),7.03(m,3H),6.89(d,J=7.6 Hz,1H),6.83(d,J=8.6 Hz,2H),5.38(t,J=7.1 Hz,1H),3.80(m,1H),3.70(m,2H),3.35(m,1H),3.15(m,1H),2.89(m,1H),2.53(s,3H),2.19(s,3H).表征結(jié)果與文獻[10]中一致.
化合物 i:白色固體.m.p.106~109℃.1H NMR(400 MHz,CDCl3,TMS)δ8.06(d,J=9.0 Hz,1H),7.97(m,1H),7.91(s,1H),7.87(d,J=8.4 Hz,1H),7.79 (d,J=8.9 Hz,1H),7.14 (d,J=3.5 Hz,2H),7.04(m,1H),6.94(t,J=8.0 Hz,3H),6.79(d,J=8.6 Hz,2H),5.38(t,J=7.0 Hz,1H),3.79(m,1H),3.70(m,2H),3.39(m,1H),3.14(m,1H),2.87(m,1H),2.18(s,3H).表征結(jié)果與文獻[10]中一致.
化合物 j:白色固體.m.p.155~157℃.1H NMR(400 MHz,CDCl3,TMS)δ8.16(d,J=8.4 Hz,1H),7.96(d,J=8.3 Hz,1H),7.77(m,2H),7.53(t,J=7.8 Hz,1H),7.20(m,4H),7.04(d,J=8.3 Hz,2H),6.90 (d,J=7.5 Hz,1H),6.81 (d,J=8.9 Hz,2H),5.44(t,J=7.0 Hz,1H),3.78(m,1H),3.65(m,1H),3.36(m,1H),3.13(m,1H),2.96(m,1H).表征結(jié)果與文獻[9]中一致.
化合物k:白色固體.m.p.158~160℃.1H NMR(400 MHz,CDCl3,TMS)δ8.19(d,J=8.3 Hz,1H),7.99(d,J=8.3 Hz,1H),7.80(m,2H),7.55(t,J=7.2 Hz,1H),7.19(d,J=2.8 Hz,2H),7.10(m,4H),6.93(m,3H),5.46(t,J=6.8 Hz,1H),3.81(m,1H),3.66(m,2H),3.39(m,1H),3.17(m,1H),2.97(m,1H).表征結(jié)果與文獻[9]中一致.
化合物 l:白色固體.m.p.174~175℃.1H NMR(400 MHz,CDCl3,TMS)δ8.03 (d,J=8.5 Hz,1H),7.87(d,J=8.3 Hz,1H),7.57(m,2H),7.16(m,2H),7.07(m,4H),6.88(d,J=7.6 Hz,1H),6.84(d,J=9.0 Hz,2H),5.40(t,J=7.0 Hz,1H),3.78(m,1H),3.65(m,2H),3.34(m,1H),3.16(m,1H),2.95(m,1H).表征結(jié)果與文獻[10]中一致.
化合物m:白色固體.m.p.146~147℃.1H NMR(400 MHz,CDCl3,TMS)δ8.01 (d,J=8.9 Hz,1H),7.91(d,J=2.1 Hz,1H),7.86(d,J=8.4 Hz,1H),7.80(m,1H),7.17(m,2H),7.08(m,4H),6.86(d,J=7.6 Hz,1H),6.82(d,J=9.0 Hz,2H),5.39(t,J=7.0 Hz,1H),3.77(m,1H),3.64(m,2H),3.33(m,1H),3.12(m,1H),2.95(m,1H).表征結(jié)果與文獻[10]中一致.
化合物n:黃色固體.m.p.173~174℃.1H NMR(400 MHz,CDCl3,TMS)δ8.72(s,1H),8.49(d,J=9.2 Hz,1H),8.23 (d,J=9.2 Hz,1H),8.11 (d,J=8.4 Hz,1H),7.18(m,3H),7.07(m,3H),6.86(m,3H),5.44(t,J=7.0 Hz,1H),3.77(m,1H),3.68(m,2H),3.38(m,1H),3.16(m,1H),2.97(m,1H).表征結(jié)果與文獻[10]中一致.
化合物o:白色固體.m.p.154~156℃.1H NMR(400 MHz,CDCl3,TMS)δ8.14(d,J=8.4 Hz,1H),7.98(d,J=8.3 Hz,1H),7.79(m,2H),7.54(t,J=7.6 Hz,1H),7.17(d,J=4.0 Hz,2H),7.09(m,2H),6.92(d,J=7.6 Hz,1H),6.86(m,4H),5.40(t,J=6.9 Hz,1H),3.81(m,1H),3.65(m,2H),3.37(m,1H),3.14(m,1H),2.93(m,1H).表征結(jié)果與文獻[9]中一致.
3 討論與結(jié)論
本研究以可見光為能量來源,以廉價易得且對環(huán)境友好的金屬銅配合物(2,9-二甲基-4,7-二苯基-1,10-鄰菲啰啉碳硼烷雙二苯基膦一價銅配合物,Cu1)和間甲基苯甲酸為雙催化劑,催化喹啉類和異喹啉類的C—H交叉脫氫偶聯(lián)反應.根據(jù)文獻[9-10,20]的報道,推斷本研究的反應機理為:在可見光條件下,Cu1與間甲基苯甲酸組成的雙催化劑促使異喹啉類物質(zhì)與喹啉類物質(zhì)形成C(sp3)—C(sp3)鍵,其中,間甲基苯甲酸將喹啉類物質(zhì)轉(zhuǎn)變?yōu)楦佑H核的烯胺,Cu1在氧氣存在下使異喹啉類物質(zhì)變?yōu)橛H電子的亞胺離子,二者發(fā)生偶聯(lián)反應,生成新的化合物.本研究首先以一種喹啉類(2-甲基喹啉)和一種異喹啉類(N-苯基四氫異喹啉)為底物,篩選出最優(yōu)反應條件.在此條件下,選用帶有不同取代基的2-甲基喹啉和N-苯基四氫異喹啉作為反應底物,成功合成了15種化合物.與文獻[9-10]相比,本研究以可見光代替?zhèn)鹘y(tǒng)的加熱方法,以Cu1和間甲基苯甲酸取代氧代哌啶銨鹽為催化劑,反應條件溫和可控,能源和催化劑成本低廉,同樣獲得了較高的收率.

