青、紅花椒提取物體外抗氧化性質分析
陳靜,陳志宏,張汆*,張玉龍
(1.滁州職業技術學院 食品與環境工程系,安徽 滁州 239000;2.滁州學院 生物與食品工程學院,安徽 滁州 239000)
花椒(ZanthoxylumbungeanumMaxim.),又稱為山椒,蕓香科植物,是一種重要的香辛料,具有增香去腥的作用,在食品加工中應用廣泛[1]。花椒中含有花椒揮發油、生物堿、黃酮、植物甾醇、多糖以及維生素等多種生物活性物質,有一定的防腐抑菌、抗氧化、提高免疫力、抗感染、抗潰瘍、抗腫瘤等功效[2-4]。花椒可分為青椒和紅椒2種,青椒多產自南方,而紅椒在北方居多。2種花椒不僅在外觀上有較大差異,在風味和組分方面也有一定差別[5]。
花椒中富含各種揮發油、黃酮和多酚等生理活性組分,對這些組分的分離提取也是目前研究的主要內容之一。花椒中提取的揮發油對3種腫瘤細胞生長都表現出抑制作用,顯示出一定的體外抗腫瘤活性[6]。此外,花椒揮發油對人HePG2肝癌細胞也具有一定的殺傷力[7]。不同溶劑提取的花椒精油在顏色和氣味等方面有明顯差異,乙醚提取精油表現出最強的抗菌活性[8]。宋麗雅等[9]研究發現花椒中提取的有效成分對金黃色葡萄球菌、大腸桿菌等微生物均表現出較好的抑菌活性。狄科等[10]研究發現,采用丙酮提取的花椒多酚具有較好的DPPH·清除能力。花椒水提物可有效抑制小鼠胃潰瘍,醚提物對鹽酸性大鼠胃潰瘍的形成有一定抑制作用[11]。
以青、紅花椒為研究對象,分別采用水、50%乙醇和無水乙醇作為提取溶劑制備花椒提取物,對這2種花椒提取物的體外抗氧化性質進行了分析和比較,通過研究,為花椒作為肉制品天然保鮮劑的應用提供了一定的理論依據。
1 材料與方法
1.1 試驗材料與儀器設備
1.1.1 材料
青花椒(藤椒)、紅花椒(漢源):均購于四川。2種花椒樣品經干燥后粉碎(過40目篩),即得青花椒粉和紅花椒粉。
1.1.2 儀器設備
中草藥粉碎機 天津市泰斯特儀器有限公司;SHB-Ⅲ循環水式多用真空泵 鄭州長城科工貿有限公司;RE-85Z旋轉蒸發器 鄭州凱鵬實驗儀器有限公司;KQ-100DB型數控超聲波清洗器 昆山市超聲儀器有限公司;LGJ-10B真空冷凍干燥機 北京四環科學儀器廠有限公司;721E型可見分光光度計 上海光譜儀器有限公司。
1.1.3 試驗試劑
鐵氰化鉀、三氯化鐵(CR)、亞油酸、抗壞血酸、吐溫-20(CR)、硫氰酸銨、無水對氨基苯磺酸、鹽酸萘乙二胺、無水乙醇、亞硝酸鈉等試劑:均為分析純,購自國藥集團(上海)化學試劑公司;DPPH·(1,1-二苯基-2-苦肼基自由基,1,1-Dipheny1-2-Picrylhydrazyl Free Radical):純度>97.0%,購自梯希愛(上海)化成工業發展有限公司。
1.2 試驗方法
1.2.1 花椒提取物制備
無水乙醇提取物(簡稱為E-100)的制備:分別稱取20 g青、紅花椒粉于燒杯中,加入100 mL無水乙醇溶解,超聲波輔助浸提30 min后抽濾,殘渣用無水乙醇重復提取1次,合并提取液,真空濃縮后冷凍干燥,即得花椒無水乙醇提取物。
50%乙醇提取物(簡稱為E-50)的制備:于乙醇提取后的殘渣中加入100 mL 50%乙醇水溶液,重復上述提取流程,所得提取液濃縮后冷凍干燥,即得花椒50%乙醇提取物。
水提取物(簡稱為E-W)的制備:50%乙醇水溶液提取后的殘渣中加入100 mL水,重復上述提取流程,所得提取液濃縮后冷凍干燥,即得花椒水提取物[12]。
1.2.2 總還原力的測定
將花椒提取物分別配制成0.3,0.4,0.5,0.6,0.7 mg/mL的溶液。準確吸取各溶液2.5 mL于試管內,分別加入2.5 mL 0.2 mol/L磷酸鹽緩沖溶液(pH 6.6)和1%鐵氰化鉀溶液,50 ℃水浴保溫20 min后迅速冷卻,之后再加2.5 mL 10%醋酸溶液,3000 r/min離心10 min。取上清液2.5 mL,依次加2.5 mL蒸餾水和0.5 mL 0.1%三氯化鐵溶液,混勻,靜置10 min,于700 nm處測定其吸光度值A。按照上述方法同時測定不同濃度的抗壞血酸(VC)溶液總還原力[13,14]。不同濃度下VC溶液總還原力的測定同上。
1.2.3 DPPH·清除能力的測定
將花椒提取物分別配制成0.5,1.0,1.5,2.0,2.5 mg/mL的溶液。取2支試管,1支加1.0 mL0.2 mmol/L DPPH·-乙醇溶液,另1支加1.0 mL0.2 mmol/L DPPH·-乙醇溶液和0.2 mL樣品溶液,用無水乙醇定容至5.0 mL。室溫避光靜置30 min后在517 nm處測定吸光值,分別記作A0和A1,各樣品平行測定3次后取平均值[15-17]。樣品溶液的DPPH·清除率計算公式為:
清除率(%)=(1-A1/A0)×100。
不同濃度下VC溶液DPPH·清除能力的測定同上。
1.2.4 脂質過氧化抑制能力測定
將花椒提取物分別配制成0.2,0.4,0.6,0.8,1.0 mg/mL的溶液。準確吸取0.5 mL溶液,與2.5 mL亞油酸乳化液混勻,暗處于37 ℃水浴內保溫24 h,反應后得氧化液。取氧化液0.1 mL,加0.9 mL去離子水,依次加5 mL 75%甲醇溶液,1.0 mL 30%硫氰酸銨溶液和0.02 mol/L硫酸亞鐵溶液,靜置5 min,于510 nm波長處測定其吸光度值A1。以蒸餾水代替樣品同方法測定吸光值A0[18]。
樣品溶液脂質過氧化抑制率計算公式:
IR(%)=(1-A1/A0)×100。
式中:IR為抑制率,%;A1為樣品溶液吸光值;A0為對照溶液吸光值。
不同濃度下VC溶液脂質過氧化抑制能力測定同上。
1.2.5 不同時間條件下樣品抗脂質過氧化活性研究
取脂質過氧化抑制能力較強的樣品配制成1.0 mg/mL樣品溶液,按照上述方法分別測定反應4,8,12,24,26,28,29,30 h時的脂質過氧化抑制率,研究不同時間條件下樣品抗脂質過氧化活性[19]。
1.2.6 對NO2-的清除作用
將花椒提取物分別配制成0.05,0.10,0.15,0.20,0.25 mg/mL的樣品溶液。準確吸取5 μg/mL NaNO2溶液2 mL于50 mL容量瓶中,加5 mL樣品溶液反應10 min,再加入2 mL 0.4%對氨基苯磺酸溶液,搖勻,靜置4 min,加1 mL 0.2%鹽酸萘乙二胺溶液,用蒸餾水定容至50 mL,靜置15 min后于538 nm處測吸光度值[20],為A1。以蒸餾水代替樣品同樣方法測定吸光值得A0。
樣品溶液對NO2-的清除率計算公式為:
清除率(%)=(1-A1/A0)×100。
式中:A1為加入樣品溶液時的吸光度值;A0為空白溶液的吸光度值。
不同濃度下VC溶液NO2-的清除率測定同上。
1.2.7 數據處理方法
所有樣品均重復測定3次,最終結果以平均值±標準差表示。采用Excel數據分析軟件對試驗結果進行處理及圖表繪制。
2 結果與分析
2.1 青、紅花椒提取物感官特性
6種青、紅花椒提取物的感官性狀見表1。青、紅花椒無水乙醇提取物帶有花椒特有風味且顏色較深,呈粘稠狀。相比之下,其他2種提取物均為粉末狀,50%乙醇提取物的顏色和氣味要比水提取物更濃。原因可能與花椒中特征風味物質和色素多為脂溶性成分而易溶于乙醇有關。
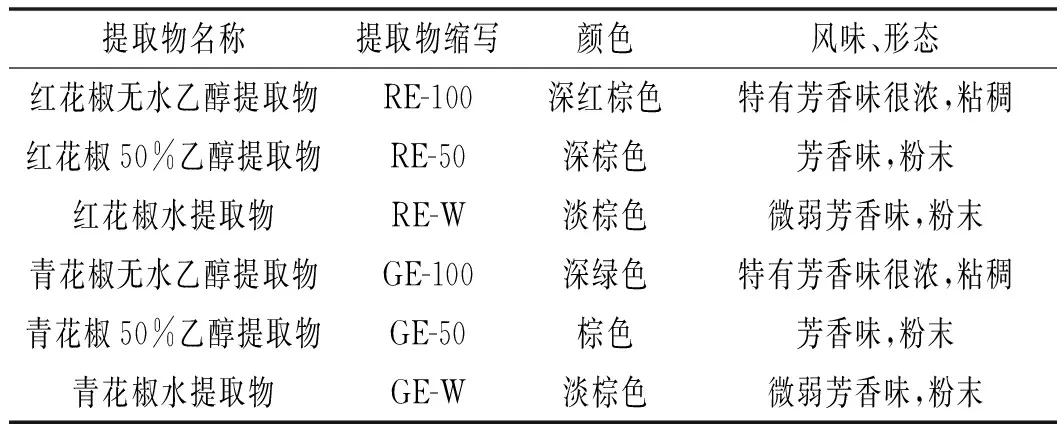
表1 青、紅花椒提取物感官特性Table 1 The sensory properties of green and red peppers' extracts
2.2 總還原能力
總還原力是物質體外抗氧化活性的一個重要指標,主要通過檢驗樣品是否為很好的電子供體,且其供應的電子不僅可以還原三價鐵離子,同時還可以參與自由基反應,使其生成穩定的物質。不同濃度下,青、紅花椒提取物的總還原力結果見圖1。
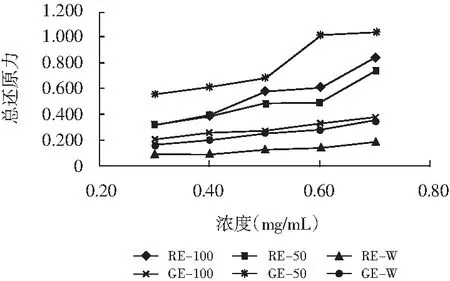
圖1 青、紅花椒提取物總還原力Fig.1 The total reduction capacities of green and red peppers' extracts
由圖1可知,隨著溶液濃度的增加,6種青、紅花椒提取物的總還原力呈現不同程度的增強趨勢。在0.3~0.7 mg/mL范圍內,GE-50還原能力最強,其次是RE-100和RE-50,RE-W還原能力最弱,GE-100和GE-W還原能力比較接近,稍高于RE-W。隨濃度增加,GE-100、GE-W和RE-50的總還原力變化幅度較低,其他3種變幅較大,呈現較明顯的劑量效應。
2.3 DPPH·清除活性
不同濃度條件下,青、紅花椒提取物的DPPH·清除率見圖2。

圖2 青、紅花椒提取物DPPH·清除率Fig.2 The DPPH· elimination rates of green and red peppers' extracts
由圖2可知,在0.5~2.5 mg/mL濃度范圍內,6種青、紅花椒提取物DPPH·清除率均隨濃度增加呈現不同程度的增加趨勢。其中,RE-100顯示出最高的清除效果,在0.5 mg/mL時即達到80%的清除效果。其次是GE-50和RE-50,在1.5 mg/mL時均接近90%。GE-W DPPH·清除率隨濃度增加變化最大,當濃度在2.5 mg/mL時達到最高,明顯高于RE-W和GE-100。
2.4 脂質過氧化抑制活性
脂質過氧化是自由基產生和參與的鏈式反應,每一步都會有自由基中間產物的產生及參與。亞油酸是油脂中較常見的一種多不飽和脂肪酸,易發生氧化,常用來衡量物質的體外抗氧化活性。不同濃度下,青、紅花椒提取物對脂質過氧化的抑制效果見圖3。

圖3 青、紅花椒提取物脂質過氧化抑制活性Fig.3 The lipid peroxidation inhibitory activities of green and red peppers' extracts
由圖3可知,在0.2~1.0 mg/mL濃度范圍內,6種青、紅花椒提取物均顯示出較高的脂質過氧化抑制活性,且均隨濃度增加而增大。在濃度為0.2 mg/mL時,其抑制率也在62%~76%之間。RE-W 和GE-50的脂質過氧化抑制活性較低,其余4種相對較高,且在濃度1.0 mg/mL時,變化趨于平穩,且比較接近,達到最高值,均在94%以上,其中GE-W抑制率最高。
2.5 抗脂質過氧化動力學
1.0 mg/mL GE-W對脂質過氧化抑制活性隨時間的變化趨勢見圖4。

圖4 不同時間內青花椒水提取物脂質過氧化抑制率Fig.4 The lipid peroxidation inhibitory rates of green peppers' extracts under different time
由圖4可知,隨著時間延長,提取物的脂質過氧化抑制活性不是固定不變的,呈現明顯的增強趨勢,且呈現明顯的3個階段。在0~12 h內,提取物對脂質過氧化的抑制活性呈線性增加;在12~24 h之間,其抑制率變化平緩;24 h以后又有較明顯的增加。以上3個階段的形成,可能是由于在開始階段,樣品中抗氧化組分濃度較高,對脂質過氧化的抑制速度增加較快;隨著反應的進行,抗氧化組分逐漸消耗或飽和,致使其抑制活性增幅緩慢;之后的明顯增加,可能與體系中具有抗氧化活性的中間物質的生成有關,具體原因還有待分析。
2.6 對NO2-的清除活性
亞硝酸鹽(NO2-)可使血液載氧能力下降,從而導致一些疾病。另外,亞硝酸鹽攝入人體后可與體內胺類物質結合,形成強致癌物N-亞硝基化合物,因此,具有清除NO2-活性的物質被認為具有降低食品中NO2-含量,從而顯示一定的抗癌作用。所以,通常也將NO2-清除能力作為衡量物質體外抗氧化活性的一個重要指標。不同濃度下,青、紅花椒提取物對NO2-的清除活性見圖5。

圖5 青、紅花椒提取物對NO2-的清除活性Fig.5 The NO2-elimination activities of green and red peppers' extracts
由圖5可知,在0.05~0.25 mg/mL的濃度范圍內,6種青、紅花椒提取物均顯示出較高的NO2-清除活性,且清除率隨濃度增大而增加。其中,在0.05 mg/L時,GE-50清除率最低,隨濃度增加,清除率明顯增加,并逐漸趨于平緩。其余5種提取物在較低濃度(0.05 mg/mL)下即顯示出較高的NO2-清除活性(67%~76%),且不同提取物之間差異較小,以RE-100和GE-100的清除率最高。
2.7 不同提取物的體外抗氧化能力比較
維生素C(VC)是膳食中普遍存在的一種水溶性維生素,也是食品中公認的天然高效抗氧化組分。以LC50值為衡量標準,不同青、紅花椒提取物與VC的抗氧化作用見表2和表3。

表2 青、紅花椒提取物體外抗氧化活性LC50值Table 2 The LC50 values of antioxidant activities in vitro of green and red peppers' extracts
注:LC50是指發揮50%體外抗氧化活性時的樣品溶液濃度,mg/mL。
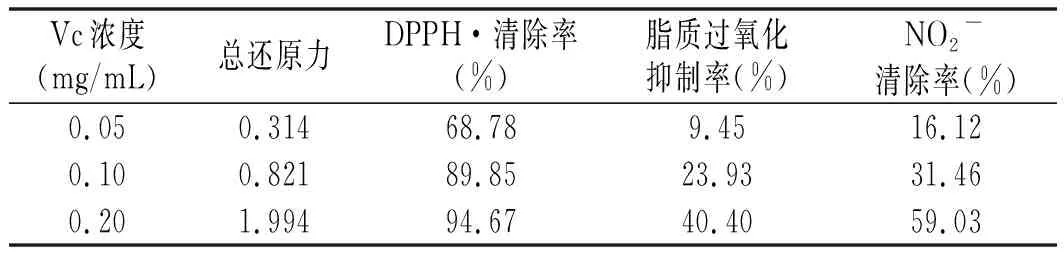
表3 不同濃度Vc溶液體外抗氧化活性分析Table 3 The antioxidant activities analysis in vitro of Vc solution with different concentration
與Vc溶液相比,6種提取物顯示出良好的脂質過氧化抑制能力和NO2-清除能力,遠高于Vc,RE-100的DPPH·清除率也優于Vc,但是總還原力均小于Vc。不同提取物之間,總還原力最高的是GE-50,其次是RE-100,最低的是RE-W。DPPH·清除效果,以RE-100最強,其次是GE-50和RE-50,最小的是2種水提取物。對脂質過氧化的抑制能力以GE-100和GE-W最強,對NO2-的清除效果以GE-100最好。
3 結論
分別采用無水乙醇、50%乙醇和蒸餾水從青、紅花椒中獲得6種花椒提取物,并對其體外抗氧化活性進行了分析比較。結果顯示:不同花椒提取物具有很強的體外抗氧化能力,且呈現不同程度的量效關系。與天然抗氧化劑VC相比,6種提取物顯示出良好的脂質過氧化抑制能力和NO2-清除能力,RE-100的DPPH·清除率也優于VC,但是總還原力均小于VC。不同提取物之間,總還原力最高的是GE-50,其次是RE-100,最低的是RE-W。DPPH·清除效果,以RE-100最強,其次是GE-50和RE-50,最小的是2種水提取物。對脂質過氧化的抑制能力以GE-100和GE-W最強,對NO2-的清除效果以GE-100最好。以上結果表明:青、紅花椒提取物抗氧化作用存在明顯差異。2種花椒提取物具有非常優良的體外抗氧化活性,尤其是在抑制脂質過氧化和清除NO2-方面,遠高于VC,在含脂食品的防腐保鮮方面顯示出很好的應用前景。

