Shp 2對舌癌細胞惡性生物學行為的調控作用
張兵,董斌#,封亞萍,韓彥博,楊新華,于兵兵
1平頂山市口腔醫院綜合科,河南 平頂山467000
解放軍第一五二中心醫院2腫瘤科,3病理科,河南 平頂山4670000
口腔癌是中國目前發病率和病死率較高的惡性腫瘤之一,大部分屬于上皮源性鱗狀細胞癌,而在口腔鱗狀細胞癌中,舌癌是發病率最高的口腔惡性腫瘤,與其他頭頸部的惡性腫瘤相比,舌癌的浸潤性強,惡化程度高,明顯影響患者的咀嚼、吞咽、呼吸等重要功能,嚴重威脅著人類的生命健康[1]。目前,臨床上主要采取以外科手術為基礎的綜合序列治療方案,雖然越來越多的抗癌藥物和靶向藥物應用于舌癌治療,但是由于舌癌具有高復發率和高遠處轉移率等特點[2],導致患者的5年生存情況并不理想,因此,尋找早期特異性腫瘤標志物對于提高對舌癌的早期診斷和預后評估能力具有十分重要的臨床價值,是舌癌治療領域長期研究的重點。舌癌的復發轉移涉及諸多因素,是一個極其復雜的病理過程,Src同源磷酸酪氨酸磷酸酶2(Srchomology phosphotyrosinephosphatase2,Shp2)是參與調控細胞內蛋白質酪氨酸磷酸化水平的關鍵酶之一,廣泛表達于細胞質中[3]。有研究顯示,Shp2與多種腫瘤細胞的增殖、分化、侵襲、轉移、凋亡等生物學行為密切相關[4],已經作為血液系統惡性腫瘤如白血病及實體腫瘤如乳腺癌、肺癌等臨床診斷和預后評估的分子標志物[5]。但目前關于Shp2在舌癌組織中的表達及其可能的作用機制的研究尚未見明確報道。本研究通過探討Shp2在舌癌組織中的表達及其對舌癌細胞惡性生物學行為的影響,為舌癌的臨床診斷、預后提供新的研究思路,為臨床治療提供潛在的分子靶點,現報道如下。
1 材料與方法
1.1 標本來源
收集2017年1月至2018年2月于解放軍第一五二中心醫院病理科存檔的石蠟包埋舌癌組織標本45例(由病理科醫師對組織切片復檢)和癌旁正常組織標本13例。舌癌組織標本取自29例男性患者和16例女性患者,患者的年齡為31~79歲,平均年齡為(58.7±7.9)歲。納入標準:所有舌癌組織標本均經鏡下病理組織檢查證實;患者均為首次診斷,術前均未接受放化療或其他相關抗腫瘤治療。排除標準:合并其他部位的惡性腫瘤患者,合并其他嚴重干預本實驗結果的重大疾病患者。
1.2 材料
人舌癌Cal-27細胞株購自中國科學院上海細胞庫。Shp2抗體購自美國Abcam公司,LipofectamineTM2000脂質體轉染試劑購自Invitrogen公司,聚合酶鏈式反應(polymerase chain reaction,PCR)引物和干擾小RNA(small interfering RNA,siRNA)干擾靶序列均由上海生工生物工程有限公司合成并提供,免疫組織化學染色試劑盒和二氨基聯苯胺(diaminobenzidine,DAB)顯色試劑盒均購自北京中杉金橋生物技術有限公司,質粒抽提試劑盒、cDNA合成試劑盒、熒光定量PCR試劑盒和細胞凋亡試劑盒均購自美國OMEGA生物公司,Opti-MEM、高糖DMEM培養基均購自美國GIBCO公司,0.25%胰蛋白酶-乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)細胞消化液購自北京鈕因華信科技發展有限公司,胎牛血清(fetal bovine serum,FBS)和鏈霉素-青霉素雙抗均購自美國Thermo Fisher公司,Trizol試劑購自美國Invitrogen公司,焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)購自美國Sigma公司,磷酸鹽緩沖液(phosphate buffer saline,PBS)、氯仿、異丙醇和無水乙醇均購自國藥集團化學試劑有限公司,生理鹽水購自安徽雙鶴藥業有限責任公司。
HERAcell150i型CO2細胞培養箱購自美國Thermo Fisher Scientific公司,Eppendorf 5427 R臺式高速冷凍離心機以及各種型號的移液器購自德國Eppndorf公司,DI-CJ-2ND超凈工作臺購自北京東聯哈爾儀器制造有限公司,實時定量PCR儀、iMake多功能酶標儀、SDS-PAGE電泳儀和電轉膜儀均購自美國Bio-Rad公司,CX41倒置光學顯微鏡購自日本OLYMPUS公司,電子分析天平購自上海玉研科學儀器有限公司,Amersham電泳儀購自瑞典Bioscience公司,恒溫水浴搖床和YCZ-40D型轉移電泳槽均購自北京六一儀器廠,流式細胞儀和Transwell小室均購自美國Becton Dickinson公司,LAS-4000 mini凝膠成像數碼分析系統購自日本FujiFilm公司。
1.3 實驗方法
1.3.1 免疫組織化學檢測 按照即用型鏈霉菌抗生物素蛋白-過氧化物酶(streptavidin-peroxidase,SP)試劑盒說明書進行操作。隨機選擇10個視野,觀察Shp2在Cal-27細胞的陽性表達情況。Shp2的陽性著色表達于細胞漿,呈棕黃色表達。染色結果判定標準:根據細胞的染色強度評分,0分為無染色,1分為弱染色,2分為中度染色,3分為強染色,然后計算10個視野的平均染色分值。同時根據視野中陽性細胞所占百分比評分,陽性細胞數目所占比例為0計0分,陽性細胞數目所占比例﹤25%計為1分,陽性細胞數目所占比例為25%~50%計為2分,陽性細胞數目所占比例為51%~75%計為3分,陽性細胞數目所占比例>75%計為4分。兩項積分相乘總分≤1分為“—”表達,2~5分為“+”表達,6~10分為“++”表達,﹥10分為“+++”表達。
1.3.2 細胞培養 將Cal-27細胞培養于含10%FBS的高糖DMEM培養基中,于含5%CO2、37℃的細胞培養箱中進行培養,24~48 h更換培養基,并觀察細胞狀態。每隔48 h傳代1次。
1.3.3 Shp 2慢病毒干擾載體構建 選擇pGMLVSB1 RNAi慢病毒載體,由上海吉瑪公司構建并提供慢病毒重組質粒,并轉染至感受態細胞DH5α中。挑取單個菌落,進行小量搖菌培養。采用質粒抽提試劑盒提取慢病毒重組質粒和包裝質粒,并轉染至293T細胞中,測定慢病毒滴度。
1.3.4 細胞轉染 轉染前1天,以5×105/孔細胞接種于6孔板中,培養24 h后,待細胞融合度達到50%~60%時,按照脂質體Lipofectamine 2000轉染說明書進行轉染操作。實驗細胞分為3組:對照組,只加入LipofectamineTM2000,不進行轉染;陰性組:轉染siRNA-NC;Shp2-siRNA組:轉染Shp2-siRNA。在EP管中分別加入5 μl預先配置的Shp2 siRNA或對照siRNA溶液,以及250 μl的無血清Opti-MEM培養基,混勻,室溫放置10 min;另外,在5 μl LipofectamineTM2000 脂質體溶液中加入 250 μl的無血清Opti-MEM培養液,振蕩混勻后,室溫放置10 min;將上述兩種溶液吹打混勻,室溫放置30 min;將脂質體-質粒DNA復合液滴加至孔板細胞表面,置于37℃、5%CO2的細胞培養箱中培養24~48 h。提取細胞RNA及蛋白,驗證目的基因的表達情況及轉染效率。
1.3.5 噻唑藍法檢測 采用噻唑藍(methylthiazolyldiphenyl-tetrazolium bromide,MTT)法檢測細胞增殖能力。將3組Cal-27細胞(1×104/孔)單層接種至96孔板中,置于37℃、5%CO2的細胞培養箱中進行培養,每組設置8個平行孔,分別培養24、48、72、96 h后,加入20 μl的MTT,置于37 ℃、5%CO2的細胞培養箱中孵育4 h后,棄除上清液,每孔加入 200 μl的 二 甲 基 亞 砜(dimethyl sulfoxide,DMSO)溶液,孵育振蕩反應5 min,置于顯微鏡下觀察無紫色結晶物。采用全自動酶標儀在450 nm波長處檢測細胞的光密度(optical density,OD)值,計算細胞增殖活性。實驗重復3次。
1.3.6 Transwell實驗 采用Transwell小室檢測細胞的侵襲和遷移能力。將3組Cal-27細胞(1×104/孔)單層接種至Transwell小室內;從小室的側空采用移液器加入500 μl含有10%FBS的高糖DMEM培養基;將Transwell小室置于37℃、5%CO2的細胞培養箱中培養48 h。蘇木素染色,Transwell小室濾膜;置于倒置光學顯微鏡中計數。實驗重復3次。
1.3.7 劃痕實驗 先用marker筆在6孔板背后,用直尺均勻地劃橫線,每隔0.5~1.0 cm劃一道,橫穿過孔。每孔至少穿過5條線;每孔加入約5×105個細胞;次日,待細胞貼壁后,標記劃痕;用PBS洗細胞3次,去除劃下的細胞,加入無血清培養基;置入37 ℃、5%CO2的細胞培養箱中培養。按0、6、12、24 h取樣,拍照。實驗重復3次。
1.3.8 流式細胞術檢測 收集3組的Cal-27細胞,采用預冷的PBS洗滌細胞3次后,1000 r/min離心5 min,離心半徑為19 cm。棄除上清液;加入500 μl的結合緩沖液重懸細胞,細胞數量約為1×104/ml;加入膜聯蛋白V-異硫氰酸熒光素(annexin V-fluorescein isothiocyanat,Annexin V-FITC)5 μl,室溫下避光孵育15 min;1000 r/min(離心半徑19 cm)離心5 min,棄除上清液;加入500 μl的結合緩沖液重懸細胞;加入碘化丙啶(propidium iodide,PI)5 μl,室溫下避光孵育15 min;1000 r/min離心5 min,離心半徑為19 cm,棄除上清液;加入300 μl的結合緩沖液。根據細胞凋亡試劑盒的操作說明檢測各組細胞的凋亡情況。實驗重復3次。
1.3.9 蛋白質印跡法(Western blot) 收集對數期生長的細胞 1×107/ml,加入 100 μl的細胞裂解液,冰浴裂解30 min,3000 rpm離心15 min,取上清液;采用BCA試劑盒檢測蛋白濃度。每孔道加入總蛋白50 μg,行十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)約2 h。電轉移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜后,采用5%的脫脂奶粉封閉過夜,置于水平搖床中,4℃孵育一抗過夜(1∶500稀釋),洗膜,加入辣根過氧化物酶標記的羊抗兔IgG(1∶10 000稀釋),置于水平搖床中,室溫下孵育1 h,洗膜,采用化學發光法檢測膜上的蛋白表達條帶,采用FluorChem FC3凝膠成像數碼分析系統進行定量分析,以積分光密度(integral optical density,IOD)表示灰度值。
1.4 統計學方法
采用SPSS 19.0軟件對數據進行統計分析。計量資料以均數±標準差(±s)表示,兩組間比較采用t檢驗,多組間比較采用單因素方差分析;多組間兩兩比較采用q檢驗;計數資料以率(%)表示,組間比較采用χ2檢驗。以P﹤0.05為差異有統計學意義。
2 結果
2.1 不同組織中Shp 2的表達情況
舌癌組織中Shp2的陽性表達率為82.22%(37/45),明顯高于癌旁正常組織的23.08%(3/13),差異有統計學意義(χ2=13.838,P﹤0.01)。
2.2 沉默Shp 2對Cal-27細胞增殖的影響
3組Cal-27細胞在不同時間點的OD值比較,差異有統計學意義(P﹤0.01)。空白對照組和陰性對照組Cal-27細胞在不同時間點的OD值比較,差異均無統計學意義(P﹥0.05);而Shp2-siRNA組中Cal-27細胞在各個時間點的OD值均低于空白對照組和陰性對照組,差異均有統計學意義(P﹤0.05)。(表1)
表1 沉默Shp 2后不同時間點Cal-27細胞OD值的比較(±s)
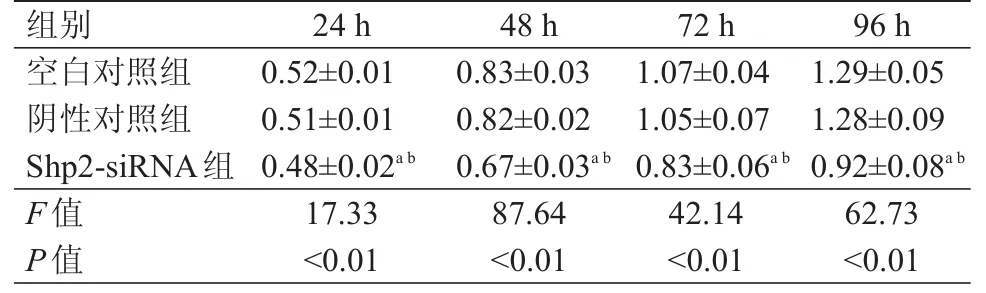
表1 沉默Shp 2后不同時間點Cal-27細胞OD值的比較(±s)
注:a與空白對照組比較,P<0.05;b與陰性對照組比較,P<0.05
組別24 h 48 h 72 h 96 h
2.3 Shp 2對Cal-27細胞體外侵襲能力的影響
空白對照組的侵襲細胞數量為(118.38±16.62)個,陰性對照組的侵襲細胞數量為(115.63±17.54)個,Shp2-siRNA組的侵襲細胞數量為(57.50±16.83)個,3組Cal-27細胞的侵襲細胞數量比較,差異有統計學意義(F=32.721,P﹤0.01)。空白對照組和陰性對照組Cal-27細胞的侵襲細胞數量比較,差異無統計學意義(P﹥0.05);而Shp2-siRNA組中Cal-27細胞的侵襲細胞數量低于空白對照組和陰性對照組,差異有統計學意義(P﹤0.05)。
2.4 沉默Shp 2對Cal-27細胞體外遷移能力的影響
3組Cal-27細胞在6、12、24 h的遷移率比較,差異均有統計學意義(F=7.75、16.62、106.72,P﹤0.01)。空白對照組和陰性對照組中Cal-27細胞在6、12、24 h的遷移率比較,差異均無統計學意義(P﹥0.05);Shp2-siRNA組中Cal-27細胞在6、12、24 h的遷移率均低于空白對照組和陰性對照組,差異均有統計學意義(P﹤0.05)。(表2)
表2 沉默Shp 2對Cal-27細胞遷移率的影響(%,±s)

表2 沉默Shp 2對Cal-27細胞遷移率的影響(%,±s)
注:a與空白對照組比較,P<0.05;b與陰性對照組比較,P<0.05
組別0 h 6 h 12 h 24 h
2.5 沉默Shp 2對Cal-27細胞凋亡的影響
干擾72 h后,Shp2-siRNA組Cal-27細胞的凋亡率為(16.14±3.17)%,空白對照組Cal-27細胞的凋亡率為(3.96±2.29)%,陰性對照組Cal-27細胞的凋亡率為(4.35±2.68)%,3組比較,差異有統計學意義(F=51.17,P﹤0.01)。與空白對照組比較,Shp2-siRNA組和陰性對照組的Cal-27細胞凋亡率均有所升高,差異均有統計學意義(P﹤0.05)。
2.6 沉默Shp 2對Cal-27細胞中凋亡相關蛋白p53、Bax和Bcl- 2表達的影響
3組Cal-27細胞中的p53、Bax和Bcl-2蛋白表達水平比較,差異均有統計學意義(F=21.59、21.56、18.22,P﹤0.01)。Shp2-siRNA 組中的 p53、Bax蛋白表達水平均高于空白對照組和陰性對照組,Bcl-2蛋白表達水平低于空白對照組和陰性對照組,差異均有統計學意義(P﹤0.05)。陰性對照組與空白對照組Cal-27細胞中p53、Bax和Bcl-2蛋白的表達水平比較,差異均無統計學意義(P﹥0.05)。(表 3)
表3 不同組別Cal-27細胞中 p53、Bax和Bcl- 2蛋白表達水平的比較(±s)
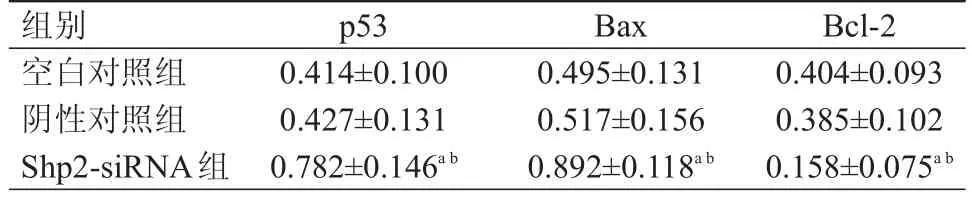
表3 不同組別Cal-27細胞中 p53、Bax和Bcl- 2蛋白表達水平的比較(±s)
注:a與空白對照組比較,P<05;b與陰性對照組比較,P<05
組別空白對照組陰性對照組Shp2-siRNA組p53 0.414±0.100 0.427±0.131 0.782±0.146a b Bax 0.495±0.131 0.517±0.156 0.892±0.118a b Bcl-2 0.404±0.093 0.385±0.102 0.158±0.075a b
3 討論
目前,臨床上關于頭頸部惡性腫瘤仍以外科手術切除為主,配合化療和放療輔助治療,尋找能夠反映患者生理狀況和細胞變化的生物標志物對于準確診斷疾病和評估預后具有十分重要的臨床價值[6]。舌癌是常見的頭頸部惡性腫瘤之一,惡化程度較高,預后差,尤其是晚期舌癌患者,易出現局部復發和遠處轉移,是治療失敗的主要原因[7],因此,早診斷、早治療是改善患者預后、延長患者生存期的主要手段[8]。Shp2是由PTPN11基因編碼的、廣泛存在于細胞質中的非受體型酪氨酸磷酸酶,在多種腫瘤組織中呈過度活化狀態[9-10]。本研究發現,舌癌組織中Shp2的陽性表達率明顯高于癌旁正常組織(P﹤0.01),表明Shp2可能參與腫瘤的發生和發展過程。但是也有研究發現,Shp2在肝癌組織中呈低表達,發揮類似抑癌基因的作用[11]。因此,在不同的腫瘤細胞中,Shp2可能表現不同的生理活性。目前,國內外關于探討Shp2在舌癌組織中的表達水平及其對腫瘤細胞惡性生物學行為的調控作用的研究尚少,因此,本研究著重探討了Shp2在舌癌組織和癌旁正常組織中的表達及其對舌癌Cal-27細胞體外增殖、侵襲、遷移和凋亡的影響,探討Shp2在舌癌中表達的臨床意義。
本研究發現,Shp2在癌旁正常組織中呈低表達。另外,本研究結果顯示,Shp2表達于細胞漿中,與有關研究結果類似[12],提示Shp2可作為舌癌診斷和治療的潛在分子靶點。但是Tassidis等[13]通過免疫組織化學檢測Shp2在前列腺癌細胞中的表達情況,結果發現,Shp2不僅在細胞質中的表達上調,而且在細胞核中也呈高表達,據推測,不同腫瘤組織中Shp2的表達部位有可能存在差異,因此,Shp2發揮的病理生理作用也可能不同。
RNA干擾技術是目前較為成熟的研究靶基因功能的實驗室手段,可特異性剔除或關閉某種靶基因的表達;慢病毒載體是一類轉染率較高的逆轉錄病毒載體,本研究通過采用RNA干擾(RNA interference,RNAi)技術,構建Shp2慢病毒干擾載體,探討Shp2在Cal-27細胞中增殖、遷移、凋亡等體外生物學過程中的作用。細胞具有增殖、分化、衰老、凋亡等方面的特性,通過相互協調,共同維持正常的生理活動[14]。增殖失控和凋亡受到抑制是腫瘤細胞不同于正常細胞的生物學特點,即細胞增殖和凋亡失衡導致細胞數量異常增加,從而為腫瘤的形成提供關鍵的病理基礎[15]。因此,腫瘤既是細胞增殖和分化異常的疾病,也是凋亡性疾病。本研究結果顯示,Shp2基因沉默后,Cal-27細胞的增殖活性受到抑制,凋亡率增加,提示Shp2在促進舌癌細胞增殖和抑制細胞凋亡過程中發揮著重要的類似癌基因的作用。另外,Bax/Bcl-2、p53蛋白等是參與細胞凋亡的主要蛋白分子,其中,Bcl-2位于細胞凋亡調控通路的終末端,是最重要的促癌基因,具有抗凋亡作用。Bax是p53蛋白轉錄的靶基因,可作用于線粒體膜上的電壓依賴性離子通道,具有促凋亡作用。p53通過上調Bax的表達,下調Bcl-2的表達共同完成促進腫瘤細胞凋亡的作用。本研究為了證實Shp2對細胞凋亡的影響,通過Western blot法檢測了沉默Shp2基因后對Bax、Bcl-2、p53蛋白表達的影響。結果顯示,轉染Shp2siRNA干擾載體后,Cal-27細胞中p53和Bax的表達水平升高,而Bcl-2表達水平下降,提示Shp2抑制腫瘤凋亡的作用機制可能與p53調控的Bax/Bcl-2比例變化有關。另外,腫瘤細胞的侵襲和轉移是舌癌患者預后不良的主要因素。有研究顯示,Shp2在乳腺癌的侵襲和轉移過程中具有正向調控作用,并通過調控細胞的黏附能力為乳腺癌細胞的侵襲和轉移提供有利的條件[16]。本研究通過Transwell小室和劃痕實驗證實,Shp2基因沉默后,Cal-27細胞遷移能力降低,推測Shp2促進舌癌細胞侵襲和遷移的作用機制可能與抑制細胞凋亡、促進增殖及增加細胞黏附能力有關。
綜上所述,Shp2在舌癌組織中的陽性表達率明顯高于癌旁正常組織,采用慢病毒介導Shp2基因沉默后,Cal-27細胞的增殖、侵襲、遷移能力受到抑制,同時,凋亡能力增強,凋亡相關蛋白Bax、p53的表達上調,Bcl-2的表達下調,提示Shp2在舌癌組織中具有促癌基因的活性,可作為舌癌早期診斷、預后評估的分子標志物以及潛在的基因治療靶點。

