siRNA靶向沉默COX- 2對宮頸癌細胞VEGF、EGFR表達的影響
陳杰,王莉,王俊嶺,王慧
周口市中醫院婦產科,河南 周口4660000
宮頸癌是婦科常見的惡性腫瘤之一,發病率居所有女性惡性腫瘤的第2位,僅次于乳腺癌。近年來的調查顯示,宮頸癌的發病率逐年升高,且呈年輕化趨勢,對女性的健康造成嚴重的威脅[1]。宮頸癌的發病機制目前尚未統一,近年來以腫瘤血管作為切入點對腫瘤進行生物靶向治療是目前研究的熱點,其中表皮生長因子受體(epithelial growth factor receptor,EGFR)和血管內皮生長因子(vascular endothelial growth factor,VEGF)的靶向藥物研究較多[2]。研究顯示,EGFR和VEGF在腫瘤細胞中高度表達,在腫瘤細胞的增殖、轉移、凋亡及細胞周期和血管生成等過程中發揮著重要作用[3]。本研究通過RNA干擾技術沉默HeLa細胞中環氧合酶-2(cyclo-oxygen-ase,COX-2)基因的表達,分析HeLa細胞中EGFR和VEGF的基因及蛋白表達水平,旨在為宮頸癌的治療提供一定的理論依據,現報道如下。
1 材料與方法
1.1 材料、試劑與儀器
人宮頸癌HeLa細胞購自中科院細胞研究所。胎牛血清和0.25%胰酶溶液均購自美國Gbico公司;雙抗(青霉素與鏈霉素)溶液、TBST溶液、DHanks溶液、聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜均購自美國Sigma公司;NIH3T3培養液、DMEM培養基和磷酸鹽緩沖液(horseradish peroxidase,PBS)均購自美國Hyclone公司;鼠抗人COX-2、VEGF、EGFR單抗以及辣根過氧化物酶(horseradish peroxidase,HRP)標記的山羊抗鼠二抗均購自美國R&D公司;人COX-2siRNA、陰性對照siRNA均購自西寶生物科技(上海)股份有限公司。LipofectamineTM轉染試劑盒、碘化丙啶(propidium iodide,PI)均購自美國Invitrogen公司;DAB顯色試劑盒購自北京中杉金橋生物技術有限公司;RNA提取試劑盒和反轉錄試劑盒均購自北京天根生化科技有限公司;2×SYBR Mix和RT-PCR試劑盒均購自日本Takara公司;BCA蛋白濃度測定試劑盒購自美國Bio-red公司。CO2培養箱購自美國Thermo Scientific公司;低溫高速離心機購自德國Beckman公司;Transwell小室以及半透明8 μm聚碳酸濾膜均購自德國Greiner公司;凝膠成像儀、PCR儀及電轉儀均購自美國BioRad公司。
1.2 細胞復蘇和培養
從-80℃超低溫冰箱中取出凍存的HeLa細胞,室溫下融化3 min后,加入含10%胎牛血清、50 U/ml雙抗的DMEM培養液中,置于37℃、5%CO2培養箱中進行培養,每隔一日更換培養液,當細胞貼壁生長至80%時,加入0.25%胰酶消化1 min,隨后加入2 ml含10%胎牛血清的DMEM培養液終止消化后,置于離心機中1000 r/min離心10 min,加入DMEM培養液進行傳代培養,培養至第3代可用于后續研究。
1.3 COX- 2 siRNA轉染
取生長至對數期的細胞,加入0.25%胰酶溶液進行消化,置于離心機中,1000 r/min離心10 min,收集細胞,在細胞培養板中培養細胞,將細胞濃度調整為2×105/L,置于37℃、5%CO2培養箱中進行培養,待細胞數量達到80%時,用于后續轉染。用DMEM培養基漂洗細胞培養板,將已凋亡細胞去除,將7.5 μlCOX-2siRNA質粒(上游序列為5'-GGACUUAUGGGUAAUGUUA-3',下游序列為5'-CCUGAAUACCCAUUACAAU-3')和5 μl LipofectamineTM2000與DMEM培養液混勻作為轉染組,室溫下放置5 min,隨后將兩者混勻,室溫下放置20 min為轉染復合物,將制備好的轉染復合物加入培養板中,隨后再加入培養液定容至2 ml,同時設置空白對照組與陰性對照組,每組6個重復,空白對照組中僅加入細胞培養液,陰性對照組中加入陰性對照siRNA,置于37℃、5%CO2培養箱中培養。
1.4 RT-PCR法檢測VEGF和EGFR基因的表達水平
應用RNA提取試劑盒提取HeLa細胞的總RNA,應用反轉錄試劑盒將RNA反轉錄為cDNA。VEGF上游序列為5'-AGCACGAGCTACCTCAG-3',下游序列為5'-TTTAGACATGCATGCATCGGCAGGAA-3';EGFR上游序列為5'-AGATAGTCGCCCAAAGTTCCG-3',下游序列為5'-GGGCACGAAGGCTCATCATT-3';COX-2上 游 序 列 為 5'-TTCAAATGAGATTGTGGGAAAATTGCT-3',下 游序列為5'-AGATCATCTCTGCCTGAGTATCTT-3'。以β-actin作為內參基因,上游序列為5'-AGCGAGCATCCCCCAAAGTT-3',下游序列為5'-GGGCACGAAGGCTCATCATT-3'。 反 應 體 系 :10 μl 2 ×SYBR Green Mix,上下游引物各 1 μl,ddH2O 8 μl,10×cDNA模板1 μl。反應條件:95 ℃ 3 min,94 ℃10 s,60 ℃ 20 s,72 ℃ 2 min,共30個循環,72 ℃10 min。利用CFX manager 3.0軟件進行Cq值分析,以β-actin作為內參基因,按照2-ΔΔCq法計算基因的相對表達量。
1.5 Western blot檢測VEGF和EGFR蛋白表達水平
采用D-Hanks溶液清洗細胞,加入蛋白裂解液在冰上裂解30 min,置于離心機中,1200 r/min離心10 min,收集上清液,利用BCA法測定蛋白濃度,隨后制備8%分離膠和12.5%濃縮膠,蛋白上樣量統一為30 μg,起始電壓設置為80 V,樣品進入分離膠后,電壓調整為120 V,反應結束后將蛋白凝膠轉移至PVDF膜上,4℃冰浴,電壓設置為100 V,進行1 h轉膜反應,加入TBST溶液進行清洗后,加入5%脫脂牛奶,37℃封閉1 h,清洗PVDF膜,每次10 min,共3次。加入一抗稀釋液(COX-2、VEGF、EGFR),4℃振蕩過夜,加入PBS溶液清洗3次,每次10 min,加入二抗稀釋液(HRP標記的山羊抗鼠IgG抗體),室溫下孵育2 h,PBS清洗后采用凝膠成像儀分析蛋白表達水平。
1.6 MTT法檢測細胞增殖
將細胞置于37℃、5%CO2培養箱中分別培養12、24、48、72 h,培養結束后棄去原培養基,添加100 μl DMEM 溶液和 10 μl MTT 溶液 ,避光孵育4 h,棄去培養液后添加150 μl DMSO溶液,振蕩10 min,使用酶標儀于570 nm波長下測定每孔的吸光度值。細胞增殖抑制率=(1-實驗組吸光度值/對照組吸光度值)×100%。
1.7 流式細胞儀檢測細胞的凋亡情況
細胞中加入0.25%胰酶進行消化,置于離心機中,1000 r/min離心10 min,收集下層細胞,加入含有10 μg/ml PI的 PBS 溶液 100 μl,重懸細胞后,在黑暗條件下染色30 min,采用細胞流式儀檢測細胞的凋亡情況。
1.8 Transwell小室檢測細胞的遷移和侵襲能力
采用24孔Transwell小室對細胞的遷移和侵襲能力進行評估,在小室下方加入NIH3T3細胞培養液作為趨化因子,并將小室插件如濾膜、底板等于小室下方固定好,在小室上方加入已培養24 h的3組細胞,每組設置6個復孔,將Transwell小室在37℃、5%CO2培養箱中培養8 h,將濾膜取出后,用棉簽去除未遷移的細胞,在室溫下加入70%甲醇固定40 min,采用蘇木精染色,在顯微鏡下統計穿膜的細胞數目,采用Image Pro Plus 6軟件分析細胞穿透率,細胞穿透率=穿膜數量/細胞總數×100%。
1.9 統計學方法
采用SPSS 21.0軟件對數據進行統計學分析,計量資料以均數±標準差(±s)表示,兩組間比較采用t檢驗,多組間比較采用單因素方差分析,以P﹤0.05為差異有統計學意義。
2 結果
2.1 COX- 2、VEGF、EGFR基因表達水平的比較
RT-PCR結果顯示,轉染組的COX-2、VEGF、EGFR基因表達水平均低于空白對照組和陰性對照組,差異均有統計學意義(P﹤0.05)。(圖1)
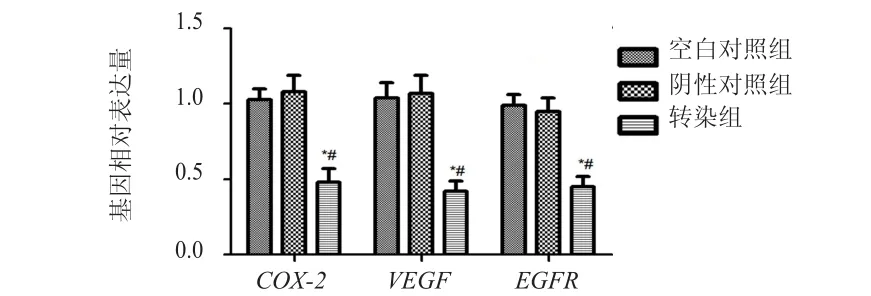
圖1 3組HeLa細胞中COX- 2、VEGF、EGFR基因的相對表達量
2.2 COX- 2、VEGF、EGFR蛋白表達水平的比較
Western blot結果顯示,空白對照組、陰性對照組及轉染組的COX-2、VEGF、EGFR蛋白表達水平比較,差異均有統計學意義(F=40.399,P﹤0.01;F=51.649,P﹤0.01;F=51.765,P﹤0.01);轉染組的COX-2、VEGF、EGFR蛋白表達水平均低于空白對照組和陰性對照組,差異均有統計學意義(P﹤0.05)。(圖2、表1)
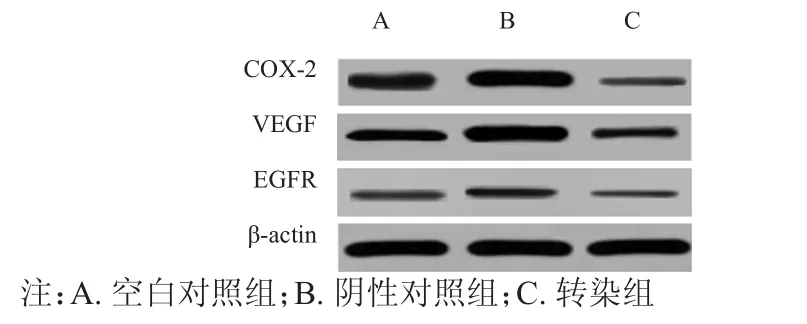
圖2 Western blot結果圖
表1 3組HeLa細胞的COX- 2、VEGF、EGFR蛋白表達水平(±s)
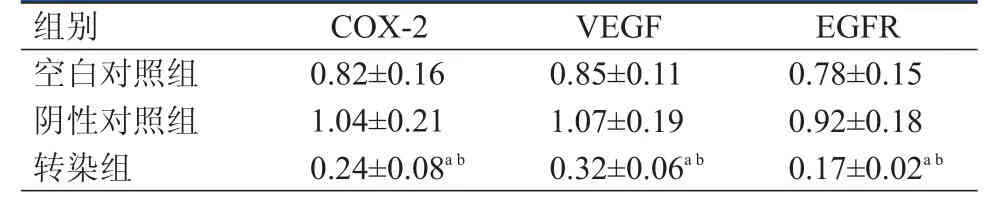
表1 3組HeLa細胞的COX- 2、VEGF、EGFR蛋白表達水平(±s)
注:a與空白對照組比較,P<0.05;b與陰性對照組比較,P<0.05
組別COX-2VEGF EGFR空白對照組陰性對照組轉染組0.82±0.16 1.04±0.21 0.24±0.08a b 0.85±0.11 1.07±0.19 0.32±0.06a b 0.78±0.15 0.92±0.18 0.17±0.02a b
2.3 細胞增殖抑制率的比較
MTT檢測結果顯示,隨著培養時間的延長,轉染組的細胞增殖抑制率逐漸升高。不同時間點轉染組的細胞增殖抑制率均高于空白對照組和陰性對照組,差異均有統計學意義(P﹤0.05)。(表2)
表2 3組HeLa細胞增殖抑制率的比較(%,±s)

表2 3組HeLa細胞增殖抑制率的比較(%,±s)
注:a與空白對照組比較,P<0.05;b與陰性對照組比較,P<0.05
組別12 h 24 h 48 h 72 h
2.4 細胞凋亡率的比較
流式細胞儀檢測結果顯示,轉染組的細胞凋亡率為(31.08±4.03)%,高于空白對照組的(8.36±0.73)%和陰性對照組的(8.98±0.95)%,差異均有統計學意義(P﹤0.05)。(圖3)
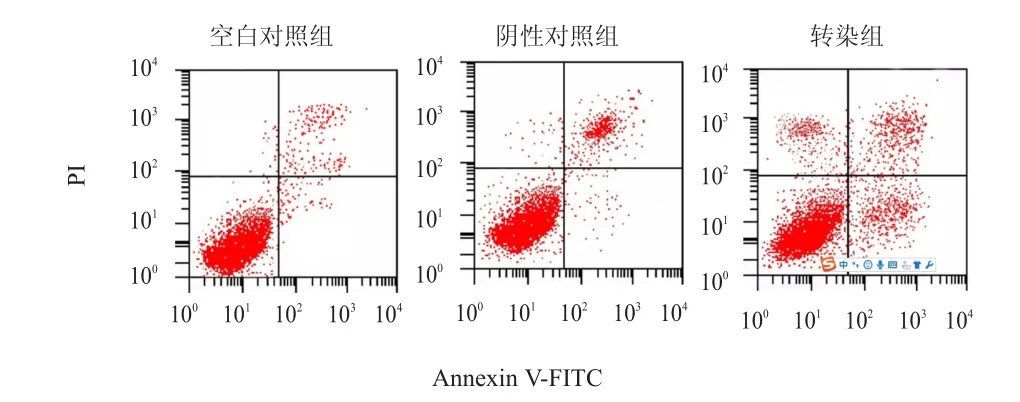
圖3 流式細胞儀檢測各組HeLa細胞的凋亡情況
2.5 細胞穿透率的比較
Transwell小室檢測結果顯示,空白對照組、陰性對照組及轉染組的細胞穿透率比較,差異有統計學意義(F=20.003,P﹤0.01)。空白對照組與陰性對照組的細胞穿透率比較,差異無統計學意義(P﹥0.05);轉染組的細胞穿透率低于空白對照組和陰性對照組,差異均有統計學意義(P﹤0.05)。(表3)
表3 3組HeLa細胞穿透率的比較(%,±s)

表3 3組HeLa細胞穿透率的比較(%,±s)
注:a與空白對照組比較,P<0.05;b與陰性對照組比較,P<0.05
組別 細胞穿透率
3 討論
腫瘤的發生、發展較為復雜,至少涉及2種癌變基因相互協同發揮作用,共同促進細胞發生癌變。COX-2是機體前列腺素生成的關鍵限速酶,研究表明,COX-2在多種腫瘤組織中高表達,與腫瘤的發生和轉移關系密切,同時在腫瘤細胞的遷移和侵襲中發揮重要作用[4]。研究表明,宮頸癌細胞中的COX-2能通過促進VEGF表達,進而促進腫瘤血管形成,實現腫瘤淋巴結的轉移[5]。此外還有研究顯示,EGFR可通過與含表皮生長因子(epidermal growth factor,EGF)的類纖維蛋白樣細胞外基質蛋白 1(EGF-containing fibulin-like extracellular matrix protein 1,EFEMP1)結合,激活MAPK-VEGF信號通路,從而促進宮頸癌微血管生成[6]。因此,VEGF和EGFR可能為控制腫瘤細胞增殖及轉移的重要靶點,如何降低VEGF和EGFR的表達,抑制腫瘤細胞增殖是目前的研究熱點。
COX-2屬于誘導酶,在正常組織中一般不表達,當細胞受到促癌劑、炎性介質、細胞因子及生長因子等的刺激后會出現高表達,其主要在轉錄水平上進行調控[7]。近年來的研究發現,COX-2過表達能夠促進腫瘤血管形成,促進基質金屬蛋白酶表達,進一步促進腫瘤的發展、侵襲和轉移[8]。另有研究顯示,COX-2在宮頸癌細胞中的表達異常升高,免疫組化染色結果說明COX-2主要在瘤變上皮細胞及惡性上皮細胞中表達,提示COX-2可能參與宮頸癌的發生[9-10]。此外還有研究顯示,COX-2表達水平在淋巴結發生轉移的宮頸癌患者中明顯升高,表明COX-2與宮頸癌轉移有關,且腫瘤復發患者中COX-2的表達水平高于未復發患者,提示COX-2與腫瘤細胞凋亡有關[11]。本研究結果顯示,轉染組的COX-2、VEGF、EGFR基因表達水平均低于空白對照組和陰性對照組,細胞增殖抑制率和凋亡率均高于空白對照組和陰性對照組,細胞穿膜率低于空白對照組和陰性對照組,差異均有統計學意義(P﹤0.05)。提示COX-2過表達在宮頸癌細胞的增殖、遷移及凋亡中具有重要意義。
VEGF在血管內皮生長及淋巴結轉移中發揮著重要作用,尤其在胚胎發育時期高度表達,較多研究均證實VEGF表達上調能夠促進腫瘤細胞增殖,增強腫瘤細胞的侵襲能力[12-13]。有研究報道,宮頸癌細胞中COX-2與VEGF的表達呈正相關[14]。相關學者將COX-2基因轉染至人胃癌細胞中,進而誘導COX-2基因過表達,結果顯示VEGF表達水平明顯升高,當抑制COX-2基因表達時,VEGF基因的表達也受到抑制,提示COX-2基因能夠調控VEGF基因表達[15]。研究顯示,在乳腺癌以及大腸癌細胞中COX-2基因可以通過中間蛋白CCR-7調控VEGF表達,從而促進腫瘤細胞血管生成,提示兩者在腫瘤細胞的形成中存在相互交叉的作用[16]。Deshpande等[17]研究顯示,在頭頸鱗癌細胞中COX-2過表達能夠刺激VEGF的上調,進而促進淋巴血管生成。本研究結果顯示,空白對照組和陰性對照組中VEGF均呈高表達,而轉染COX-2siRNA后,VEGF的基因與蛋白表達水平均降低,且細胞穿膜率降低,增殖抑制率升高,表明siRNA干擾HeLa細胞中COX-2基因的表達后,COX-2基因表達水平降低,VEGF基因表達水平也降低,提示COX-2沉默后可能通過抑制VEGF的合成,抑制細胞遷移,進而誘導細胞凋亡。
EGFR屬于跨膜蛋白,主要參與血管上皮形成,在細胞膜信號傳遞中發揮著重要作用。EGFR在多種腫瘤細胞的增殖、分化、遷移及侵襲中發揮重要作用,在胃癌、肝癌、乳腺癌、直腸癌及宮頸浸潤癌中均呈現高表達。有研究顯示,EGFR在鱗癌中呈強陽性表達,且與浸潤深度呈正相關,與淋巴結轉移呈正相關,表明EGFR在宮頸癌的浸潤和轉移中發揮重要作用,其過表達與宮頸癌細胞的高增殖、易轉移有關,可作為宮頸癌患者預后的重要指標[18-19]。另有研究顯示,EGFR參與腫瘤細胞血管生成,可以直接或間接刺激腫瘤細胞,EGFR為血管發生的受體,在腫瘤細胞血管表皮中表達[20]。本研究結果顯示,EGFR在空白對照組和陰性對照組中均表達,轉染COX-2siRNA后,EGFR的基因與蛋白表達水平均降低,且流式細胞儀檢測結果顯示,轉染后能夠明顯誘導HeLa細胞凋亡,可能原因為COX-2基因沉默后通過下調EGFR基因表達,抑制HeLa細胞遷移,進而誘導HeLa細胞凋亡。
本研究采用細胞流式儀檢測轉染后HeLa細胞的凋亡情況,結果顯示,轉染組的細胞凋亡率高于空白對照組和陰性對照組,差異均有統計學意義(P﹤0.05);Transwell小室檢測結果顯示,轉染組的細胞穿透率低于空白對照組和陰性對照組,差異均有統計學意義(P﹤0.05)。以上結果間接表明,COX-2能夠促進腫瘤細胞的增殖和侵襲,可能是通過調控VEGF和EGFR的表達實現。
綜上所述,siRNA靶向沉默HeLa細胞中的COX-2基因,能夠抑制其基因及蛋白表達水平,同時使VEGF和EGFR的基因及蛋白表達水平降低,進一步降低HeLa細胞的遷移和侵襲能力,促進HeLa細胞凋亡。

