母血microRNA-520a水平與胎兒心臟缺陷關系的研究
李 源,阮 焱*,舒 暢
(1.首都醫科大學附屬北京婦產醫院,北京100026;2.中國科學院基因組科學與信息重點實驗室)
在2013年研究發現在母體中可以檢測到來源于胎兒胎盤的RNA[1]。固有RNA的不穩定性,提示可以通過防止其在血清中降解從而使循環RNA達到穩定,甚至可以延長RNA在凋亡小體中暴露于核酶的時間[2]。這一重要發現使循環RNA分子應用于臨床,也使得性別或基因型等可以用于無創性產前基因表達分析。另發現所有胎盤來源的mRNA在分娩之后就被快速清除,這一證據表明了該目標mRNA與妊娠過程相關[1]。miRNAs在胎盤中顯著表達,其可能在持續的妊娠過程中與胎盤分化相關。且胎盤miRNAs可在母體血漿中被檢測到[3],這就提示其可做為新的胎兒核酸標記物,因此其可用于監控妊娠過程。
目前,用于妊娠早期胎兒心臟缺陷的診斷標志物及相關技術在準確性等方面仍然非常有限。因此,探尋有效、簡便、快捷、高效而準確的可替代性無創循環或組織學指標來預測或診斷胎兒心臟缺陷的需求急為迫切[4]。本文旨在探討母血中microRNA-520a水平與胎兒心臟缺陷的關系及其臨床意義。
1 材料和方法
1.1 研究對象與分組
收集2010年1月至2015年12月間于我院進行系統產前檢查并超聲心臟檢查提示一處或多處先天性心臟缺陷胎兒的孕婦作為研究組,共44例;隨機收集同期同孕周胎兒未發現異常的孕婦作為對照組共34例。兩組的年齡為32.56±6.18歲,孕周為23.18±5.62周。全部參與者接收全程跟蹤隨訪,隨訪結果滿意。本研究經首都醫科大學附屬北京婦產醫院醫學研究倫理委員會批準。每位患者知情同意并簽署書面知情同意書,全部患者均同意其病例數據及標本用于實驗研究及論文發表。
1.2 標本采集
使用EDTA (Ethylenedinitrilotetraacetic acid) 抗凝管采集靜脈血9 ml共兩管,800×g離心后取上清。所得上清使用Eppendorf Centrifuge 5810 R 離心機(Eppendorf AG,Hamburg,Germany)再次4,800×g于4℃下離心10 min。經過兩次離心后,所獲得的母體血漿上清標本使用Eppendorf 凍存管于-80℃保存以備進一步提取及分析miRNA 。
1.3 miRNA 提取
使用NucleoSpin○RmiRNA Plasma kit (Macherey-Nagel GmbH and Co.,KG,Düren,Germany), 即血漿miRNA提取試劑盒提取miRNA,進一步采用Nanodrop spectrophotometer (Thermo Fisher Scientific Inc.,Waltham,MA,USA)檢測儀測定總miRNA濃度。每個純化后的標本測定使用吸光度值比率表示(吸光度值=A260/280)。
1.4 定量RT-PCR檢測
在上述標本中加入3.5 μl合成miRNA-39 (cel-microRNA-39),其來源于秀麗隱桿線蟲(Caenorhabditiselegans),用于跟蹤標定對照,其工作濃度為1.6×108copies/μl。所提取miRNAs的定量和純度測定分別使用Agilent 公司的Agilent 2100 Bioanalyzer 和RNA 6000 Nano/Pico LabChip進行相應檢測。
進一步采取定量RT-PCR的方法標本中microRNA-520a的表達水平。為避免基因組DNA的污染及影響,首先采取如下措施以消除基因組DNA:(1)配制如下混合物--即5×gDNA Eraser緩沖液2.0 μl,1.0μl Gdna Eraser,然后加入微量總RNA后用RNase-free水補充至總量10.0 μl。(2)將前述混合物保持在42 ℃ 2 min,然后在4℃保存至進一步使用。(3)應用美國Applied Biosystems Thermo Fisher Scientific公司的TaqMan microRNA逆轉錄試劑盒(4366596)將總RNA逆轉錄為cDNA,試劑體系為總量20.0 μl,其中包括上述去除基因組DNA的10.0 μl體系,另外再加入4.0 μl 5 × PrimeScript緩沖液,1.0 μl PrimeScript RTEnzyme混合物I,以及1.0 μl RT引物混合物,最后加入4.0 μl RNase-free水。(4)采取定量PCR方法使用PCR7900熱循環儀(Applied Biosystems Thermo Fisher Scientific公司)檢測microRNA水平。各檢測模板的目標序列如表1所示。
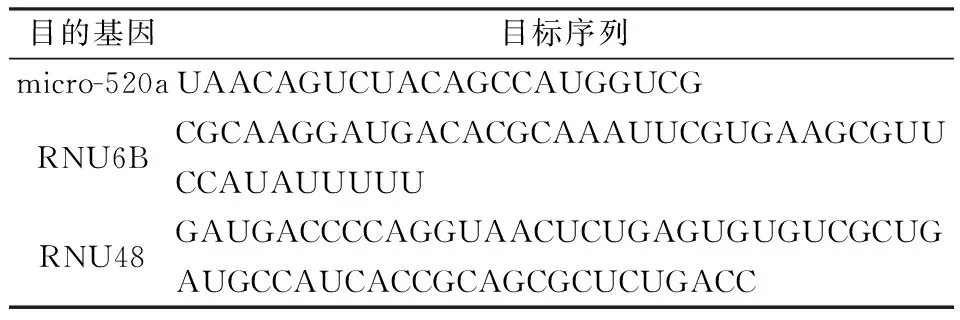
表1 各檢測模板的目標序列
PCR反應體系總體積為20.0 μl,其中包括10.0 μl LightCycler 480 SYBR Green I混合物(德國,羅氏公司),0.8 μl 正向PCR引物(10 μM),0.8 μl反向PCR引物(10 μM),1.0 μl cDNA模板(<100 ng)和7.4 μl RNase-free水。應用LightCycler 480(德國,羅氏公司)執行定量PCR檢測,反應條件如下:在95℃下預變性5 min;95℃ 12 s,60℃ 8 s,72℃ 15秒為一個循環,共40個循環;溶解度曲線分析為95℃ 5 s、65℃ 60 s;最后在40℃下冷卻30 s。每個反應進行6次。采用德國Bio-Rad公司CFX Manager Software v2.1 軟件計算相對microRNA-520a表達水平,計算方法使用2-ΔΔCt法[5]。
1.5 統計分析
全部試驗數據使用SPSS 18.0專用統計分析軟件進行統計分析。獨立樣本t檢驗和單因素方差分析用于確定組間差異。數據以平均值(mean)±標準偏差(standard deviation,SD)形式表示。受試者工作特征曲線即ROC曲線是用來鑒別mirRNA-520a的預測能力。 所有P值采用雙側檢驗,P<0.05提示顯著統計學差異。
2 結果
通過運用cel-microRNA-39的表達水平進行標準化后,結果顯示研究組microRNA-520a的血漿表達水平較對照組顯著升高(2.732±0.075)×10-2ng/ml vs (2.096±0.084)×10-2ng/ml;P<0.001,見圖1。 ROC曲線下面積(AUC)結果為0.92 (95%可信區間為0.86-0.97;P<0.001) (見圖2)。提示microRNA-520a在胎兒心臟缺陷兒的母體血漿中的表達水平顯著升高。
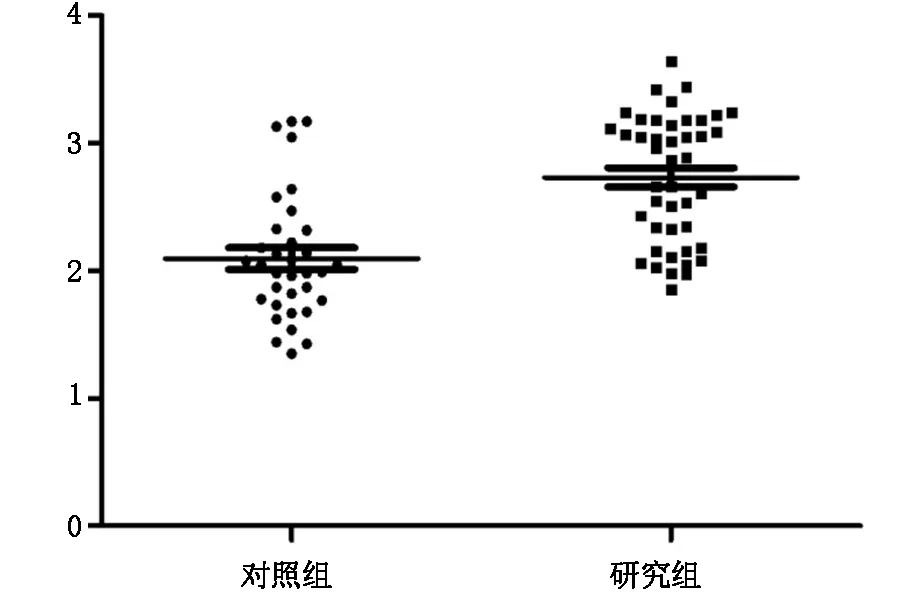
Y軸單位為10-2 ng/ml
3 討論
新的非侵入性檢測生物標志物對早期診斷胎兒的遺傳性疾病具有重大的臨床價值,其可能顯著改善早期診斷胎兒遺傳性疾病的準確性。MicroRNAs已被諸多研究證實,其在人類的發育過程中起著至關重要的作用[6]。Lazar等研究發現,microRNAs與胎兒心臟發育密切相關[7]。
已有研究證實,microRNA-520/373是聯系TGF-β和NF-κB通路之間的重要因素,其可能導致炎癥、影響腫瘤的轉移或進展過程[8]。miR-520-3p通過靶向MAP3K2,抑制非小細胞肺癌細胞的增殖、凋亡和轉移,miR-520-3p在臨床上可以作為非小細胞肺癌的預后標志物[9]。Mamczarz等證明過表達miR-520c-3p抑制細胞增殖及其全部基因的表達,從而調節DLBCL細胞的未成熟衰老過程,過表達miR-520c-3p可以抑制人類異種移植瘤在小鼠模型體內的生長過程[10]。
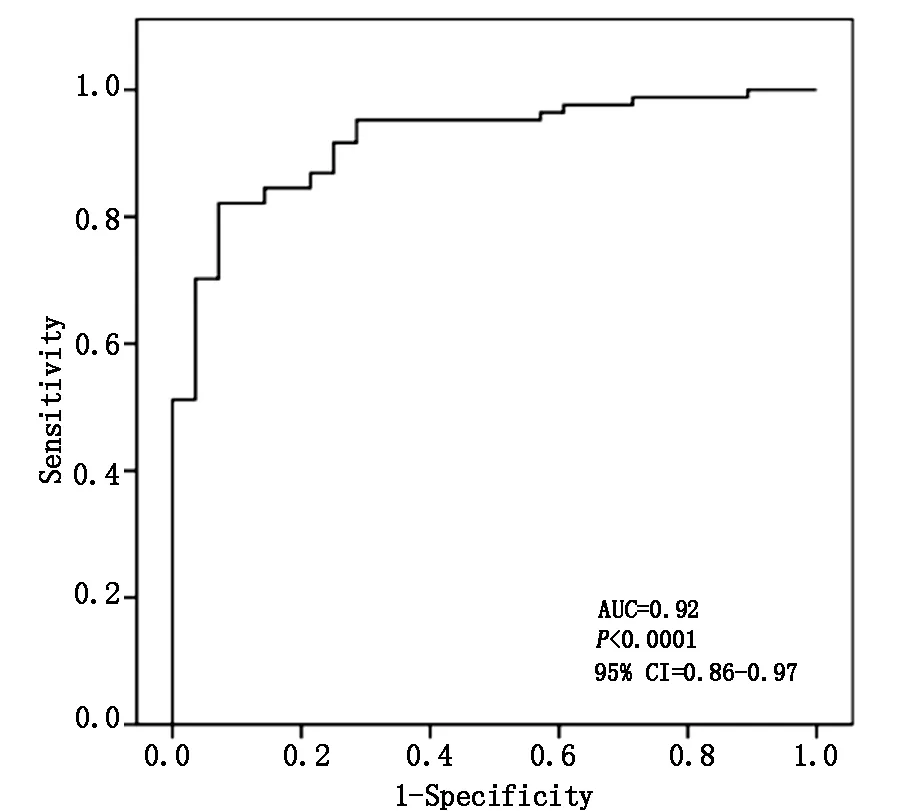
圖2 ROC曲線下面積(AUC)分析
本研究microRNA-520a作為非侵入性診斷標志物在胎兒先天性心臟缺陷的臨床診斷中的價值及意義。本研究中采用定量RT-PCR方法檢測microRNA-520a在78例妊娠期母親血漿中的表達水平,其中44例母親分娩胎兒后隨訪發現心臟先天性缺陷,而對照組34例胎兒心臟狀態正常。本結果提示,microRNA-520a在先天性心臟缺陷患兒母親血漿中的表達水平與正常對照組相比顯著上升 (P<0.001),ROC特征曲線下面積(AUC)為0.92 (95%可信區間為0.86-0.97;P<0.001)。研究提示,microRNA-520a的血漿表達水平與胎兒心臟缺陷存在一定的關系。因此,本研究提示microRNA-520a有可能作為組合性miRNA評估指標之一,母血microRNA-520a表達水平可能作為妊娠期胎兒的先天性心臟缺陷的非侵入性輔助診斷標志物,用于妊娠期胎兒的先天性心臟缺陷的早期篩查與評估。
在胚胎發育的過程中,心臟發育屬于其中一部分且是一個極為復雜的過程,與細胞多種生物學過程相關,包括細胞遷移、細胞黏附以及細胞周期等過程。心臟發育也涉及了多種理化過程,因此也受到相關因素的影響與調控。心臟的發育過程中,各種信號轉導通路及其相關的關鍵通路蛋白及調控因子均參與其中,也包括多種生長因子和轉錄因子[11]。而miRNAs作為轉錄后調控的關鍵因素之一,其雖為非編碼RNA,但可通過結合靶基因mRNA的3’非翻譯區起到直接使靶基因的mRNA降解或使之翻譯過程受到顯著抑制而發揮其細胞生物學功能。miRNAs廣泛參與的細胞生物學過程,對心臟發育也至關重要[12,13]。
在本研究中,本課題組首次通過一定樣本量的實驗研究了母血microRNA-520a水平與胎兒心臟缺陷的關系,為臨床篩查與診斷胎兒心臟出生缺陷提供新的輔助指標。

