NLRP3炎癥小體與炎癥性腸病的關系及針灸調節作用研究進展
吳麗潔,張霽,張丹,楊延婷,楊玲,智方圓,吳凌翔,謝晨,馬曉芃,
?
NLRP3炎癥小體與炎癥性腸病的關系及針灸調節作用研究進展
吳麗潔1,張霽1,張丹2,楊延婷1,楊玲2,智方圓1,吳凌翔2,謝晨2,馬曉芃1,2
(1.上海中醫藥大學,上海 201203;2.上海市針灸經絡研究所,上海 200030)
炎癥性腸病(inflammatory bowel disease, IBD)是一組慢性非特異性腸道炎癥性疾病,包括潰瘍性結腸炎(UC)和克羅恩病(CD)。炎癥小體作為一種大分子復合蛋白,在炎癥發生發展與機體固有免疫中發揮了重要作用。其中NLRP3在IBD的發生發展與維持腸道穩態的作用機制中起到了雙向調節的作用。該文綜述了NLRP3炎性小體在IBD中的研究進展以及針灸對其的調節作用及可能機制,以期為針灸治療炎癥性腸病的臨床和機制研究提供新思路。
炎癥性腸病;針灸療法;炎癥小體;NLRP3
炎癥性腸病(inflammatory bowel disease, IBD)是一組影響胃腸道功能的慢性炎癥性疾病,主要包括克羅恩病(CD)和潰瘍性結腸炎(UC)[1]。其發病機制尚未完全明確,可能與腸道上皮屏障功能的改變、腸道微生物失調、腸道先天免疫和飲食等因素相關[2]。NLRP3作為炎癥小體的其中一個亞型,是目前研究最多也是最具特點的一員,對炎癥性腸病的調控具有雙向調節作用[3]。大量的臨床實踐已證明,針灸治療炎癥性腸病療效確切[4-27],機制研究也逐步深入。探討NLRP3在IBD中的分子調節機制以及針灸干預作用,為針灸治療IBD提供可靠的科學依據具有重要意義。
1 NLRP3炎癥小體的組成
NLRP3炎癥小體是一種存在于細胞質中的蛋白復合物,由NLRP3、凋亡相關斑點樣蛋白(ASC)以及半胱天冬肽酶-1(caspase-1)前體蛋白結合而成。NLRP3由C端亮氨酸重復序列(LRR)和核苷酸寡聚化結構域(NACTH)以及N端效應結構域(PYD)組成[28],其中PYD連接ASC的PYD結構域后,ASC的C端CARD(caspase recruitment domain)結構域招募caspase-1前體,進而激活caspase-1,實現炎癥小體NLRP3的裝配[29]。靜息狀態時,NLRP3處于無活性狀態,只有被激活后才能轉化為炎癥小體發揮作用,具體的激活物分為病原相關分子模式(PAMPs)和損傷相關分子模式(DAMPs),其中PAMPS主要包括金黃色葡萄球菌、B組鏈球菌、李斯特氏菌、病毒[30-33]等;DAMPS主要包括尿酸或膽固醇結晶、b淀粉狀蛋白、三磷酸腺苷(ATP)等[34-36]。當PAMPs或DAMPs被Toll樣受體(第一信號)識別后,激活核轉錄因子NF-kB,啟動NLRP3、pro-IL-1b和pro-IL-18等的轉錄過程,進而上調炎癥小體的表達水平。第二信號(ATP,某些細菌毒素或顆粒物質)介導NLRP3的寡聚化,將NLRP3、ASC和caspase-1前體蛋白裝配成復合物,引起caspase-1的活化以及IL-1b和IL-18的分泌[37-38]。
2 NLRP3炎癥小體的激活途徑
目前,NLRP3炎癥小體主要存在4種激活路徑。①細胞外的ATP(三磷酸腺苷)充當NLRP3受體激動劑,通過結合表面受體P2X7,使離子通道打開。同時,細菌毒素使細胞膜形成空隙,從而誘導K﹢外流,從而導致NLRP3炎癥小體的組裝和激活。可以認為,K﹢外流是NLRP3炎癥小體的主要催化劑,而細胞外ATP和成孔毒素是炎癥因子分泌的主要誘因[39]。②在PAMPs和DAMPs影響下,損傷的線粒體激發活性氧(ROS)、線粒體DNA和心磷脂的產生,作為激活NLRP3炎癥小體的關鍵信號導致NLRP3裝配和激活[40-41]。③結晶或顆粒結構(如二氧化硅、石棉、淀粉樣蛋白b和明礬等)刺激吞噬細胞內環境的穩定,引起溶酶體破裂,組織蛋白酶B釋放到細胞質中,直接激活炎性小體[42]。④Ca2﹢通量和Ca2﹢依賴性信號觸發NLRP3炎癥小體組裝[43-44]。
最近的研究表明,NIMA相關激酶(NEK)家族的成員NEK7直接與NLRP3的LRR結構域結合,在K﹢外排和ROS產生作用下,完成炎癥小體的組裝與激活[45]。Wang W等[46]發現EV71(腸道病毒71)3D蛋白作為RNA依賴性RNA聚合酶,通過直接結合NLRP3刺激NLRP3炎性細胞的活化。除此之外,自噬功能障礙、線粒體鈣離子超載引起的功能失調、TXNIP的活化、PYD結構域的磷酸化、高爾基體介導的蛋白激酶D信號傳導、氯離子等因素也可以激活NLRP3炎癥小體[47-51]。NLRP3炎癥小體組裝與激活途徑如圖1所示。
然而NLRP3炎癥小體的不適當激活會破壞先天性免疫應答在人體的防御作用,研究表明,胰腺癌、動脈硬化、糖尿病、慢性肝病、帕金森等自身免疫相關性疾病都與其相關[52-56]。
3 NLRP3的負調控途徑
近幾年發現,NLRP3的激活可以被自噬等多種調控途徑所抑制。自噬作為一種自我降解過程,在某些條件下,可以選擇性去除特定的蛋白質和受損的細胞器(如線粒體)[57],從而維持細胞代謝平衡,實現內環境穩態。自噬由4個連續步驟組成,自噬體的形成,自噬膜的伸長和閉合,自噬體和溶酶體之間的融合以及降解,這種復雜過程在哺乳動物中至少由18個自噬相關基因(Atg基因)介導[58]。最近的研究已經確定了自噬相關基因在NLRP3炎癥細胞活化中的關鍵作用,如Saitoh T等[59]發現Atg16L1可以通過促進自噬體P62的降解來抑制IL-1b的分泌;van der Burgh R等[60]發現Atg7缺陷導致線粒體受損,NLRP3炎癥體活化,與自噬可以通過清除損傷的線粒體直接抑制NLRP3炎癥體激活的結論一致[61]。有研究[61-62]發現3MA(PI3K抑制劑)抑制自噬增加了mtROS的產生,導致在沒有炎性體刺激的情況下,NLRP3依賴性IL-1b分泌;在干預結核分枝桿菌感染的細胞時,3MA阻斷自噬體形成導致IL-1b分泌增加。Spalinger MR等[63]發現PTPN22(蛋白酪氨酸磷酸酶,非受體型22)的喪失通過自噬途徑,增強的NLRP3磷酸化水平抑制NLRP3炎癥體的激活。除此之外,作為Fork框架轉錄因子家族的成員,Foxo3a在營養缺乏條件下參與自噬形成。研究證實,Foxo3a在細胞核中被抑制使自噬功能受損,NLRP3炎癥細胞在KCs中被激活;Foxo3a的過表達恢復自噬通量,并通過促進Bim的轉錄來減弱NLRP3炎癥細胞的活化[64]。
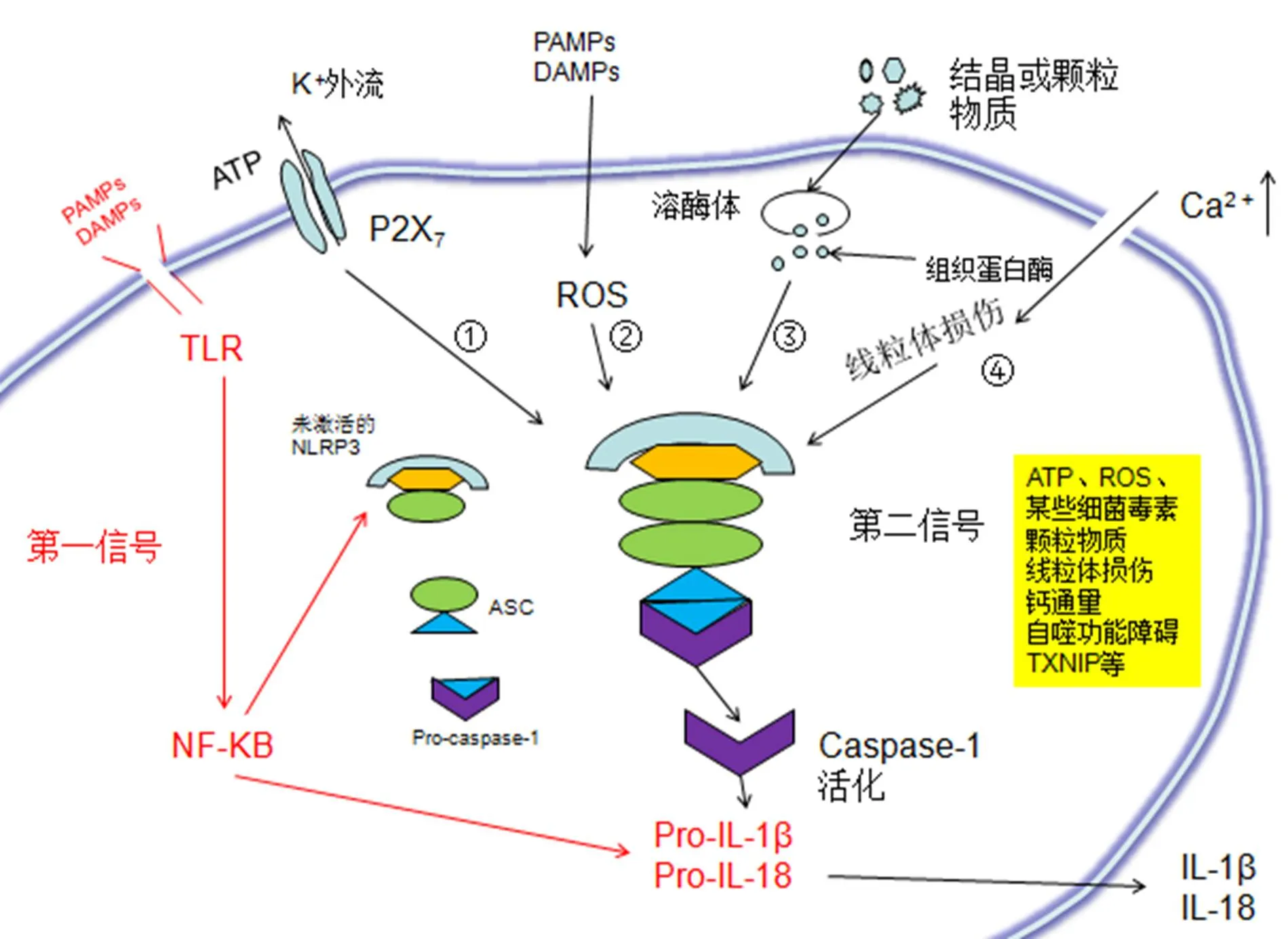
注:紅色箭頭與字體為第一信號,黑色為第二信號,①②③④為主要激活途徑
除自噬外,泛素相關蛋白可以負調控NLRP3的激活。E3泛素連接酶TRIM31(三分體基序蛋白31)被認為是NLRP3炎癥反應抑制因子,它可以直接結合NLRP3,促進NLRP3的K48連鎖聚泛素化和蛋白酶體降解,同時,TRIM31缺乏可以減輕DSS誘導的結腸炎[65]。另外,TRIM30通過抑制細胞內ROS的產生,從而抑制NLRP3炎癥小體激活[66]。
此外,NO與CO以及Nrf2(核轉錄因子E2相關因子2)通過抑制線粒體中ROS的產生,線粒體膜電位,和線粒體DNA在巨噬細胞中的胞內易位,維持線粒體穩定來抑制NLRP3的表達,ASC的裝配和IL-1b分泌達到負調控的作用[67-69]。研究發現,NLRP3炎癥體激活物觸發Src同源2域包含蛋白酪氨酸磷酸酶-2(SHP2)易位到線粒體,與腺嘌呤核苷酸translocase 1(ANT1)相互作用和去磷酸化抑制線粒體膜電位以及線粒體DNA和活性氧的釋放,從而防止NLRP3炎癥小體的過度激活[70]。
4 NLRP3炎癥小體與IBD的關系
近幾年的研究發現,NLRP3在IBD的發病與炎癥中具有促進炎癥與維持腸道穩態的雙重作用[3]。
4.1 NLRP3在IBD病理學中的促炎作用
研究顯示,在CD患者和患有急性或慢性結腸炎小鼠的結腸組織中存在NLRP3的高表達[33,71-73]。與NLRP3相關NLRs家族中的NOD1和NOD2存在于細胞質中,它們分別識別細菌肽聚糖、胞壁酰二肽,Paneth細胞、上皮細胞和抗原呈遞細胞中的轉錄因子NF-kB和AP-1被活化,導致促炎因子IL-b的釋放[74]。DE la Fuente M等[75]發現從IBD患者分離的大腸桿菌菌株可以通過NLRP3炎癥小體誘導小鼠巨噬細胞的IL-1b分泌。Liu W等[76]使用NLRP3依賴的pro-caspase-1、IL-1b和IL-18的抑制劑Fc11a-2來治療模型小鼠,急性結腸炎的癥狀得到減輕。Bauer C等[77]發現,與正常小鼠對比,NLRP3-/-小鼠在DSS造模的情況下,結腸炎的嚴重程度明顯下降。以上這些研究均提示,NLRP3對結腸炎的發生發展具有促進作用,且可以作為開發IBD患者的新型治療劑的潛在靶標。
4.2 NLRP3維持腸道內穩態作用
NLRP3在調節腸內穩態中起著關鍵作用,維持腸道上皮屏障完整性并降低實驗性結腸炎期間的死亡率,并影響腸道內生物群的組成[48,78-80]。研究發現攜帶NLRP3 R258W突變的CAPS模型小鼠通過調節性T細胞(Treg細胞)誘導IL-1b的分泌增加,促進局部抗微生物肽促進微生物群的重建,從而維持腸道穩態[81]。有學者[78-79,82]發現和NLRP3-/-、ASC-/-和caspase-1-/-小鼠對葡聚糖硫酸鈉(DSS)和2,4,6-三硝基苯磺酸(TNBS)誘導的結腸炎更易感染,小鼠腸道上皮細胞增殖缺陷,上皮屏障功能減弱,細菌的透過率升高,從而使易感性增加。除此之外,NLLRP3-/-小鼠在NO合成酶(iNOS)活性增加的誘導情況下,NO水平升高,IL-10和TGF-b表達降低,從而表明NLRP3可以在腸炎中下調炎癥反應,在腸內穩態中起關鍵作用[79]。在惡唑酮(OXA)誘導的結腸炎WT小鼠模型中,外源性IL-1b、IL-18可通過調節Th2細胞因子的表達,降低結腸炎的嚴重性。而NLRP3-/-小鼠結腸炎的嚴重性與Th2細胞因子的表達呈正相關。這提示NLRP3衍生的IL-1b、IL-18可以通過不同的機制抑制Th2細胞因子產生,減輕腸道損傷[83]。研究還發現NLRP3炎癥小體可以調節上皮細胞的衍生物IL-18的分泌,來維持腸道穩態[84]。以上研究均提示NLRP3炎癥小體對實驗性結腸炎有保護作用。
隨著研究的深入,雖然研究者對NLRP3炎癥小體有了較多的認識,但其在IBD中的作用機制尚不明確,對于NLRP3炎癥小體表達水平對結腸炎的影響仍然存在爭議。特別是在NLRP3-/-小鼠結腸炎模型中的結果差異,可能與誘導結腸炎的方案、實驗條件、遺傳背景和所使用的動物的性別以及不同小鼠之間不同微生物群落等差異相關[85]。所以如要確定NLRP3炎癥小體在穩定狀態條件下和在IBD中發揮的作用需要做進一步的研究。
5 針灸對炎癥性腸病NLRP3炎癥小體的作用與展望
目前,針灸對炎癥性腸病NLRP3炎癥小體是否有調節作用尚未見有報道,但業已證實針灸對NLRP3信號通路的激活因素、下游炎癥因子以及負調控的相關因素,有一定的調節作用,提示調節NLRP3炎癥小體及相關信號通路可能是針灸治療IBD的重要效應機制。
NF-kB與NLRP3炎癥小體的組裝與激活相關,研究發現針灸對IBD核轉錄因子NF-kB及下游炎癥因子有調節作用。
在克羅恩病中,研究發現電針刺激足三里、曲池穴能夠減輕TNBS誘導的結腸病變,與其下調IL-1b的表達,以及抑制p-IkBa和NF-kB p65等蛋白表達水平相關[86];艾灸天樞、氣海穴,能下調克羅恩病大鼠結腸NF-kB p65、TNF-a、IL-1b的表達,提示艾灸可能通過抑制克羅恩病大鼠結腸NF-kB p65的表達,進而減少其下游炎癥因子TNF-a、IL-1b的表達,從而減輕腸道炎癥,改善結腸組織形態結構,發揮治療作用[87]。在潰瘍性結腸炎中,研究發現,電針上巨虛能調節潰瘍性結腸炎IL-1b的異常表達,改善結腸黏膜損傷[88];大鼠潰瘍性結腸炎的發生涉及多種基因的表達異常,隔藥灸可通過調節IL-1b等諸多基因表達起到治療作用[89]。艾灸可通過抑制結腸組織NF-kB p65轉錄而下調TLR-9表達,從而修復UC大鼠受損黏膜上皮,抑制血清中IL-8含量,提高血清中IL-10含量,且灸量越大效果越明顯[90]。還有研究發現調控TLR/MyD88/NF-kB信號轉導通路中MyD88、TRAF6的表達是隔藥灸調節潰瘍性結腸炎結腸黏膜局部過激免疫炎癥反應的作用途徑之一[91]。
除此之外,針灸對NLRP3負調控途徑的相關因素也有一定的作用。有研究發現,在金黃色葡萄球菌引起的巨噬細胞感染中,溫和灸可以下調IL-1b、iNOS以及caspase-1的表達,減輕炎癥;除此之外還證實了,溫和灸是通過下調自噬mTOR通路中Akt的磷酸化水平來起到作用的[92]。
綜上所述,針灸對NLRP3炎癥小體下游炎癥因子、調控途徑均有一定的調節作用。NLRP3炎癥小體作為系列炎癥反應的核心,可能是針灸防治炎癥性腸病新的重要靶點。探討艾灸調節炎癥小體及其相關信號通路治療炎癥性腸病的效應機制,對于炎癥性腸病的防治至關重要。以NLRP3炎癥小體為介入點,觀察針灸對炎癥性腸病NLRP3炎癥小體及上下游通路信號分子的調節作用,闡釋針灸對NLRP3炎癥小體調控的分子機制,有助于進一步闡明針灸防治炎癥性腸病的作用機制,為臨床炎癥性腸病的針灸治療提供科學證據。
[1] Gersemann M, Wehkamp J, Stange EF. Innate immune dysfunction in inflammatory bowel disease[J]., 2012,271(5):421-428.
[2] de Souza HS, Fiocchi C. Immunopathogenesis of IBD: current state of the art[J]., 2016,13(1):13-27.
[3] Gorfu G, Cirelli KM, Melo MB,. Dual role for inflammasome sensors NLRP1 and NLRP3 in murine resistance to Toxoplasma gondii[J]., 2014,5(1): e01117-e01123.
[4] 包春輝,吳璐一,吳煥淦,等.針灸治療活動期克羅恩病:隨機對照研究[J].中國針灸,2016,36(7):683-688.
[5] 陳俊玲,趙洪霄.隔藥餅灸治療慢性潰瘍性結腸炎50例療效觀察[J].新疆中醫藥,2017,35(1):13-15.
[6] 陳淑君.穴位埋線治療潰瘍性結腸炎的療效及對抗中性粒細胞胞漿抗體的影響[J].中醫臨床研究,2015,7 (3):78-80.
[7] 高培彥.中醫針灸對潰瘍性結腸炎的臨床療效觀察[J].大家健康(學術版),2015,9(9):21.
[8] 郭保君,陸鵬,張鐳瀟,等.針灸健脾補腎法治療潰瘍性結腸炎療效觀察[J].四川中醫,2016,34(5):182-185.
[9] 韓國勇.溫針灸治療脾腎陽虛型慢性潰瘍性結腸炎臨床研究[J].亞太傳統醫藥,2015,11(22):102-103.
[10] 何邦廣,吳海標,錢火輝.溫針灸治療脾虛型潰瘍性結腸炎臨床觀察[J].吉林中醫藥,2009,29(5):410-411.
[11] 賀君,廖穆熙,孟珍珍.針刺聯合臍環穴隔姜灸治療脾腎陽虛型潰瘍性結腸炎臨床療效及對相關炎性因子的影響[J].廣州中醫藥大學學報,2015,32(4):687-689, 693.
[12] 黃艷平.艾灸在潰瘍性結腸炎臨床治療中應用觀察[J].中國現代藥物應用,2015,9(21):259-260.
[13] 蔣海燕.中醫針灸治療慢性潰瘍性結腸炎療效觀察[J].中醫臨床研究,2015,7(30):109-110.
[14] 劉小紅.針灸治療慢性潰瘍性結腸炎的臨床療效[J].光明中醫,2016,31(21):3173-3174.
[15] 陸嫄,包春輝,吳璐一,等.艾灸治療潰瘍性結腸炎的臨床與實驗研究進展[J].中華中醫藥學刊,2013,31 (6):1261-1264.
[16] 欒炳玉.針灸治療潰瘍性結腸炎療效觀察[J].亞太傳統醫藥,2016,12(20):90-91.
[17] 呂偉.重灸神闕穴治療脾腎陽虛型潰瘍性結腸炎[J].內蒙古中醫藥,2015,34(9):46.
[18] 米嬿.針灸治療慢性潰瘍性結腸炎的療效觀察[J].內蒙古中醫藥,2015,34(3):50-51.
[19] 歐亞,吾爾納,徐君超.溫針灸治療脾虛型潰瘍性結腸炎35例臨床觀察[J].中國民族民間醫藥,2014,15 (24):55,57.
[20] 宋宸宇.艾灸治療脾胃虛寒型潰瘍性結腸炎60例臨床分析[J].亞太傳統醫藥,2014,10(21):53-54.
[21] 宋宸宇,劉麗爽.艾灸治療脾腎陽虛型潰瘍性結腸炎30例臨床體會[J].亞太傳統醫藥,2015,11(18):98- 99.
[22] 王允娜,牛崇信.溫通針法治療脾腎陽虛型潰瘍性結腸炎臨床療效及對相關炎性因子的影響[J].西部中醫藥, 2017,30(5):114-116.
[23] 王增.探討中醫針灸治療慢性潰瘍性結腸炎療效[J].光明中醫,2016,31(8):1142-1144.
[24] 肖再軍.穴位艾灸治療脾腎陽虛型潰瘍性結腸炎102例臨床觀察[J].北方藥學,2014,11(3):98-99.
[25] 許力榮.中醫針灸治療慢性潰瘍性結腸炎療效觀察[J].世界最新醫學信息文摘,2016,16(49):206.
[26] 楊金鎖.中醫針灸治療慢性潰瘍性結腸炎的方法及效果評價[J].中醫臨床研究,2016,8(26):27-28.
[27] 楊周雨,賁定嚴,易展,等.隔藥餅灸治療脾虛濕蘊證輕中度潰瘍性結腸炎臨床研究[J].中國中醫藥信息雜志, 2017,24(4):32-35.
[28] Garib FY, Rizopulu AP, Kuchmiy AA,. Inactivation of Inflammasomes by Pathogens Regulates Inflamma- tion[J].(), 2016,81(11):1326-1339.
[29] Bryan NB1, Dorfleutner A, Rojanasakul Y,. Activation of inflammasomes requires intracellular redistribution of the apoptotic speck-like protein containing a caspase recruitment domain[J]., 2009,182(5):3173-3182.
[30] Mariathasan S, Weiss DS, Newton K,. Cryopyrin activates the inflammasome in response to toxins and ATP[J]., 2006,440(7081):228-232.
[31] Costa A, Gupta R, Signorino G,. Activation of the NLRP3 inflammasome by group B streptococci[J]., 2012,188(4):1953-1960.
[32] Duncan JA, Gao X, Huang MT,. Neisseria gonorrhoeae activates the proteinase cathepsin B to mediate the signaling activities of the NLRP3 and ASC- containing inflammasome[J]., 2009,182(10): 6460-6469.
[33] Allen IC, Scull MA, Moore CB,. The NLRP3 inflammasome mediates in vivo innate immunity to
influenza A virus through recognition of viral RNA[J]., 2009,30(4):556-565.
[34] Vanaja SK, Rathinam VA, Fitzgerald KA. Mechanisms of inflammasome activation: recent advances and novel insights[J]., 2015,25(5):308-315.
[35] Dostert C, Pétrilli V, Van Bruggen R,. Innate immune activation through Nalp3 inflammasome sensing of asbestos and silica[J]., 2008,320(5876):674- 677.
[36] Abderrazak A, Syrovets T, Couchie D,. NLRP3 inflammasome: from a danger signal sensor to a regulatory node of oxidative stress and inflammatory diseases[J]., 2015,4:296-307.
[37] Franchi L, Mu?oz-Planillo R, Nú?ez G. Sensing and reacting to microbes through the inflammasomes[J]., 2012,13(4):325-332.
[38] Lamkanfi M, Dixit VM. Mechanisms and functions of inflammasomes[J]., 2014,157(5):1013-1022.
[39] Karmakar M, Katsnelson MA, Dubyak GR,. Neutrophil P2X7 receptors mediate NLRP3 inflammasome-dependent IL-1bsecretion in response to ATP[J]., 2016,7:10555.
[40] Crane DD, Bauler TJ, Wehrly TD,. Mitochondrial ROS potentiates indirect activation of the AIM2 inflammasome[J]., 2014,5:438.
[41] Park S, Won JH, Hwang I,. Defective mitochondrial fission augments NLRP3 inflammasome activation[J]., 2015,5:15489.
[42] Lima H Jr, Jacobson LS, Goldberg MF,. Role of lysosome rupture in controlling Nlrp3 signaling and necrotic cell death[J]., 2013,12 (12):1868-1878.
[43] Lee GS, Subramanian N, Kim AI,. The calcium- sensing receptor regulates the NLRP3 inflammasome through Ca2﹢and cAMP[J]., 2012,492 (7427):123-127.
[44] Murakami T, Ockinger J, Yu J,. Critical role for calcium mobilization in activation of the NLRP3 inflammasome[J]., 2012,109 (28):11282-11287.
[45] Shi H, Wang Y, Li X,. NLRP3 activation and mitosis are mutually exclusive events coordinated by NEK7, a new inflammasome component[J]., 2016,17(3):250-258.
[46] Wang W, Xiao F, Wan P,. EV71 3D protein binds with NLRP3 and enhances the assembly of inflammasome complex[J]., 2017,13(1): e1006123.
[47] Jabir MS, Hopkins L, Ritchie ND,. Mitochondrial damage contributes to Pseudomonas aeruginosa activation of the inflammasome and is downregulated by autophagy[J]., 2015,11(1):166-182.
[48] Miao H, Ou J, Ma Y,. Macrophage CGI-58 deficiency activates ROS-inflammasome pathway to promote insulin resistance in mice[J]., 2014,7 (1):223-235.
[49] Stutz A, Kolbe CC, Stahl R,. NLRP3 inflammasome assembly is regulated by phosphorylation of the pyrin domain[J]., 2017,214(6):1725-1736.
[50] Zhang Z, Meszaros G, He WT,. Protein kinase D at the Golgi controls NLRP3 inflammasome activation[J]., 2017,214(9):2671-2693.
[51] Tang T, Lang X, Xu C,. CLICs-dependent chloride efflux is an essential and proximal upstream event for NLRP3 inflammasome activation[J]., 2017, 8(1):202.
[52] Daley D, Mani VR, Mohan N,. NLRP3 signaling drives macrophage-induced adaptive immune suppression in pancreatic carcinoma[J]., 2017, 214(6):1711-1724.
[53] Sharma A, Tate M, Mathew G,. Oxidative stress and NLRP3-inflammasome activity as significant drivers of diabetic cardiovascular complications: therapeutic implications[J]., 2018,9:114.
[54] Wu X, Dong L, Lin X,. Relevance of the NLRP3 Inflammasome in the Pathogenesis of Chronic Liver Disease[J]., 2017,8:1728.
[55] Sarkar S, Malovic E, Harishchandra DS,. Mitochon- drial impairment in microglia amplifies NLRP3 inflammasome proinflammatory signaling in cell culture and animal models of Parkinson’s disease[J]., 2017,3:30.
[56] Wang R, Wang Y, Mu N,. Activation of NLRP3 inflammasomes contributes to hyperhomocysteinemia- aggravated inflammation and atherosclerosis in apoE- deficient mice[J]., 2017,97(8):922-934.
[57] Saito T, Sadoshima J. Molecular mechanisms of mitoch- ondrial autophagy/mitophagy in the heart[J]., 2015,116(8):1477-1490.
[58] Mizushima N, Levine B. Autophagy in mammalian development and differentiation[J]., 2010,12(9):823-830.
[59] Saitoh T, Fujita N, Jang MH,. Loss of the autophagy protein Atg16L1 enhances endotoxin-induced IL-1beta production[J]., 2008,456(7219):264-268.
[60] van der Burgh R, Nijhuis L, Pervolaraki K,. Defects in mitochondrial clearance predispose human monocytes to interleukin-1bhypersecretion[J]., 2014, 289(8):5000-5012.
[61] Alfonso-Loeches S, Ure?a-Peralta JR, Morillo-Bargues MJ,. Role of mitochondria ROS generation in ethanol-induced NLRP3 inflammasome activation and cell death in astroglial cells[J]., 2014, 8:216.
[62] Harris J, Hartman M, Roche C,. Autophagy controls IL-1beta secretion by targeting pro-IL-1beta for degradation[J]., 2011,286(11):9587- 9597.
[63] Spalinger MR, Lang S, Gottier C,. PTPN22 regulates NLRP3-mediated IL1B secretion in an autophagy- dependent manner[J]., 2017,13 (9):1590-1601.
[64] Liu Y, Zhang W, Wu X,. Foxo3a-dependent Bim transcription protects mice from a high fat diet via inhibition of activation of the NLRP3 inflammasome by facilitating autophagy flux in Kupffer cells[J]., 2017,8(21):34258-34267.
[65] Song H, Liu B, Huai W,. The E3 ubiquitin ligase TRIM31 attenuates NLRP3 inflammasome activation by promoting proteasomal degradation of NLRP3[J]., 2016,7:13727.
[66] Hu Y, Mao K, Zeng Y,. Tripartite-motif protein 30 negatively regulates NLRP3 inflammasome activation by modulating reactive oxygen species production[J]., 2010,185(12):7699-7705.
[67] Jung SS, Moon JS, Xu JF,. Carbon monoxide negatively regulates NLRP3 inflammasome activation in macrophages[J]., 2015,308(10):L1058-L1067.
[68] Liu X, Zhang X, Ding Y,. Nuclear factor E2-related factor-2 negatively regulates NLRP3 inflammasome activity by inhibiting reactive oxygen species-induced NLRP3 priming[J].al, 2017,26(1): 28-43.
[69] Mao K, Chen S, Chen M,. Nitric oxide suppresses NLRP3 inflammasome activation and protects against LPS-induced septic shock[J]., 2013,23(2): 201-212.
[70] Guo W, Liu W, Chen Z,. Tyrosine phosphatase SHP2 negatively regulates NLRP3 inflammasome activation via ANT1-dependent mitochondrial homeostasis[J]., 2017,8(1):2168.
[71] Zhang J, Fu S, Sun S,. Inflammasome activation has an important role in the development of spontaneous colitis[J]., 2014,7(5):1139-1150.
[72] Bauer C, Duewell P, Lehr HA,. Protective and aggravating effects of Nlrp3 inflammasome activation in IBD models: influence of genetic and environmental factors[J]., 2012,30(Suppl 1):82-90.
[73] Zhang Z, Shen P, Lu X,.andstudy on the efficacy of terpinen-4-ol in dextran sulfate sodium- induced mice experimental colitis[J]., 2017,8:558.
[74] Sahoo BR, Swain B, Dikhit MR,. Activation of nucleotide-binding oligomerization domain 1 (NOD1) receptor signaling in Labeo rohita by iE-DAP and identification of ligand-binding key motifs in NOD1 by molecular modeling and docking[J]., 2013,170(6):1282-1309.
[75] De la Fuente M, Franchi L, Araya D,. Escherichia coli isolates from inflammatory bowel diseases patients survive in macrophages and activate NLRP3 inflammasome[J]., 2014,304(3-4): 384-392.
[76] Liu W, Guo W, Wu J,. A novel benzo[d]imidazole derivate prevents the development of dextran sulfate sodium-induced murine experimental colitis via inhibition of NLRP3 inflammasome[J]., 2013,85(10):1504-1512.
[77] Bauer C, Duewell P, Mayer C,. Colitis induced in mice with dextran sulfate sodium (DSS) is mediated by the NLRP3 inflammasome[J]., 2010,59 (9):1192-1199.
[78] Hirota SA, Ng J, Lueng A,. NLRP3 inflammasome plays a key role in the regulation of intestinal homeostasis[J]., 2011,17 (6):1359-1372.
[79] Zaki MH, Boyd KL, Vogel P,. The NLRP3 inflammasome protects against loss of epithelial integrity and mortality during experimental colitis[J]., 2010,32(3):379-391.
[80] Dupaul-Chicoine J, Yeretssian G, Doiron K,. Control of intestinal homeostasis, colitis, and colitis-associatedcolorectal cancer by the inflammatory caspases[J]., 2010,32(3):367-378.
[81] Yao X, Zhang C, Xing Y,. Remodelling of the gut microbiota by hyperactive NLRP3 induces regulatory T cells to maintain homeostasis[J]., 2017,8 (1):1896.
[82] Allen IC, TeKippe EM, Woodford RM,. The NLRP3 inflammasome functions as a negative regulator of tumorigenesis during colitis-associated cancer[J]., 2010,207(5):1045-1056.
[83] Itani S, Watanabe T, Nadatani Y,. NLRP3 inflammasome has a protective effect against oxazolone- induced colitis: a possible role in ulcerative colitis[J]., 2016,6:39075.
[84] Liu JJ, Davis EM, Wine E,. Epithelial cell extrusion leads to breaches in the intestinal epithelium[J]., 2013,19(5):912-921.
[85] Elinav E, Thaiss CA, Flavell RA. Analysis of microbiota alterations in inflammasome-deficient mice[J]., 2013,1040:185-194.
[86] 施麗薇,顧晗,劉明江,等.針刺對潰瘍性結腸炎大鼠結腸炎性細胞因子及細胞凋亡的影響[J].針刺研究, 2017,42(1):56-61.
[87] 魏凱,張丹,竇傳字,等.艾灸對克羅恩病大鼠結腸NF-kB p65及TNF-a、IL-1b調節作用的研究[J].世界中醫藥,2013,8(8):862-866,870.
[88] 易細芹,張泓,凌希,等.電針對潰瘍性結腸炎大鼠結腸IL-1b及nAchRa7mRNA的影響[J].上海針灸雜志,2016, 35(10):1251-1255.
[89] 吳煥淦,劉慧榮,趙琛,等.隔藥灸治療大鼠潰瘍性結腸炎差異表達基因研究[J].中國針灸,2005,25(5):359- 365.
[90] 馬鐵明,韓洋,馬賢德,等.不同灸量對潰瘍性結腸炎大鼠結腸上皮形態學及血清中炎性細胞因子、結腸組織中炎性細胞信號轉導通路的影響[J].針刺研究,2014, 39(1):20-26.
[91] 楊玲,吳璐一,竇傳字,等.隔藥灸對潰瘍性結腸炎大鼠結腸黏膜MyD88及TRAF6表達的影響[J].中華中醫藥學刊,2013,31(9):1864-1866,2080-2081.
[92] 李曉娟.溫和灸對小鼠細菌感染炎癥的影響及其自噬機制研究[D].湖北中醫藥大學,2014.
Research Advances in the Relationship Between NLRP3 Inflammasome and Inflammatory Bowel Disease and the Regulating Effect of Acupuncture and Moxibustion
1,1,2,1,2,1,2,2,1,2.
1.201203,; 2.200030,
Inflammatory bowel disease (IBD) is a group of chronic nonspecific inflammatory intestinal diseases including Crohn's disease (CD) and ulcerative colitis (UC). The inflammasome is macromolecular multiprotein and plays an important role in inflammatory occurrence and development and bodily innate immunity. NLRP3 inflammasome produces a bidirectional regulating effect in the occurrence and development of IBD and the mechanism of maintaining intestinal homeostasis. This article reviews research advances in NLRP3 inflammasome in IBD, and the regulating effect of acupuncture and moxibustion on it and the possible mechanism to provide a new idea for clinical and mechanism studies of acupuncture-moxibustion treatment for inflammatory bowel disease.
Inflammatory bowel disease; Acupuncture-moxibustion therapy; Inflammasome; NLRP3
1005-0957(2018)08-0961-08
R2-03
A
10.13460/j.issn.1005-0957.2018.08.0961
2018-03-20
國家自然科學基金項目(81674073,81273843);國家重點基礎研究發展計劃項目(2015CB554501);上海市衛生和計劃生育委員會項目(2017BR047)
吳麗潔(1990—),女,2017級博士生,Email:wljzwb@163.com
馬曉芃(1973—),女,研究員,博士生導師,Email:pengpengma@163.com

