基于魚鱗貯藏方式改善鳙魚魚鱗明膠的功能特性
沙小梅,涂宗財,,*,黃 濤,胡姿姿,王 輝,張 露,李 鑫,王振興
鳙魚(Hypophthalmichthys nobilis)是一種產自亞洲的淡水魚,廣泛分布于湖泊和河流中。鳙魚已經被引入歐洲、南美洲和北美洲的70多個國家[1]。在中國,鳙魚是四大家魚之一,其他3 種為青魚(Mylopharyngodon piceus)、鰱魚(Hypophthalmichthys molitrix)和草魚(Ctenopharyngodon idella)[2]。據報道,早在2010年,我國鯉科魚類年產量已達到1 500萬 t[3]。據中國漁業統計年鑒,2015年我國鳙魚養殖產量達到335.944萬 t。
魚鱗是魚制品加工過程中的主要廢棄物之一,其富含膠原蛋白,是一種良好的明膠原料[4]。近些年來,有關魚鱗明膠的研究漸漸增加,主要集中在魚鱗預處理[5]、制備過程[6]、明膠改性[7]等。Karim等[8]的報道指出,原料的貯藏方式會對明膠的功能性質產生很大影響。熱風干燥作為一種食品保存手段,廣泛應用于食品工業。工業上的烘干機通常是采用熱風或者直接將燃燒氣體作為干燥媒介[9]。太陽曬干是一種傳統且低成本的脫水方式,這種利用太陽對物質進行干燥的方式在當代仍被廣泛使用[10]。眾所周知,一般情況下,低溫能有效延長食品的貯藏期,冰箱貯藏就是一個日常生活中用于食物保藏的典型方式。
因此,本實驗選取熱風干燥、太陽曬干和低溫保藏方式處理魚鱗,研究其對制備的魚鱗明膠功能性質(凝膠強度、乳化性、起泡性)的影響,探尋能夠提高鳙魚魚鱗明膠功能性質的原料貯藏方式。此外,采用傅里葉變換紅外光譜(Fourier transform infrared spectra,FTIR)、十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)和掃描電子顯微鏡(scanning electron microscope,SEM)探究魚鱗貯藏方式對明膠結構特性的影響。
1 材料與方法
1.1 材料與試劑
鳙魚魚鱗為市售。
蛋白分子質量Marker 美國Thermo Scientific公司;KBr(光譜級) 上海晶純實業有限公司;其他均為分析純。
1.2 儀器與設備
Nicolet 5700 FTIR儀 美國Thermo公司;環境SEM 德國FEI Deutschland GmbH公司;CT3質構分析儀 美國Brookfield公司;T25分散機 德國IKA公司;T6新世紀紫外-可見分光光度計 北京普析通用儀器有限公司。
1.3 方法
1.3.1 魚鱗的貯藏
將新鮮魚鱗清洗3 遍以去除雜質,再等分成5 份。第1份魚鱗直接用于明膠的制備,作為空白組;第2份魚鱗在約30 ℃下日光曬約48 h,至水分質量分數低于10%,然后在室溫(約25 ℃)下貯藏1 個月;第3份魚鱗置于4 ℃貯藏1 個月;第4份魚鱗置于-20 ℃貯藏1 個月;第5份魚鱗在60 ℃烘干至水質量分數低于10%,然后在室溫(約25 ℃)下貯藏1 個月。
1.3.2 魚鱗明膠的提取
5 份魚鱗分別置于組織搗碎機中搗碎5 min,以去除魚鱗表面的銀白色物質。接下來對魚鱗進行脫鈣處理,脫鈣工藝如下:鹽酸濃度0.5 mol/L、料液比1∶25(m/V)、脫鈣時間1 h。脫鈣后,進一步清洗魚鱗以去除殘存的酸液,以用于下一步的魚鱗明膠提取。基于課題組前期研究[11]并進行適當的修改,確定魚鱗明膠的制備工藝如下:濕魚鱗和去離子水1∶3(m/V)、加熱溫度80 ℃、制備時間2 h。過濾去除魚鱗殘渣,將濾液置于60 ℃的旋轉蒸發儀中,將濾液體積蒸發至原體積的1/3。凍干濃縮后的魚鱗明膠,備用。測定不同方式貯藏魚鱗后制備得到的明膠組成。結果顯示,所有明膠樣品都具有高蛋白質量分數(90.87%~92.53%)、低水分質量分數(4.89%~6.43%)和低灰分質量分數(0.39%~0.94%)。
1.3.3 魚鱗明膠的結構特性測定
SDS-PAGE實驗方法[12]如下:質量分數5%濃縮膠和質量分數7.5%分離膠。制備5 mg/mL的魚鱗明膠樣品,在95 ℃加熱5 min,再5 000×g離心10 min,取10 μL上清液上樣。
FTIR光譜測定方法[13]如下:將干燥的明膠樣品和光譜級的KBr粉末混合均勻,并壓成片狀。魚鱗明膠的FTIR光譜圖采用Nicolet 5700 FTIR儀在波數范圍400~4 000 cm-1采集,獲得的數據繪制成以吸光度為y軸和以波數為x軸的圖譜。
SEM的測定參考Chen Jun等[14]的方法。將10 mg/mL的魚鱗明膠溶液凍干,置于樣品臺的導電膠上。采用環境SEM在低真空模式下放大1 000 倍拍攝魚鱗明膠的微觀結構。
1.3.4 魚鱗明膠的功能性質測定
魚鱗明膠的凝膠強度測定方法[7]如下:在55 ℃水浴鍋中利用去離子水溶解魚鱗明膠制備成66.7 mg/mL溶液,在10 ℃下冷卻16~18 h。采用質構分析儀以直徑1.27 cm的平底圓柱形探頭測定魚鱗明膠的凝膠強度,測試速率為1 mm/s。當魚鱗明膠樣品被擠壓4 mm時產生的最大受力(g)即為凝膠強度。樣品規格:直徑33 mm,高度22 mm。
魚鱗明膠的乳化活性根據Nagarajan等[15]的方法進行適當修改,9 mL魚鱗明膠溶液(1 mg/mL)和3 mL大豆油混合,在T25分散機中9 500 r/min下分散1 min。立即從燒杯底部取100 μL乳濁液,加入5 mL 1 mg/mL的SDS溶液,混勻10 s后,立即采用紫外-可見分光光度計測定其在波長500 nm處的吸光度(A0),乳化活性的計算見式(1)。
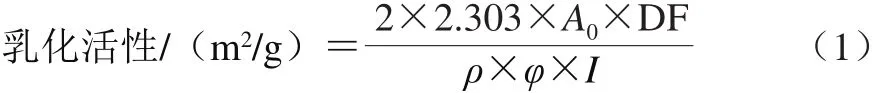
式中:DF表示為稀釋系數(50);ρ表示蛋白質量濃度(1 000 g/m3);φ表示油占乳濁液的比例(0.25);I表示比色皿的寬度(0.01 m)。
魚鱗明膠起泡能力的測定參考Shyni等[16]的方法,并略作修改。運用T25分散機以13 500 r/min分散20 mL 2 mg/mL魚鱗明膠溶液2 min,再將起泡后的溶液倒入50 mL的量筒中,立即記錄總的樣品體積。起泡能力按照式(2)進行計算。

1.4 數據分析
所有實驗均測定3 次平行,結果取平均值。數據通過SPSS 17.0軟件進行分析,選取Duncan’s新復極差法用于顯著性分析,P<0.05表示差異顯著。
2 結果與分析
2.1 魚鱗明膠的分子質量分析
如圖1所示,所有的魚鱗明膠樣品均含有特征性的α鏈(α1和α2)、β鏈(兩條α鏈共價交聯形成)和高分子質量聚合物(high molecule weight polymer,HMWP)。相比新鮮魚鱗和60 ℃熱風干燥魚鱗制備得到的明膠,太陽曬干和低溫方式(4 ℃和-20 ℃)貯藏的魚鱗制備得到的明膠具有更多的α鏈、β鏈和HMWP。在所有的魚鱗明膠樣品中,新鮮魚鱗和60 ℃熱風干燥魚鱗制備得到的明膠具有更多分子質量低于100 Da的多肽。這些結果與Liu Haiying等[17]的報道一致,其研究結果表明,相比于25 ℃熱風干燥魚鱗和-18 ℃低溫貯藏魚鱗制備的明膠,新鮮魚鱗制備的明膠含有較少的α鏈、β鏈和HMWP。干燥會引起蛋白質結構的改變,如脫水和變性[18]。脫水可能會促進蛋白質間的相互作用,并誘導蛋白質發生聚集,從而影響明膠的形成[19]。因此,太陽曬干后的魚鱗制備得到的明膠具有更多的α鏈、β鏈和HMWP。同樣的,魚鱗在低溫條件下(4 ℃、-20 ℃)因水分蒸發而引起脫水,因此制備得到的明膠含有較多的高分子質量成分。值得說明的是,蛋白質在較高干燥溫度下可能會發生變性,而變性會促使蛋白質丟失其特有的結構特征,包括氫鍵和常用于維持蛋白質分子穩定的二級結構。60 ℃熱風干燥可能引發魚鱗膠原蛋白發生變性,進而使得制備的明膠具有更少的α鏈、β鏈和HMWP。
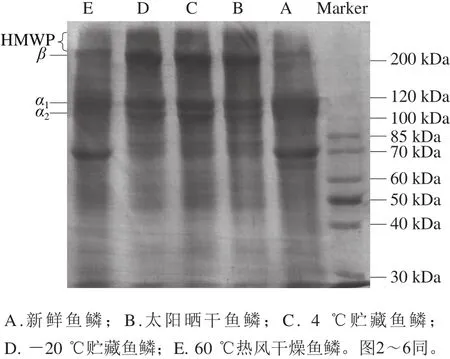
圖1 魚鱗經不同方式貯藏后制備的明膠電泳圖Fig. 1 SDS-PAGE profile of fish gelatin extracted from bighead scales under various conditions
2.2 魚鱗明膠的FTIR分析
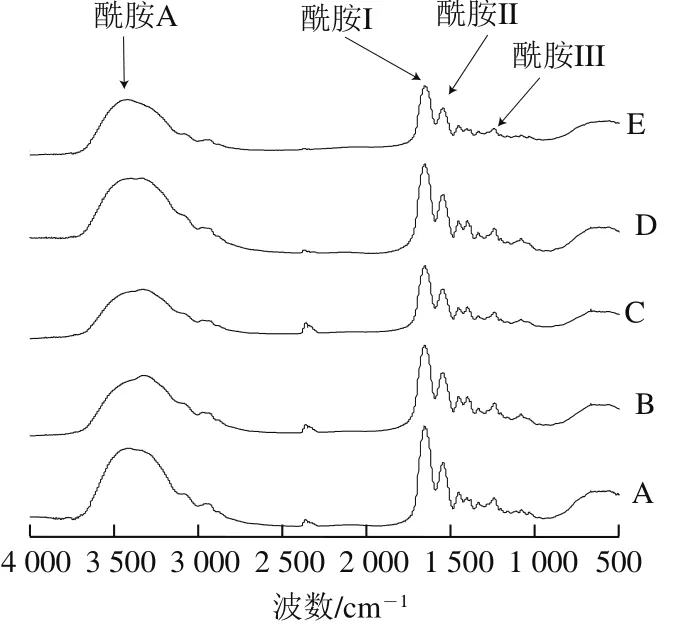
圖2 魚鱗經不同方式貯藏后制備的明膠FTIR圖Fig. 2 FTIR spectra of fish gelatin extracted from bighead scales under various storage conditions
由圖2可知,所有的魚鱗明膠樣品都含有4 個類似的酰胺帶吸收峰:酰胺A帶(3 440~3 300 cm-1)、酰胺I帶(1 600~1 700 cm-1)、酰胺II帶(1 560~1 540 cm-1)、酰胺III帶(1 250~1 230 cm-1),表明所有貯藏魚鱗的方式都不會破壞明膠的功能性基團。新鮮、太陽曬干、4 ℃貯藏、-20 ℃貯藏和60 ℃熱風干燥的魚鱗制備的明膠酰胺A帶吸收峰波數分別為3 401.98、3 336.91、3 332.67、3 337.29 cm-1和3 400.41 cm-1。酰胺A帶吸收峰是由N—H伸縮振動引起的。一般而言,單獨的N—H伸縮振動引起的酰胺A帶吸收峰的波數在3 400~3 440 cm-1范圍內。當N—H基團涉及氫鍵,酰胺A帶吸收峰將向低波數移動。氫鍵越強,酰胺A帶吸收峰將向更低波數移動[12]。在所有樣品中,經4 ℃貯藏的魚鱗制備的明膠顯示了最低波數的酰胺A帶吸收峰,表明含有更強的氫鍵。新鮮和60 ℃熱風干燥的魚鱗制備的明膠顯示了最高波數的酰胺A帶吸收峰,表明含有最弱的氫鍵。類似于SDS-PAGE結果分析,脫水可能是增強氫鍵、促進蛋白質間相互作用的重要原因。
新鮮、太陽曬干、4 ℃貯藏、-20 ℃貯藏和60 ℃熱風干燥的魚鱗制備的明膠酰胺I帶吸收峰波數分別為1 658.06、1 658.25、1 654.84、1 654.83 cm-1和1 653.54 cm-1,這與Bhat等[20]報道的商業魚明膠結果(~1 655 cm-1)類似。酰胺I帶代表C=O伸縮振動/COO締合氫鍵的情況[15],它可能是FTIR中分析蛋白質二級結構的最有力工具。新鮮、太陽曬干、4 ℃貯藏、-20 ℃貯藏和60 ℃熱風干燥的魚鱗制備的明膠酰胺II帶吸收峰波數分別為1 549.45、1 550.40、1 549.23 cm-1和1 549.98 cm-1。酰胺II帶是由N—H基團彎曲振動和C≡N基團伸縮振動引起[15]。一般認為,相比于二級結構改變,水合作用更易引起酰胺II帶變化。新鮮、太陽曬干、4 ℃貯藏、-20 ℃貯藏和60 ℃熱風干燥的魚鱗制備的明膠酰胺III帶吸收峰波數分別為1 242.76、1 240.45、1 241.12、1 240.90 cm-1和1 241.04 cm-1。酰胺III帶由多種因素產生,包括C≡N基團伸縮振動、酰胺鍵引起的N—H基團變形、甘氨酸和脯氨酸的—CH2基團的非平面搖擺振動[23]。
2.3 魚鱗明膠的微觀結構分析
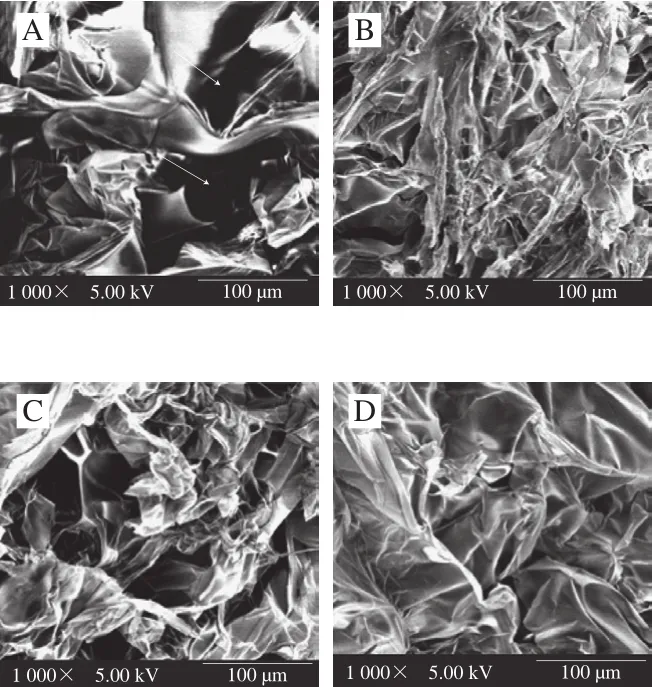

圖3 魚鱗經不同方式貯藏后制備的明膠微觀結構圖(×1 000)Fig. 3 SEM micrographs of fish gelatin extracted from bighead scales under various storage conditions (× 1 000)
由圖3可知,不同方式貯藏魚鱗會導致明膠具有不同的微觀結構。新鮮和60 ℃熱風干燥的魚鱗制備得到的明膠微觀結構呈現出較大孔洞。太陽曬干、4 ℃和-20 ℃貯藏的魚鱗制備得到的明膠具有致密的網絡結構外觀。明膠的微觀結構受其組分影響,高含量的α鏈有利于明膠凝膠的形成[15],β鏈和HMWP也能促進凝膠網絡形成,然而低分子質量的明膠碎片將起到相反的影響[24]。因此,相比于新鮮和60 ℃熱風干燥魚鱗制備的明膠,太陽曬干、4 ℃貯藏和-20 ℃貯藏魚鱗制備的明膠含有更多的α鏈、β鏈和HMWP,繼而呈現了更好的凝膠狀態,即更致密的網絡微觀結構。
2.4 魚鱗明膠的凝膠強度分析
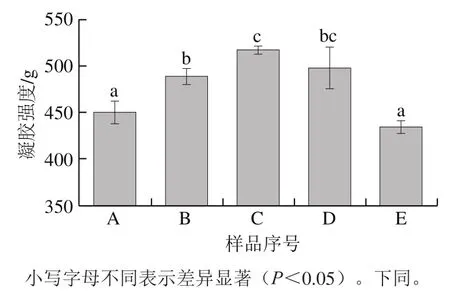
圖4 魚鱗經不同方式貯藏后制備的明膠凝膠強度Fig. 4 Gel strength of fish gelatin extracted from bighead scales under various storage conditions
凝膠強度是一項重要的凝膠性能表征指標,本實驗測定了不同方式貯藏魚鱗后制備得到的明膠凝膠強度,如圖4所示。新鮮、太陽曬干、4 ℃貯藏、-20 ℃貯藏和60 ℃熱風干燥的魚鱗制備的明膠凝膠強度分別為(450.33±12.12)、(488.86±8.40)、(516.91±4.50)、(497.65±22.44)g和(434.25 ±7.01)g。相比于新鮮和60 ℃熱風干燥方式,太陽曬干和低溫(4 ℃和-20 ℃)貯藏魚鱗使得明膠具有更強的凝膠強度(P<0.05)。值得特別指出的是,魚鱗經過4 ℃貯藏1 個月,制備得到的明膠凝膠強度比新鮮魚鱗制備的明膠凝膠強度高出66.58 g。在4 ℃的保藏溫度下,魚鱗脫水可能會促進其蛋白質間的相互作用,進而增強其凝膠強度。此外,4 ℃貯藏能較好地防止魚鱗膠原蛋白變性,提高魚鱗明膠的品質。在許多情況下,高凝膠強度的明膠是應用過程中所需要的。例如,高Bloom值的A型明膠特別適用于生產低脂黃油或人造奶油[8]。因此,將魚鱗貯藏在4 ℃,可能是一種簡單而有前景的改善明膠凝膠強度的方法。
凝膠強度與多種結構特征有關,其中,包括分子質量分布[15]、氫鍵[20]和微觀結構[25]。結合圖4的凝膠強度和圖1的SDS-PAGE結果可知,α鏈、β鏈和HMWP是增強魚鱗明膠凝膠強度的重要組分,此外,減少低分子質量的組分含量也將提升魚鱗明膠的凝膠強度。以前的許多研究報道也得到了一致的結果,例如,含有更多α鏈的明膠呈現了更好的功能特性,包括凝膠強度[15,26];Kaewruang等[27]的研究結果表明α鏈和β鏈會影響凝膠強度,增加這兩個組分的含量將增強明膠結構的穩定性;HMWP與明膠的凝膠強度有著高度的正相關性[28];降解的明膠片段與低凝膠強度相關[29]。
由圖2、4可知,4 ℃貯藏的魚鱗制備的明膠具有最強的凝膠強度和最強的氫鍵(基于FTIR中酰胺A帶的最低波數);太陽曬干和-20 ℃貯藏的魚鱗制備的明膠具有中等強度的凝膠強度和氫鍵;新鮮和60 ℃熱風干燥的魚鱗制備的明膠具有最低的凝膠強度和最弱的氫鍵(基于FTIR中酰胺A帶的最高波數)。上述結果表明,凝膠強度可能和氫鍵強度有關。不同方式貯藏魚鱗可能會導致明膠具有不同的氫鍵強度,進而影響其凝膠強度。
低凝膠強度的魚鱗明膠(新鮮和60 ℃熱風干燥魚鱗制備得到的明膠)有著松散的網絡結構,這說明魚鱗明膠的微觀結構可能在一定程度上反映其凝膠強度。伴隨著致密的網絡結構,魚鱗明膠有更好的能力以抵制外部破壞力,因此顯示出高的凝膠強度。Wangtueai等[30]通過比較狗母魚魚鱗明膠的微觀結構發現,狗母魚魚鱗明膠的微觀結構可能和凝膠強度相關。Benjakul等[31]指出凝膠物質中蛋白質分子的排列和連接直接影響黃笛鯛魚皮明膠的凝膠強度。Jongjareonrak等[32]研究表明,谷氨酰胺轉胺酶處理的明膠具有更高的凝膠強度和更致密的凝膠網絡結構。
2.5 魚鱗明膠的界面性質分析
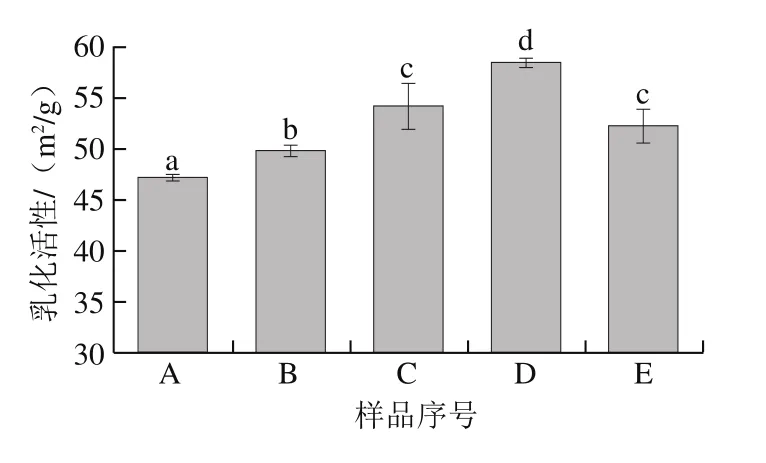
圖5 魚鱗經不同方式貯藏后制備的明膠乳化活性Fig. 5 Emulsifying activity of fish gelatin extracted from bighead scales under various storage conditions
如圖5所示,各種魚鱗貯藏方式顯著改善了明膠的乳化活性,新鮮、太陽曬干、4 ℃貯藏、-20 ℃貯藏和60 ℃熱風干燥的魚鱗制備的明膠乳化活性分別為47.26、49.87、54.26、58.56 m2/g和52.29 m2/g。在上述所有的魚鱗貯藏方式中,-20 ℃貯藏是最有效的改善明膠乳化活性的手段。
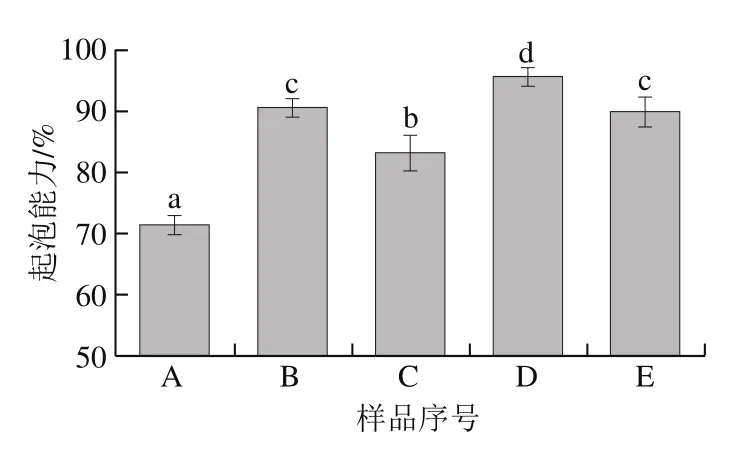
圖6 魚鱗經不同方式貯藏后制備的明膠起泡能力Fig. 6 Foaming ability of fish gelatin extracted from bighead scales under various storage conditions
圖6 為不同方式貯藏后的魚鱗制備的明膠起泡能力,太陽曬干、4 ℃貯藏、-20 ℃貯藏和60 ℃熱風干燥的魚鱗制備的明膠起泡能力分別為90.83%、83.33%、95.83%和90.00%,顯著高于新鮮魚鱗制備的明膠起泡能力(71.67%)。其中,-20 ℃貯藏魚鱗的方式提升明膠起泡能力的幅度達到33.71%。
最低的魚鱗貯藏溫度(-20 ℃)能顯著提高明膠的乳化活性和起泡能力,這也許歸因于冰凍貯藏過程中表面疏水性的改變。在長期的冰凍貯藏過程中,蛋白質會經歷構象的改變,暴露蛋白質的部分疏水性區域[33]。Wang Pei等[21]也指出冰凍能使更多的谷蛋白疏水性基團暴露。表面疏水性是改變蛋白質乳化特性和起泡特性的重要因素。表面疏水性影響蛋白質吸附到油-水界面層的能力,此時,更強的吸附特性將顯示更高的乳化能力[34]。疏水性對蛋白質起泡性發揮作用的原因可能部分源于其快速吸附到空氣-水界面,也可能與疏水性蛋白質間的相互作用有關[35-36]。Moro等[37]的研究結果亦表明,增加表面疏水性可能是改善起泡能力的決定性因素。
3 結 論
太陽曬干后室溫貯藏、4 ℃貯藏、-20 ℃貯藏和60 ℃熱風干燥后室溫貯藏均不會破壞明膠的特征性結構(所有的魚鱗明膠樣品都含有α鏈、β鏈和HMWP,且具有4 個類似的酰胺帶吸收峰:酰胺A帶、酰胺I帶、酰胺II帶和酰胺III帶)。相比新鮮魚鱗和60 ℃熱風干燥魚鱗制備得到的明膠,太陽曬干和低溫方式(4 ℃和-20 ℃)貯藏的魚鱗制備得到的明膠結構特征如下:含有更多的α鏈、β鏈和HMWP;酰胺A帶吸收峰的波數較低,表明包含更強的氫鍵;呈現更致密的網絡結構外觀。這些結構特征的變化可能是導致太陽曬干和低溫(4 ℃和-20 ℃)貯藏魚鱗制備得到的明膠呈現更強凝膠強度的主要原因。太陽曬干、4 ℃貯藏、-20 ℃貯藏和60 ℃熱風干燥魚鱗均能提升明膠的乳化活性和起泡能力,其中,-20 ℃貯藏魚鱗1 個月對改善明膠乳化活性和起泡能力的效果最佳。

