TRIM1、occludin、ZO-1 在結腸癌組織中的表達及臨床意義
紀偉平 盧明東 黃穎鵬 王娟 楊向群
結腸癌是消化系統常見的惡性腫瘤[1]。細胞極性紊亂或喪失是結腸癌發生、發展過程中的重要病理改變[2]。在細胞極性喪失的腫瘤細胞惡變過程中,往往伴有細胞極性蛋白如occludin、ZO-1等表達下調[3]。三結構域蛋白(TRIM)含有3個特征性結構域,即1個鋅指結構域、1或2個鋅離子結構域和1個卷曲螺旋結構域,一般發揮E3泛素連接酶功能[4-6],在天然免疫應答、細胞分化、轉錄調節、細胞骨架重塑、發育、細胞周期和凋亡、DNA損傷修復等生理過程中起著重要作用[7]。TRIM異常通過調節基因表達、細胞增殖、DNA損傷修復和凋亡等信號通路在癌癥中發揮作用[8],還通過調控NF-κB信號通路在炎癥向癌癥發展過程中發揮作用[9-10]。TRIM1是TRIM家族的重要一員,目前尚無關于TRIM1在結腸癌中表達及與occludin、ZO-1表達關系的相關報道。因此,本研究檢測TRIM1、occludin、ZO-1在結腸癌組織中的表達,同時分析3者間的相關性以及與結腸癌患者臨床特征和預后的關系,現將結果報道如下。
1 對象和方法
1.1 對象 選取2011年1月至2013年1月溫州醫科大學附屬第二醫院收治的120例結腸癌患者手術切除的癌組織及其癌旁正常組織標本為研究對象。其中男65例,女 55 例;年齡 14~80[61(54,67)]歲;參照 WHO 組織學分類標準,確定病理類型均為腺癌非特殊型;分化程度:高分化16例,中分化71例,低分化33例;參照國際抗癌聯盟(UICC)提出的臨床分期標準:Ⅰ期30例,Ⅱ期32例,Ⅲ期58例;腫瘤浸潤深度:T1期24例,T2期37例,T3期50例,T4期9例;淋巴結轉移93例,無淋巴結轉移27例;均無遠處轉移;術前均未接受過新輔助化療。本研究經醫學倫理委員會審查通過,所有患者簽署知情同意書。
1.2 方法
1.2.1 免疫組化染色 遵循無菌原則取材,所取組織用10%甲醛固定,常規石蠟包埋,4μm厚連續切片,免疫組化染色采用S-P法檢測。標本切片依次經過脫蠟、水化、抗原修復(采用酸修復)、3%過氧化氫去除內源性過氧化物酶等處理;采用免疫組化S-P法通用型染色試劑盒進行染色;陽性部位呈棕褐色。所加一抗(兔抗人TRIM1和鼠抗人occludin、鼠抗人ZO-1單克隆抗體)均購自R&D公司,DAB顯色劑購自武漢博士德公司。
1.2.2 染色結果的判斷 由2位病理科醫師在顯微鏡下觀察,根據陽性染色范圍及程度進行評分。采取陽性染色面積與染色強度的評分相乘方式,每個切片重復觀察5個高倍視野。陽性染色面積賦值:<1%為0分,1%~30%為1分,>30%~50%為2分,>50%為3分;染色強度賦值:弱陽性為1分,陽性為2分,強陽性為3分。將5個高倍視野的染色面積評分均值與染色強度評分均值相乘,即表達評分。表達評分>4分為高表達,≤4分為低表達。
1.3 評估指標 比較結腸癌組織及癌旁正常組織中TRIM1、occludin、ZO-1表達水平,并分析結腸癌組織中TRIM1表達與occludin、ZO-1表達的相關性。收集結腸癌患者性別、年齡、腫瘤部位、臨床分期、分化程度、T分期、淋巴結轉移與TRIM1、occludin、ZO-1表達的關系;同時分析TRIM1、occludin、ZO-1表達與結腸癌患者預后的關系。
1.4 統計學處理 應用SPSS 17.0統計軟件。計量資料用表示,組間比較采用配對樣本t檢驗;計數資料用率表示,組間比較采用χ2檢驗。結腸癌組織中TRIM1、occludin、ZO-1表達的相關性分析采用Spearman秩相關。采用Kaplan-Meier法繪制結腸癌組織中TRIM1、occludin、ZO-1表達高、低者的生存曲線,并進行logrank檢驗。采用Cox比例風險回歸模型分析結直腸癌患者術后5年總生存的影響因素。P<0.05為差異有統計學意義。
2 結果
2.1 結腸癌組織及其癌旁正常組織中TRIM1、occludin、ZO-1表達評分比較 結腸癌組織中TRIM1表達評分為(4.37±1.83)分,明顯高于癌旁正常組織的(3.72±1.98)分,差異有統計學意義(t=2.64,P<0.05);結腸癌組織中occludin表達評分為(3.09±1.71)分,明顯低于癌旁正常組織的(3.53±1.65)分,差異有統計學意義(t=2.03,P<0.05);結腸癌組織中ZO-1表達評分為(3.22±2.07)分,明顯低于癌旁正常組織的(3.75±1.23)分,差異有統計學意義(t=2.41,P<0.05),見圖 1。
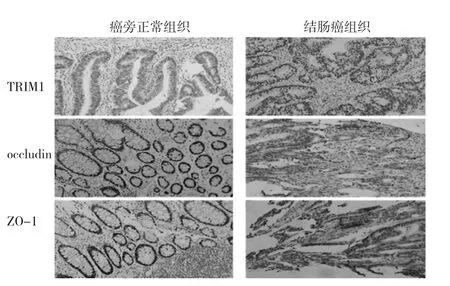
圖1 TRIM1、occludin、ZO-1在結腸癌組織及其癌旁正常組織中的表達(免疫組化染色,×200)
2.2 結腸癌組織中TRIM1、occludin、ZO-1表達的相關性 結腸癌組織中TRIM1表達與occludin、ZO-1表達均呈負相關(rs=-0.420、-0.343,均 P<0.05),見表 1。
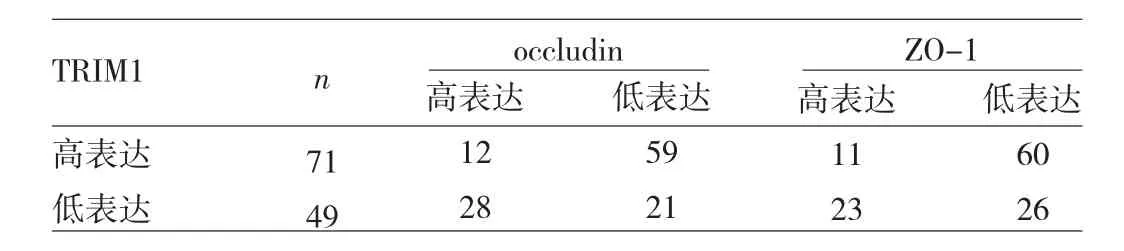
表1 結腸癌組織中TRIM1、occludin、ZO-1高低表達的交叉表(例)
2.3 結腸癌組織中TRIM1、occludin、ZO-1表達與臨床特征的關系 結腸癌組織中TRIM1、occludin、ZO-1表達與腫瘤臨床分期、分化程度、T分期、是否淋巴結轉移等有關(均P<0.05),與患者性別、年齡、腫瘤部位等均無關(均P >0.05),見表2。
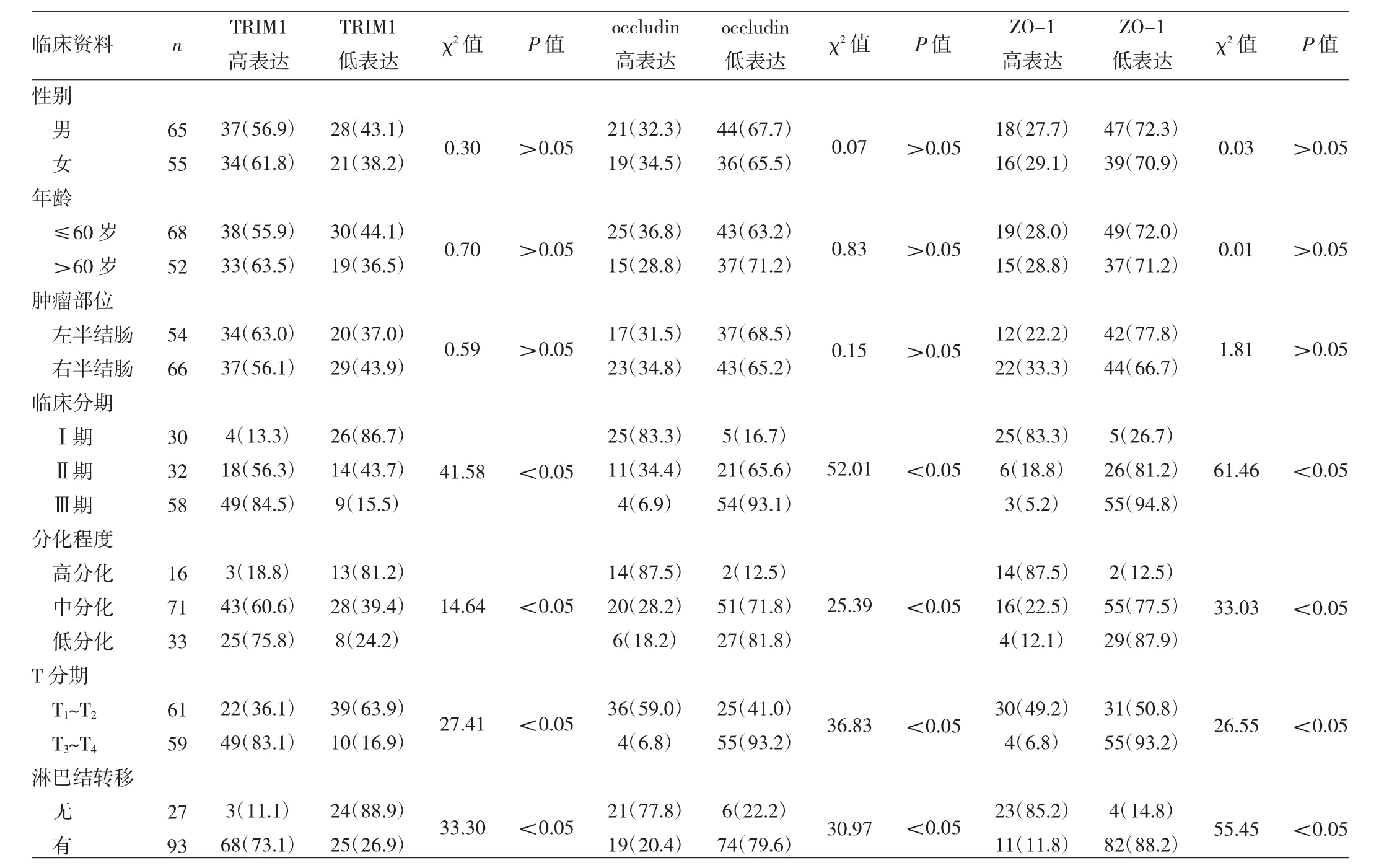
表2 結腸癌組織中TRIM1、occludin、ZO-1表達與臨床特征的關系[例(%)]
2.4 結腸癌組織中TRIM1、occludin、ZO-1表達與患者預后的關系 120例結腸癌患者均獲得術后5年完整的隨訪信息。經生存分析,TRIM1高、低表達者平均生存時間分別為(45.06±50.55)、(56.24±59.47)個月;TRIM1 高表達者5年累積生存率為35.2%,明顯低于TRIM1低表達者的 85.7%(χ2=29.31,P<0.05),見圖 2a(插頁)。occludin高、低表達者平均生存時間分別為(54.54±59.16)、(46.90±51.98)個月;occludin 高表達者 5 年累積生存率為 82.5%,明顯高于occludin低表達者的42.5%(χ2=15.66,P<0.05),見圖2b(插頁)。ZO-1高、低表達者平均生存時間分別為(54.13±59.69)、(47.55±52.32)個月;ZO-1高表達者5年累積生存率為82.4%,明顯高于ZO-1低表達者的45.3%(χ2=12.38,P<0.05),見圖 2c(插頁)。經Cox比例風險回歸模型分析,TRIM1高表達是影響結腸癌患者術后5年總生存的獨立危險因素(HR=2.374,95%CI:1.04~5.44,P<0.05)。
3 討論
隨著對腫瘤認識的不斷加深,學者對腫瘤相關因子的研究逐漸從單一分子向家族分子或序貫式關聯分子群轉變。在腫瘤發生、發展過程中,并非由單一分子發揮作用,大部分是由眾多分子相互作用進而傳遞分子信號,從而產生相應的細胞或生物行為。本研究結果發現結腸癌組織中TRIM1表達明顯升高,occludin、ZO-1表達明顯降低;TRIM1表達與occludin、ZO-1表達呈負相關。此外,本研究發現TRIM1、occludin、ZO-1蛋白表達與腫瘤臨床分期、分化程度、T分期、是否淋巴結轉移等有關;TRIM1高表達是影響結腸癌患者術后5年總生存的獨立危險因素。
細胞極性是正常細胞功能建立與維持的關鍵,它是細胞形態、細胞中某些胞質成分、細胞表面信號分子、細胞器及細胞骨架等生理組織結構按一定空間順序不均等分布以及細胞行使功能的不對稱性[11-16]。緊密連接作為一個封閉的屏障,具有保持細胞極性及穩態、調節上皮細胞通透性的作用,是上皮細胞極性建立與維持的重要細胞結構[17]。一般認為,上皮細胞緊密連接的形成意味著細胞極性的建立[18-19]。此外,緊密連接不僅調控上皮細胞層內外營養物質、小分子和離子的平衡,還調控細胞周期、細胞增殖及分化,抑制腫瘤細胞向惡性轉化,它是細胞內外眾多極性調控信號進行整合的重要平臺。上皮細胞極性的喪失是上皮細胞起源癌癥的一個重要特征[2]。細胞極性蛋白調控網絡的異常及蛋白功能的紊亂,或者由此形成的細胞極性微環境改變等,在癌癥發生、發展過程中發揮著重要作用。occludin、ZO-1是極性建立過程中發揮主要作用的極性蛋白,在多種惡性腫瘤組織中呈低表達,并與其惡性進展密切相關[3]。
TRIM1是TRIM家族的重要分子蛋白,在天然免疫應答、細胞分化、轉錄調節、細胞骨架重塑、發育、細胞周期和凋亡、DNA損傷修復等過程中發揮著重要作用。目前關于該家族分子在惡性腫瘤尤其是結腸癌中的生物學作用缺乏系統的研究。本文就TRIM1、occludin、ZO-1在結腸癌組織中的表達及臨床意義進行探討,結果發現結腸癌組織中TRIM1表達升高,occludin、ZO-1表達降低;TRIM1表達與occludin、ZO-1表達呈負相關。TRIM1、occludin、ZO-1表達與結腸癌患者臨床分期、分化程度、T分期、是否淋巴結轉移等有關,TRIM1高表達是影響結腸癌患者術后5年總生存的獨立危險因素。關于TRIM1在結腸癌發生、發展過程中發揮的調控作用及其分子機制有待進一步研究。

