維甲酸誘導基因I在DSS誘導的慢性腸炎小鼠結腸組織中的表達
吳玉丹,戴發亮,董仕楨,郭騰飛,高 磊,常永超,高 強
1)河南科技大學第一附屬醫院消化內科;河南科技大學臨床醫學院 河南洛陽 471023 2)河南科技大學第一附屬醫院檢驗科;河南科技大學臨床醫學院 河南洛陽 471023 3)首都醫科大學附屬北京康復醫院消化內科 北京 100144
炎癥性腸病(inflammatory bowel disease,IBD)包括克羅恩病(Crohn′s Disease,CD)和潰瘍性結腸炎(ulcerative colitis,UC),是一種腸道慢性非特異性炎癥性疾病,其病因和發病機制尚未完全明確,目前認為與遺傳易感性、環境、感染、菌群失調、腸黏膜免疫應答失衡及腸上皮功能障礙等因素有關[1]。近年來我國IBD臨床診治數量明顯增多[2]。內質網是與蛋白質折疊修飾、轉運和分泌功能有關的一種重要細胞器;未折疊或錯誤折疊蛋白在內質網大量蓄積可以導致內質網應激(endoplasmic reticulum stress,ERS)。腸上皮細胞ERS導致的腸黏膜屏障損傷是IBD的重要原因[3]。機體可通過啟動一系列適應性反應即“未折疊蛋白反應”(unfolded protein response,UPR)[4]來減輕ERS對細胞的損害,維持內環境穩態。ERS主要通過3種內質網跨膜感受器觸發UPR,肌醇需求酶1(inositol-requiring enzyme 1,IRE1) 是UPR的一個重要傳感器,消化道表面表達有IRE1亞型(IRE1α和IRE1β),磷酸化IRE1α(p-IRE1α)是其活化形式。在長期ERS狀態下,IRE1α可以促進基因編碼的內質網靶向蛋白質的降解,降低ERS的蛋白負荷,這個過程被稱為依賴IRE1調節的衰減作用(regulated IRE1-dependent decay,RIDD)[5-6]。維甲酸誘導基因I (retinoic acid induced gene-I,RIG-I)參與IRE1-RIDD-RIG-I通路,這個通路與黏膜固有免疫和炎癥反應有關[7-9]。RIG-I是DexD/H盒的RNA解旋酶家族的成員,在細胞內作為受體識別病毒雙鏈RNA。最近研究[10]表明,RIG-I不僅具有抗病毒功能,還參與炎癥反應、腫瘤細胞增殖或凋亡、吞噬、免疫調節等諸多生物學事件。有關IRE1-RIDD-RIG-I通路在IBD的發病機制尚不明確。該研究通過分析IRE1和RIG-I在葡聚糖硫酸鈉(dextran sulphate sodium,DSS)誘導的小鼠慢性結腸炎模型的表達情況來探討IRE1-RIDD-RIG-I通路在IBD發病過程中的作用。
1 材料與方法
1.1實驗動物8~10周齡健康清潔級C57BL/6(B6)雌性小鼠購自北京維通利華公司,體重為20~23 g,用混合配方顆粒飼料(北京華阜康生物科技股份有限公司)飼養于河南科技大學第一附屬醫院新區醫院動物實驗中心,正常飲用無菌蒸餾水。
1.2主要試劑與儀器DSS(美國MP Biomedicals公司);戊巴比妥鈉(德國Merck公司);Trizol法總RNA提取試劑盒(美國Invitrogen公司);RT-PCR試劑盒(日本TaKaRa公司);免疫組化檢測和蛋白印跡Western blot檢測用RIG-I一抗(英國Abcam公司),p-IRE1一抗(美國Thermo公司);免疫組化檢測SABC試劑盒(武漢博士德生物工程有限公司);DAB顯色試劑盒(北京索萊寶科技有限公司);RIPA裂解液試劑盒(北京普利萊基因技術有限公司);BCA試劑盒(美國Pierce公司);ECL試劑盒(美國Santa Cruz公司);RT-PCR儀(美國Bio-Rad公司);光學拍照顯微鏡系統(日本Olympus公司)。
1.3實驗動物的分組、造模及取材處理造模前,小鼠適應性喂養1周,采用隨機數字表法將小鼠分為2組,每組8只。對照組:飲用無菌蒸餾水;慢性炎癥組:先自由飲用10 g/L DSS溶液(現配現用)7 d,然后飲用無菌蒸餾水14 d,3周為一個周期(共3個周期)建立小鼠慢性結腸炎模型。于造模第10周末腹腔注射戊巴比妥鈉麻醉后頸椎脫臼法處死小鼠,剖腹取全結腸,測量長度。記錄結腸內是否有血性內容物,PBS漂洗并翻轉結腸,從遠端起取第一段約0.5 cm放于包埋框,浸泡于體積分數10%甲醛中固定,石蠟包埋, 4 μm厚切片以備HE和免疫組化染色用;取第二段約1.0 cm結腸置于含RNA later液的離心管,先在4 ℃冰箱放置24 h后,轉入-80 ℃冰箱,用于相關mRNA的檢測;再取第三段約1.0 cm放入1.5 mL離心管,液氮凍存后轉入-80 ℃冰箱,用于Western blot。
1.4兩組小鼠結腸組織學表現、疾病活動指數(DAI)評分、結腸長度變化及腸道炎癥程度評分實驗期間每3 d于早晨9:00測量各組小鼠體重1次,觀察小鼠活動、攝食和飲水情況,記錄大便性狀、是否便血及便血程度。HE染色觀察結腸組織學變化:在高倍鏡(×400)下,每張切片選擇10個視野共計數1 000個細胞。參照Jackson等[11]的方法進行DAI評分,DAI取體重下降百分比、大便性狀、便血評分三者均值(取材時測量結腸長度,依據張靜等[12]的方法進行便血評分)。腸道炎癥程度評分參照Esworthy等[13]的方法。
1.5兩組小鼠結腸組織中IL-6、IL-8、TNF-α、IRE1α及RIG-ImRNA表達水平的檢測采用Trizol法提取小鼠結腸組織總RNA,測定RNA純度和濃度后取RNA 2 μg,逆轉錄合成cDNA,置于-20 ℃冰箱保存。冰上配制PCR反應體系(共25 μL):SYBR Premix EX TaqⅡ(×2)12.5 μL,上下游引物各1 μL(濃度10 μmol/L),RNase-Free水8.5 μL,cDNA 2 μL。每個樣本設3個復孔。PCR反應條件:95 ℃預變性30 s;95 ℃變性 5 s;根據引物Tm值設置退火溫度,退火時長30 s,72 ℃延伸30 s,共40個循環。以β-actin作為內參基因,采用2-ΔΔCt法計算各指標mRNA相對表達量。引物由上海生工生物工程公司設計并合成(表1)。

表1 引物名稱及序列
1.6兩組小鼠結腸組織中p-IRE1α、RIG-I蛋白表達的免疫組化檢測按照免疫組化檢測試劑盒說明書進行操作。p-IRE1α一抗按1∶500稀釋,RIG-I一抗按1∶600稀釋,生物素化山羊抗兔IgG作為二抗。用PBS緩沖液代替一抗和二抗作陰性對照。DAB顯色,蘇木精復染;干燥封片后在高倍鏡(×400)下,參考文獻[14-15]報道的方法觀察p-IRE1α、RIG-I蛋白的表達情況。
1.7兩組小鼠結腸組織中p-IRE1α、RIG-I蛋白表達的定量分析取40~60 mg小鼠結腸組織置于勻漿器中,加入1 mL RIPA裂解液,充分勻漿后離心取
上清。BCA法測定蛋白濃度。將蛋白稀釋成適當濃度,100 ℃變性5 min,加20 μg樣品進行SDS-PAGE,之后將蛋白轉移到PVDF膜上,50 g/L脫脂奶粉溶液封閉,分別滴加p-IRE1α和RIG-I抗體一抗(按1∶500稀釋)、二抗(按1∶2 000稀釋),ECL顯色1或3 min,成像系統成像后用Image J軟件進行灰度值分析。
1.8統計學處理采用SPSS 20.0進行分析,應用兩獨立樣本的t檢驗比較兩組小鼠DAI、結腸長度、腸道炎癥程度評分以及結腸組織中炎性因子、IRE1α、RIG-I mRNA及蛋白表達的差異。檢驗水準α=0.05。
2 結果
2.1兩組小鼠一般活動情況觀察對照組小鼠每天飲水攝食正常,反應機警,大小便正常,體重增加。慢性炎癥組造模開始后小鼠即出現精神萎靡,體重減輕;第7天小鼠均出現稀血便。在第一個周期結束時,慢性炎性組平均體重下降最多;造模結束時,兩組小鼠均無死亡;部分小鼠大便潛血實驗陽性,無明顯肉眼血便。
2.2兩組小鼠結腸組織學表現情況、DAI評分、結腸長度變化及腸道炎癥程度評分比較見圖1、表2。對照組小鼠組織病理學顯示結腸黏膜腺體結構完整,未見炎癥細胞浸潤;慢性炎癥組結腸黏膜結構不規則,腺體萎縮,細胞結構紊亂,隱窩異常,杯狀細胞消失,局部炎癥細胞浸潤,并可見隱窩呈慢性炎癥改變伴不規則增生。造模結束后,慢性炎癥組DAI評分、腸道炎癥程度評分均高于對照組,結腸長度短于對照組。

A:對照組;B:慢性炎癥組圖1 兩組小鼠結腸組織學表現(HE,×200)表2 兩組小鼠DAI評分、結腸長度及腸道炎癥程度評分比較(n=8)
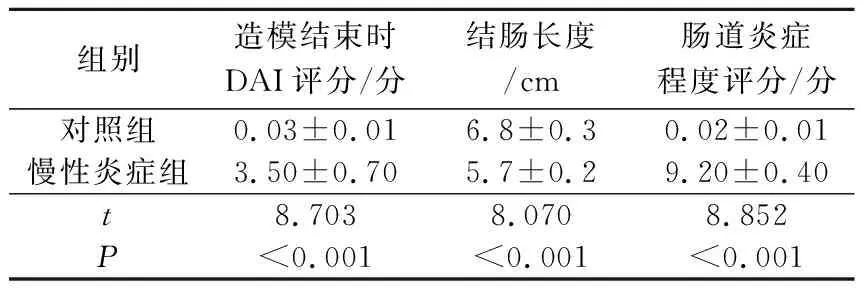
組別造模結束時DAI評分/分結腸長度/cm腸道炎癥程度評分/分對照組0.03±0.016.8±0.30.02±0.01慢性炎癥組3.50±0.705.7±0.29.20±0.40t8.7038.0708.852P<0.001<0.001<0.001
2.3兩組小鼠結腸組織中炎性因子、IRE1α、RIG-ImRNA及蛋白的表達比較見表3、圖2和3。由圖3可知,p-IRE1α主要在結腸上皮細胞刷狀緣、漿細胞等細胞胞質中表達;RIG-I蛋白主要表達于結腸上皮細胞的胞質、間質細胞的胞質中。

表3 兩組小鼠結腸組織中炎性因子、IRE1α、RIG-I mRNA及蛋白的表達比較(n=8)
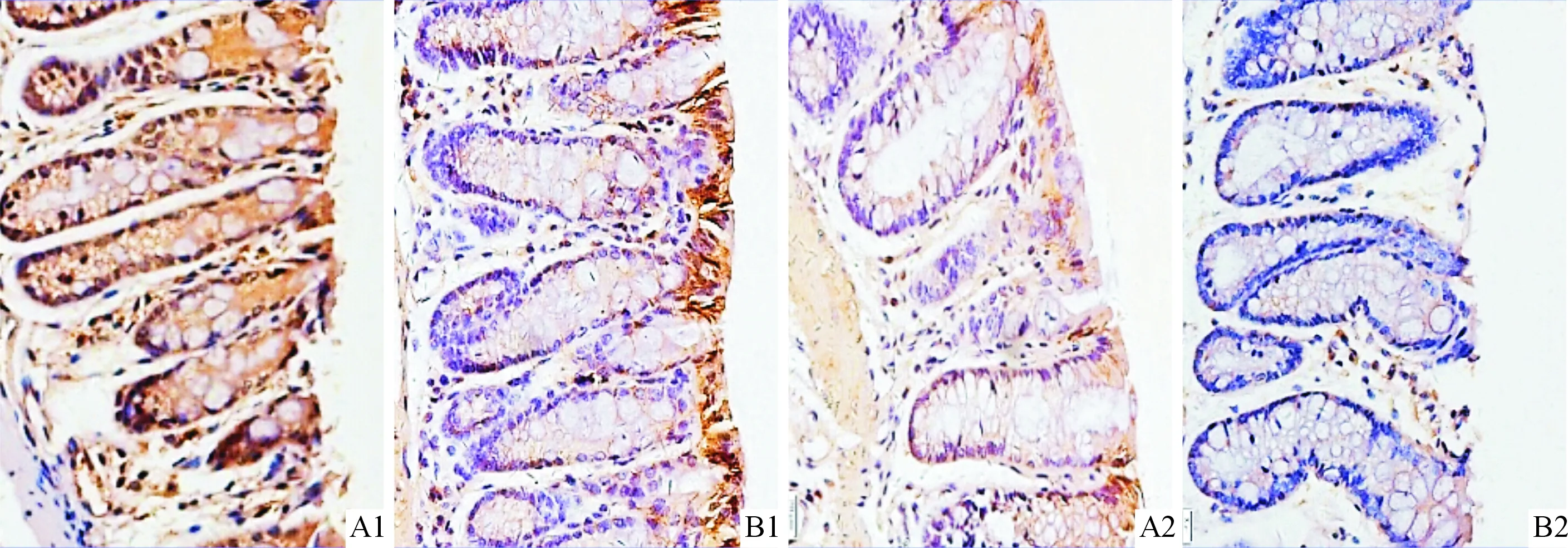
A:RIG-I蛋白; B:IRE1α蛋白;1:對照組;2:慢性炎癥組圖2 兩組小鼠結腸上皮組織中RIG-I和IRE1α蛋白免疫組化結果(DAB,×400)
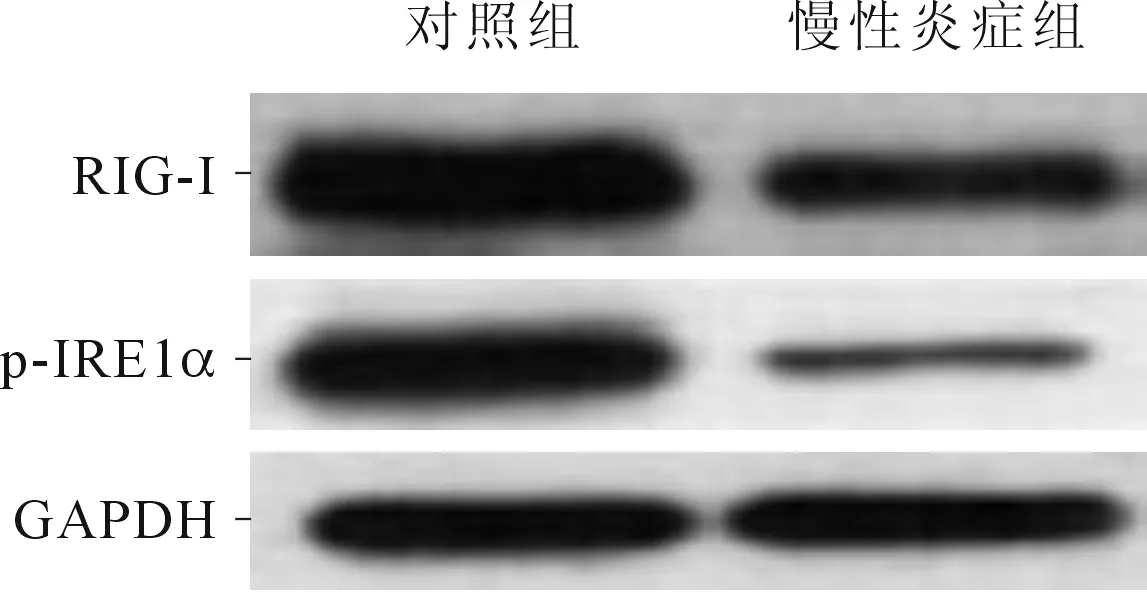
圖3 兩組小鼠結腸上皮組織中RIG-I和p-IRE1α蛋白的Western blot結果
3 討論
本實驗用DSS誘導B6小鼠,經過3個周期共10周的造模誘導小鼠慢性結腸炎來模擬人UC的發生發展過程。造模過程中,腸炎小鼠與人類UC有相似癥狀,如體重減輕、腹瀉、血便等;慢性炎癥組小鼠結腸縮短,且縮短程度與炎癥程度一致,病理表現為黏膜結構不規則,隱窩結構紊亂,腺體變形萎縮,黏膜及黏膜下層大量炎癥細胞浸潤等,同時伴有DAI增高;TNF-α、IL-8、IL-6 mRNA升高。
實驗結果顯示慢性炎癥組IRE1α mRNA、RIG-I mRNA、p-IRE1α和RIG-I蛋白的表達量低于對照組,表明IRE1-RIDD-RIG-I通路在炎癥時被抑制。IRE1-RIDD-RIG-I通路在黏膜表面的固有免疫應答將針對某些微生物的先天性免疫應答信號與內質網相關聯,影響內質網功能[9]。IRE1不僅可以作為防御受體也可作為模式識別受體,感知外源入侵的病原微生物和內源性的未折疊或錯誤折疊的蛋白質,并根據不同的應激狀態調節內質網功能。在應激狀態下,活化的p-IRE1 激活細胞內激酶和核酸內切酶結構域移碼剪切XBP1的mRNA(XBP1u)成為具有活性的XBP1s而進入細胞核調節基因轉錄,同時把其他mRNA剪切為未標記的片段呈遞給配體感受器RIG-I,激活的RIG-I通過下游接頭蛋白MAVS(也稱IPS-1、CARDIF或VISA)誘導Ⅰ型干擾素IFN的產生、NF-κB調控免疫反應和炎癥反應[8]。長期ERS狀態下,RIDD過程可以通過降解內質網結構蛋白和下調Caspase 2觸發細胞凋亡。活化的多聚化IRE1還可以通過TRAF2激活ASK1-JNK/IKK通路調節炎癥反應。據Coelho等[5]報道,IRE1除了XBP1還有更廣泛的mRNA作用底物范圍,隨后這也在裂殖酵母和哺乳動物細胞中得到證實。Maurel等[16]提出XBP1剪切與RIDD是 IRE1核糖核酸酶活化調控的兩種不同細胞反應,兩者在內質網應激時會導致細胞不同的命運。
本實驗結果顯示p-IRE1α、RIG-I的表達下降導致內質網調節未折疊或錯誤折疊的蛋白質能力減弱,可能參與了IBD的發生和發展。新近的研究[10]顯示RIG-I在人和小鼠結腸炎相關性結腸癌組織中表達也下調,且RIG-I缺乏的小鼠與野生型小鼠相比腸道菌群紊亂,IgA、 Reg3γ和 Pdcd1表達水平降低,因此,IRE1-RIDD-RIG-I通路的激活可能影響腸道菌群,并且導致潘氏(Paneth)細胞和杯狀細胞分泌功能(如分泌抗菌肽和黏蛋白等)異常,使正常腸道抗菌作用和黏蛋白屏障受損進而引起持續的炎癥刺激,影響IBD的發生和發展。此外,IRE1-RIDD-RIG-I通路的下調可能使內質網的自噬功能減弱,從而降低內質網降解異常蛋白質的能力,這也與以往報道[17-18]的未折疊蛋白反應與自噬和固有免疫密切相關,自噬功能受損會促進IBD的發生和發展一致。
綜上所述,本實驗證實在腸道慢性炎癥的發生和發展過程中IRE1-RIDD-RIG-I通路被抑制,這種抑制可能促進了炎癥的發生和發展,其具體調控機制還有待進一步研究,以期為IBD的治療提供新靶點。
致謝:感謝軒青霞、馮丹丹、陳攀、邢瑩瑩和張臘梅在實驗中給予的大力幫助。