三種檢測豬瘟疫苗中牛血清蛋白含量的ELISA試劑盒的性能對比
曹玉美,方茜,陸江,孫如水,孫龍
(廣西農墾永新畜牧集團有限公司良圻原種豬場,廣西 橫縣 530317)
當前疫苗生產中普遍采用牛血清作為細胞培養的主要成分,這導致疫苗中不同程度地殘留有牛血清蛋白,牛血清殘余蛋白對于機體來說是一種異源蛋白,如果殘留種類多,注射疫苗后就可能引起過敏性休克等不良反應[1]。目前已見報道的過敏成分主要是牛血清白蛋白(BSA)和牛血清IgG(B-IgG)。為了有效控制過敏原含量,《中國生物制品規程(2000年版)》明確規定疫苗中牛血清蛋白的殘余量不得超過50ng/mL[2]。由于疫苗質量的安全性越來越受到關注,因此,建立檢測疫苗中牛血清蛋白殘留量的方法和研制相關試劑盒具有十分重要的意義。早在2004年國內已經研制出能定量檢測牛血清蛋白含量的酶聯免疫試劑盒,市面上也出現了許多廠家研制的檢測牛血清蛋白含量的ELISA試劑盒,而眾多試劑盒的檢測效果存在差異,選擇一款穩定性好、靈敏度高的試劑盒成為有效控制牛血清蛋白含量的關鍵。本試驗從市面上選購了3種用于檢測豬瘟疫苗中牛血清蛋白含量的ELISA試劑盒(分別為A、B、C),由本實驗室人員對這3種試劑盒進行各項質量參數驗證,并分別用其對18個豬瘟疫苗樣品進行牛血清蛋白含量檢測,以此評價這3種試劑盒用于常規疫苗質量控制的可行性。
1 材料
1.1 檢測儀器及試劑 酶標儀;ELISA試劑盒A(生產批號:201708),其檢測范圍為 1~45ng/mL;ELISA試劑盒B(生產批號:2017082809),其檢測范圍為1~45 ng/mL;ELISA 試劑盒 C(生產批號:201708),其檢測范圍為0.5~80ng/mL。所有試劑盒均在保質期內使用。
1.2 待檢樣品 選擇18個豬瘟疫苗作為待檢樣品。
2 方法
2.1 標準曲線繪制 準確按照試劑盒的操作說明進行標準曲線繪制,通過對比3種試劑盒標準曲線線性方程的相關性及變異系數來驗證試劑盒的穩定性。具體操作步驟如下:
2.1.1 標準品稀釋 準備5支稀釋標準品的EP管,每支EP管加入150μL標準品稀釋液,將試劑盒中的標準品原液進行倍比稀釋,得到5個不同濃度的標準品,試劑盒A的標準曲線濃度分別為2.5、5、10、20、40ng/mL,試劑盒B的標準曲線濃度分別為2.5、5、10、20、40ng/mL,試劑盒 C 的標準曲線濃度分別為5、10、20、40、80ng/mL。
2.1.2 加樣 將稀釋好的標準品加入酶標板孔底部,盡量不觸及孔壁,輕輕晃動均勻,并設置空白孔(不加樣品及酶標試劑,其余各步驟操作相同)。
2.1.3 溫育 用封口膜封板后置37℃恒溫箱中溫育30min。
2.1.4 配液 將濃縮洗滌液用蒸餾水稀釋30倍后使用。
2.1.5 洗滌 小心揭掉封板膜,棄去液體,甩干,每孔加滿洗滌液,靜置30s后棄去。如此重復5次,拍干。
2.1.6 加酶 每孔加入酶標試劑50 μL,空白孔除外。
2.1.7 溫育、洗滌 操作同上。
2.1.8 顯色 每孔加入顯色劑A 50μL,再加入顯色劑B 50μL,輕輕振蕩混勻,37℃避光顯色10min。
2.1.9 終止 每孔加入終止液50μL,終止反應。
2.1.10 測定 以空白孔調零,450nm波長讀取各孔吸光度值。
2.2 豬瘟疫苗樣品檢測 準確按照試劑盒的操作說明對本場的18個豬瘟疫苗樣品進行牛血清蛋白含量測定,每個樣品做兩個重復,取平均值。具體操作同2.1步驟,只是在加樣時先加入40 μL樣品稀釋液,再加入10 μL待測樣品,最終將樣品稀釋5倍,其余步驟均相同。通過標準曲線回歸線性方程和樣品吸光度,測得樣品中牛血清蛋白的含量,并對其變異系數進行對比,比較檢測結果的差異及符合程度。
3 結果
3.1 標準曲線 3種試劑盒的標準曲線及其相關系數詳見表1。試劑盒A的標準曲線為y=0.079 1x+0.4997,相關系數為0.9692;試劑盒B的標準曲線為y=0.0350x-0.0089,相關系數為0.9948;試劑盒C的標準曲線為y=0.0045x+0.0787,相關系數為0.9884。可見試劑盒B的標準曲線的相關性較高。

表1 3種試劑盒的標準曲線及其相關系數
3種試劑盒標準品吸光度值的變異系數詳見圖1。由圖可知,試劑盒A的變異系數在0.005~0.115之間,試劑盒B的變異系數在0.005~0.439之間,試劑盒C的變異系數在0.104~0.260之間。可見試劑盒A標準曲線的變異系數最小。
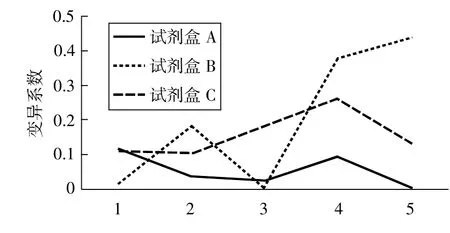
圖1 3種試劑盒標準品吸光度值的變異系數
3.2 豬瘟疫苗樣品中牛血清蛋白含量的測定 3種試劑盒對18個豬瘟疫苗樣品檢測所得到的結果詳見表2。使用試劑盒A檢測時,樣品濃度均為負值,說明樣品中未檢出牛血清蛋白。使用試劑盒B對相同樣品進行檢測時,結果發現樣品中牛血清蛋白的含量在36.99~57.27ng/mL之間,而試劑盒B的檢測范圍為1~45ng/mL,其中有10個樣品濃度超出了檢測范圍,并且有7個樣品的牛血清蛋白含量超標(>50ng/mL)。由于含量超過試劑盒檢測范圍,試劑盒B的檢測結果有待考證,需要對樣品稀釋后進行再次檢查。使用試劑盒C檢測樣品時,發現樣品中牛血清蛋白的含量在28.07~39.96ng/mL之間,其含量均在試劑盒檢測范圍內,且低于生物制品規程中的相關規定。
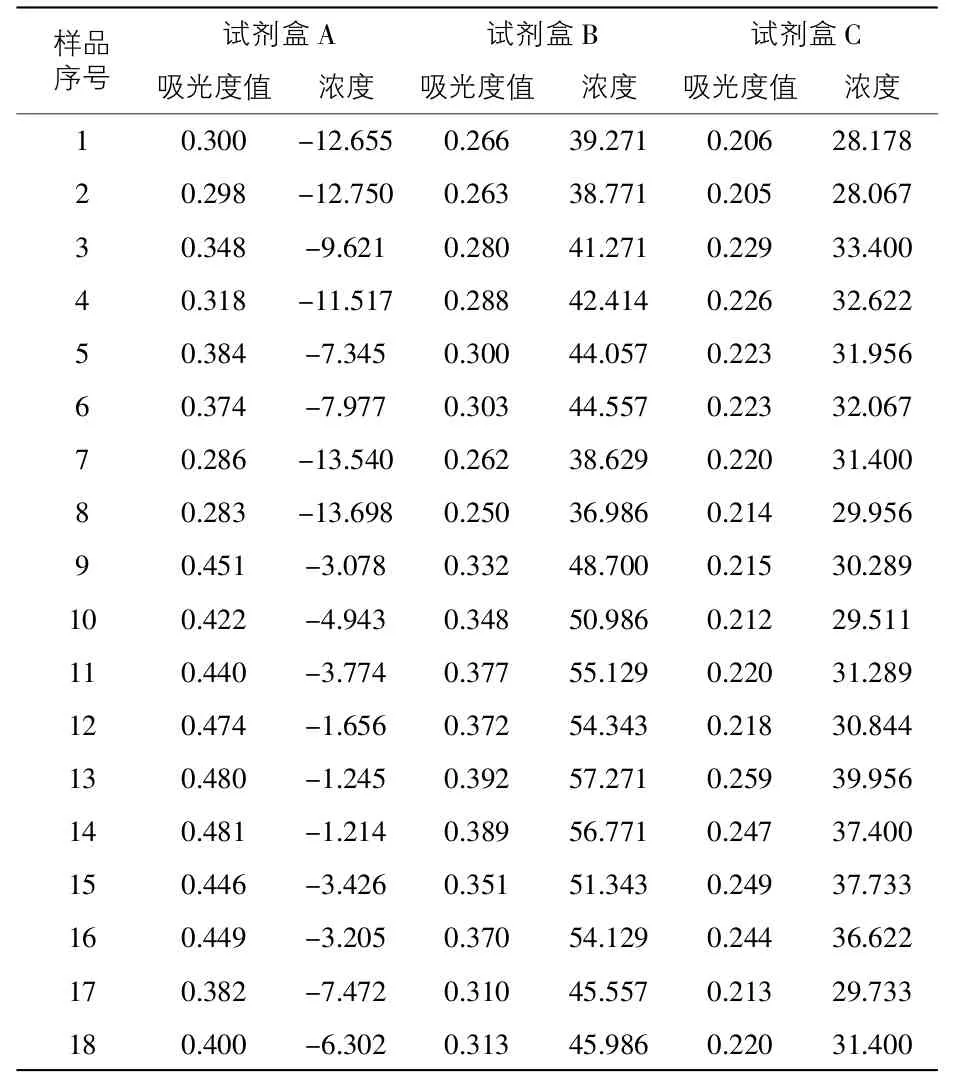
表2 3種試劑盒檢測疫苗樣品中的牛血清蛋白含量 ng/mL
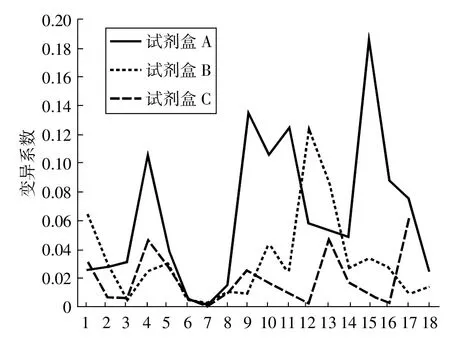
圖2 3種試劑盒檢測樣品時的變異系數
3種試劑盒在檢測18個豬瘟疫苗樣品時吸光度值的變異系數詳見圖2。由圖可知,試劑盒A的變異系數在0.002~0.186之間,試劑盒B的變異系數在0.003~0.124之間,試劑盒 C的變異系數均小于0.063。可見用3種試劑盒檢測樣品時,試劑盒C的變異系數最小。
4 討論
酶聯免疫吸附法是一種與國際接軌的檢測方法,主要通過制作標準曲線來確定相關系數,再通過直線范圍內的吸光度值來計算出樣品中的牛血清蛋白含量,可以對樣品進行定量測定,并且具有特異性好、靈敏度佳的優點[3]。早在2004年,國內就已經研制出了用于檢測牛血清蛋白的ELISA試劑盒,經過驗證,具有較好的準確度、靈敏度和可重復性,且操作快捷。本試驗對3個不同生產廠家的ELISA試劑盒進行了各項質量參數驗證,對比其用于常規疫苗質量控制的可行性。
通過繪制標準曲線,可以看到3種試劑盒的相關系數均在0.95以上,相關系數最好的是試劑盒B,其次為試劑盒C,試劑盒A最差。但從標準曲線的變異系數來看,試劑盒A與試劑盒C的變異系數趨勢較一致,波動較小,特別是試劑盒A的變異系數均在0.115以內;而試劑盒B的變異系數波動較大(有兩個點的變異系數高于0.35),說明其標準曲線離散度大于其他兩種試劑盒。
在使用3種試劑盒檢測疫苗樣品中的牛血清蛋白含量時,試劑盒A的結果均為負值,說明未檢出,而試劑盒B與試劑盒C的結果均顯示樣品中含有不同濃度的牛血清蛋白,且試劑盒B的檢測結果顯示有7份樣品的牛血清蛋白含量高于50ng/mL,超標率為38.88%,而試劑盒C的結果顯示18個樣品的牛血清蛋白含量均在規定范圍內。從檢測樣品的變異系數來看,試劑盒A的變異系數較大,波動幅度大于其他兩種試劑盒,而試劑盒B與試劑盒C有較一致的變異趨勢,且試劑盒C的變異系數最小。說明在檢測樣品時,試劑盒C的重復性優于其他兩種試劑盒。
5 結論
整體而言,試劑盒C表現出較好的穩定性和可操作性,具有較好的相關性及可重復性。由于3種試劑盒所測樣品的牛血清蛋白含量的差異較大,無法最終判斷疫苗樣品中牛血清蛋白的含量,故建議使用已知濃度的牛血清蛋白標準品進行再次檢測,以確定試劑盒檢測結果的準確性;也可以在檢測時,適當將疫苗樣品稀釋,然后進一步檢測。綜上所述,3種試劑盒的優劣各有千秋,還需要進一步的試驗驗證。

