基于高通量測序和可培養方法的勐海發酵普洱茶細菌多樣性分析
張欣,姚粟*,白飛榮,田海霞,趙婷,馬躍,劉海新,李頌,郝彬秀,王春玲
1 (中國食品發酵工業研究院有限公司,中國工業微生物菌種保藏管理中心,北京,100015) 2 (中國茶葉有限公司,北京,102209)
勐海是云南地理標志產品普洱茶的重要發祥地和產區[1-2]。發酵普洱茶是采用“渥堆發酵技術”,以地理標志保護范圍內的云南大葉種為原料,經殺青、揉捻、曬干制成曬青毛茶,再經人工灑水,渥堆微生物發酵之后而成的后發酵茶類,具有獨特的風味和顯著的保健功能,深受大眾喜愛[3-5]。
微生物是普洱茶后發酵的核心,對普洱茶的品質產生至關重要的影響。不同原料、不同環境和不同的工藝造就了微生物的多樣性變化,通過微生物的代謝,產生多種生化產物,形成了普洱茶多樣化的風味[6]。目前,關于普洱茶發酵微生物的研究多集中在真菌,如黑曲霉、青霉、木霉等[7-10],對普洱茶發酵中細菌的研究較少。姚靜等人從普洱茶渥堆發酵過程中分離到芽胞桿菌屬、克雷伯氏菌屬、短桿菌屬、假單胞菌屬等7個屬的細菌[11]。王輝等人發現大理南澗鳳凰沱茶廠普洱茶堆中存在歐文氏菌屬、無色桿菌屬、芽胞桿菌屬、類芽胞桿菌屬、鞘氨醇桿菌屬、短桿菌屬、葡萄球菌屬等優勢細菌[12]。
對普洱茶微生物種類的研究主要依靠傳統的平板分離、純化等可培養的方法。但傳統方法存在數據不完整,不能全面揭示發酵過程中微生物的群落組成。隨著分子生物學的發展,PCR-DGGE、克隆文庫等非培養技術[13-15]開始用于普洱茶發酵微生物群落研究。Illumina高通量測序是近年來新興起來的基于宏基因組的深度測序技術,能直接反映微生物群落構成和多樣性,為環境、傳統發酵食品的微生物解析提供了新的工具,具有通量高、全面、準確的優勢[16-17]。
本文基于高通量測序的非培養技術,并結合傳統可培養方法對勐海普洱茶發酵各階段細菌種類、群落多樣性進行了研究,旨在揭示普洱茶發酵過程中細菌群落組成和變化規律,為普洱茶生產工藝的優化提供理論依據。
1 材料與方法
1.1 材料
1.1.1 茶葉樣品
普洱茶樣品采集自云南勐海百中堂茶莊(經緯度E 100°27′13″,N 21°58′57″;海拔1 136 m;環境溫度19~30 ℃,濕度45%~97%)同一發酵茶堆的9個發酵節點,具體信息見表1。取樣方法:利用取樣釬在發酵堆5個位點(四周及中央)的表面和內部(表面下約20 cm處)各取約200 g發酵茶樣品,置于取樣袋中充分混勻,冷鏈運至實驗室后,將樣品分成兩等份,1份4 ℃保存,用于可培養方法分離菌種,1份-80 ℃保存,用于基因組DNA提取和高通量測序。

表1 樣品編號及描述Table 1 Numbers and description of samples
1.1.2 試劑與儀器
試劑:胰酪胨大豆瓊脂(TSA)培養基,美國BD公司;磁珠基因組提取試劑盒,美國Omega Bio-Tek公司;細菌基因組DNA提取試劑盒,天根生化科技(北京)有限公司;PCR MasterMix、DL 2000 Marker,北京全式金生物技術有限公司;PCR引物由生工生物工程(上海)股份有限公司合成。
儀器:高速冷凍離心機(5424R),德國Eppendorf公司;PCR儀(TRIO48),德國Biometra公司;電泳儀(EC250-90),美國BIO-RAD公司;恒溫培養箱(GHP-9160),上海一恒科學儀器有限公司;測序由北京諾賽基因組研究中心有限公司完成;Illumina Miseq高通量測序由深圳華大基因科技有限公司完成。
1.2 方法
1.2.1 茶葉樣品可培養細菌的分離與鑒定
1.2.1.1 茶葉樣品可培養細菌的分離
將茶樣按四分法縮分后準確稱取25 g,置于225 mL滅菌生理鹽水中,150 r/min振蕩1 h,制成10倍稀釋液,取1 mL 稀釋液于9 mL滅菌生理鹽水的試管中,依次稀釋后制成 10-2、10-3、10-4、10-5、10-6濃度梯度稀釋液,選取10-3、10-4、10-5、10-6四個稀釋度,用移液器分別吸取0.l mL稀釋液涂布于TSA平板培養基上,每個稀釋度3個平行,于(28±1)℃培養箱內倒置培養48 h。根據菌落大小、形態和顏色等表型特征挑選優勢菌落進行平板劃線分純,獲得純菌種,并于-80 ℃甘油管冷凍保藏備份。
1.2.1.2 茶葉樣品可培養細菌的分子鑒定
利用細菌基因組DNA提取試劑盒提取優勢菌株DNA,以通用引物:27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′)[18]擴增菌株16S rDNA序列,再經EzBioCloud數據庫鑒定[19]。反應條件及序列數據比對分析參照ZHANG等人的方法[20]。
1.2.2 茶葉樣品的Illumina高通量測序分析
1.2.2.1 茶葉樣品DNA提取及高通量測序
液氮研磨結合磁珠法DNA提取試劑盒提取不同工藝階段茶葉樣品DNA,每個樣品重復提取3次并混勻。用微量核酸蛋白分析儀檢測DNA濃度及純度。采用細菌16S rDNA V4區引物進行PCR擴增[21]。利用Illumina高通量測序儀對茶樣DNA PCR擴增產物進行測序分析。
1.2.2.2 高通量測序數據分析
利用Illumina MiSeq 2×250 bp paired-end 測序后,下機數據經過濾,去除低質量的reads,用高質量的Clean data進行后續分析[22]。通過軟件FLASH,將reads通過reads之間的Overlap關系拼接成Tags[23]。通過軟件USEARCH在97%的相似度下將Tags聚成操作分類單元(Operational Taxonomic Unit,OTU)[24]。通過R(v3.1.1)語言中的VennDiagram包繪制Venn圖(不考慮OTU豐度,只考慮OTU有無),給出樣品間共有OTU個數。通過軟件RDP classifer(v2.2)將OTU代表序列在數據庫(Greengene V201305; RDP Release9 201203)中比對,進行OTU物種注釋[25]。通過軟件QIIME(v1.80)對樣品進行組成差異分析并計算樣品間距離,以判斷各樣品物種組成的差異性[26]。基于OTU和物種注釋結果進行樣品物種多樣性以及樣品間物種差異分析。
2 結果與分析
2.1 茶葉樣品可培養優勢細菌的分離與鑒定
采用平板稀釋法,選擇合適稀釋度涂布的平板,根據菌落形態、大小、顏色等表型特征,挑取不同單菌落,再經平板劃線分純,共獲得76株細菌菌株。經16S rDNA序列測定及比對分析,獲得優勢菌株的種屬名稱。部分優勢菌株的菌落形態及顯微形態見圖1,不同茶樣獲得優勢菌株的16S rDNA鑒定結果見表2,序列登錄號MG557666~MG557688。
9個樣品分離到細菌18個屬,30個種,共計76株。分離到的優勢菌主要分布在微桿菌屬(Microbacteriumsp.)、葡萄球菌屬(Staphylococcussp.)、小短桿菌屬(Brachybacteriumsp.)、考克氏菌屬(Kocuriasp.)、泛菌屬(Pantoeasp.)、芽胞桿菌屬(Bacillussp.)等。發酵起始階段曬青毛茶原料(G2)溶出大量內生菌,分離到的細菌種類較多。隨著發酵開始,環境微生物和暴露的內生細菌在外界溫濕度條件下,選擇性增殖,此消彼長。渥堆發酵開始后至發酵7 d(G3、G4),主要優勢菌逐漸集中在泛菌屬(Pantoeasp.)、Pluralibactergergoviae和假單胞菌屬(Pseudomonassp.)。發酵15 d(G5)優勢菌群轉變為微桿菌屬(Microbacteriumsp.)和葡萄球菌屬(Staphylococcussp.),并穩定維持到發酵完成(G10),提示這2種優勢細菌對于普洱茶后發酵的作用需要重點研究。另外,16S rDNA鑒定結果表明,分離到的微桿菌屬(Microbacteriumsp.)優勢菌株均為新種,小短桿菌屬(Brachybacteriumsp.)、考克氏菌屬(Kocuriasp.)和泛菌屬(Pantoeasp.)也分布有新種,這些發酵普洱茶中發現的潛在新種資源在國際上尚屬首次,對其功能和分類研究具有重要意義。

圖1 部分優勢菌株的菌落形態(a)及顯微形態(b)Fig.1 Colony morphology and microscopic morphology of some dominant strains
表2 不同茶樣分離的優勢菌種Table 2 The dominant species isolated from different tea samples

樣品編號菌落總數/(CFU·g-1)優勢菌種G21.5×105Kocuria palustris、Kocuria koreensis、Pantoea sp.、Oceanobacillus iheyensis、Brevibacterium sp.、Brachybacteri-um sp.、Bacillus sp.、Brevundimonas sp.、Paracoccus yeei、Pseudomonas sp.G36.3×108Pantoea sp.、Pluralibacter gergoviae、Pseudomonas sp.、Brachybacterium sp.、Klebsiella sp. G45.0×109Pantoea sp.、Pluralibacter gergoviae、Pseudomonas sp.G56.5×109Listeria grayi、Kocuria koreensis、Microbacterium sp.、Staphylococcus sp.、Alcaligenes sp.、Serratia sp.、Mi-crococcus sp. G62.3×109Microbacterium sp.、Staphylococcus sp.、Brachybacterium sp.G7/Microbacterium sp.、Staphylococcus sp.、Brachybacterium sp.G8/Microbacterium sp.、Staphylococcus sp.、Brachybacterium sp.G9/Microbacterium sp.、Staphylococcus sp.、Paracoccus communisG103.3×109Kocuria koreensis、Microbacterium sp.、Staphylococcus sp.
2.2 茶葉樣品的Illumina高通量測序分析
2.2.1 OTU統計及物種注釋
利用Illumina Miseq高通量測序技術對9個發酵時間節點的茶樣DNA PCR產物進行測序,測序數據經軟件拼接、過濾等處理后,9個樣品共獲得246 297條序列。在97%相似度下將其聚類用于物種分類的OTU(Operational Taxonomic Units), 9個樣品共產生212個OTU。OTU的venn圖(圖2)直觀展示了樣品間OTU的重疊情況。通過分析,G2、G4、G5、G6和G7共有的OTU為22;G6、G7、G8、G9和G10共有的OTU為77;G7、G8、G9和G10共有的OTU為88;G8、G9和G10共有的OTU為89,分別占這3個樣品細菌OTU的62%、66%和75%;G9和G10共有的OTU為95,占這2個樣品細菌OTU的70%和80%。說明隨著發酵的進行,微生物群落構成趨于穩定。
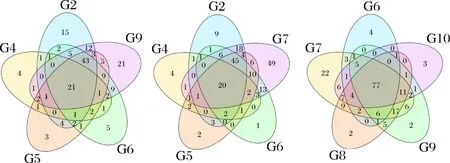
圖2 OTU venn分析Fig.2 OTU venn analysis
將OTU代表序列在數據庫中比對,進行物種注釋。9個樣品的細菌主要分布在61個屬,28個科,4個門(放線菌門(Actinobacteria)、擬桿菌門(Bacteroidetes)、厚壁菌門(Firmicutes)和變形菌門(Proteobacteria))。
2.2.2 發酵不同階段的菌落構成及豐度
根據OTU在發酵不同階段的每個樣品的豐度信息,計算出每個OTU在各個樣品中的相對豐度(即各種細菌物種所占樣品細菌總數的比例)。結果如圖3和表3所示。
其中屬水平豐度>5%的有12個屬:乳桿菌屬(Lactobacillussp.)、葡萄球菌屬(Staphylococcussp.)、考克氏菌屬(Kocuriasp.)、土地桿菌屬(Pedobactersp.)、草螺菌屬(Herbaspirillumsp.)、短桿菌屬(Brevibacteriumsp.)、歐文氏菌屬(Erwiniasp.)、泛菌屬(Pantoeasp.)、假單胞菌屬(Pseudomonassp.)、芽胞桿菌屬(Bacillussp.)、腸桿菌屬(Enterobactersp.)和小短桿菌屬(Brachybacteriumsp.)。
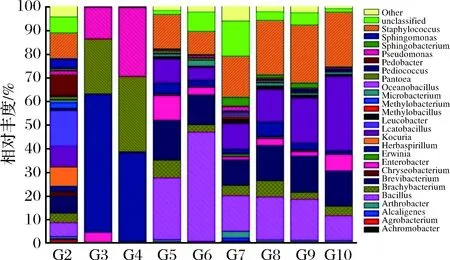
圖3 樣品屬水平的物種profiling堆積柱狀圖Fig.3 Profiling stack column of the sample at the levelof the genus
表3 發酵不同階段各樣品優勢菌屬及豐度Table 3 Dominant genera and abundance of samples in different stages of fermentation

樣品編號OTU數目優勢菌種及豐度G2111Lactobacillus sp.(15%); Staphylococcus sp.(11%); Kocuria sp.(9%); Pedobacter sp.(9%); Herbaspirillum sp.(8%); Brevibacterium sp.(7%); Brachybacterium sp. (4%)G350Erwinia sp.(58%); Pantoea sp. (23%); Pseudomonas sp. (13%)G439Erwinia sp.(38%); Pantoea sp. (32%); Pseudomonas sp. (29%)G599Bacillus sp. (26%); Brevibacterium sp. (17%); Staphylococcus sp. (15%); Enterobacter sp. (11%); Kocuria sp. (10%); Brachybacterium sp. (7%); Microbacterium sp. (1%)G6105Bacillus sp.(46%); Brevibacterium sp. (12%); Staphylococcus sp. (10%); Kocuria sp. (6%); Brachybacterium sp. (3%); Microbacterium sp. (2%)G7179Staphylococcus sp.(17%); Bacillus sp.(15%); Kocuria sp. (11%); Brevibacterium sp. (11%); Brachybacterium sp. (4%)G8143Staphylococcus sp.(23%); Bacillus sp.(18%);Brevibacterium sp. (15%); Kocuria sp. (14%);Brachybacterium sp. (7%)G9135Staphylococcus sp.(25%); Kocuria sp. (19%); Brevibacterium sp. (15%); Bacillus sp.(17%); Brachybacterium sp. (3%)G10119Kocuria sp. (31%); Staphylococcus sp.(23%); Brevibacterium sp. (15%); Bacillus sp.(10%); Brachybacterium sp. (4%)
曬青毛茶原料樣品(G2)菌落構成較為豐富,包括乳桿菌屬(Lactobacillussp.)、葡萄球菌屬(Staphylococcussp.)、考克氏菌屬(Kocuriasp.)、土地桿菌屬(Pedobactersp.)、草螺菌屬(Herbaspirillumsp.)及短桿菌屬(Brevibacteriumsp.)。渥堆發酵開始后(G3、G4),革蘭氏陰性的歐文氏菌、泛菌屬和假單胞菌大量繁殖,占90%以上。渥堆發酵15 d至發酵完成(G5至G10),葡萄球菌、芽胞桿菌、考克氏菌、短桿菌成為整個發酵中、后期的優勢菌群,優勢菌種此消彼長。而短桿菌和小短桿菌在整個過程中相對維持穩定(分別約占菌群15%和5%)。發酵中期(發酵15 d(G5)、發酵21 d(G6)),芽胞桿菌最為優勢。發酵后期(發酵29~41 d(G7、G8、G9)),芽胞桿菌優勢度逐漸下降,葡萄球菌躍升為最優勢菌,考克氏菌逐漸增加。發酵完成(G10),葡萄球菌維持穩定,芽胞桿菌優勢度繼續下降,考克氏菌進一步增殖,成為最優勢菌種。
2.2.3 樣品間物種組成差異分析
根據各樣品差異性的統計結果,對樣品進行Beta多樣性(Beta diversity)分析,比較樣品間在物種多樣性方面存在的差異大小,見圖4。采用Bray-Curtis距離作為衡量群落之間差異性的指標,Bray-Curtis距離值在0~1之間,值越大表示樣品間的差異越大。 由圖4可知,發酵前期樣品(G3、G4)差異最小,發酵中期樣品(G5、G6)組成相似,發酵后期樣品(G7、G8、G9和G10)聚為一支,組成相似。
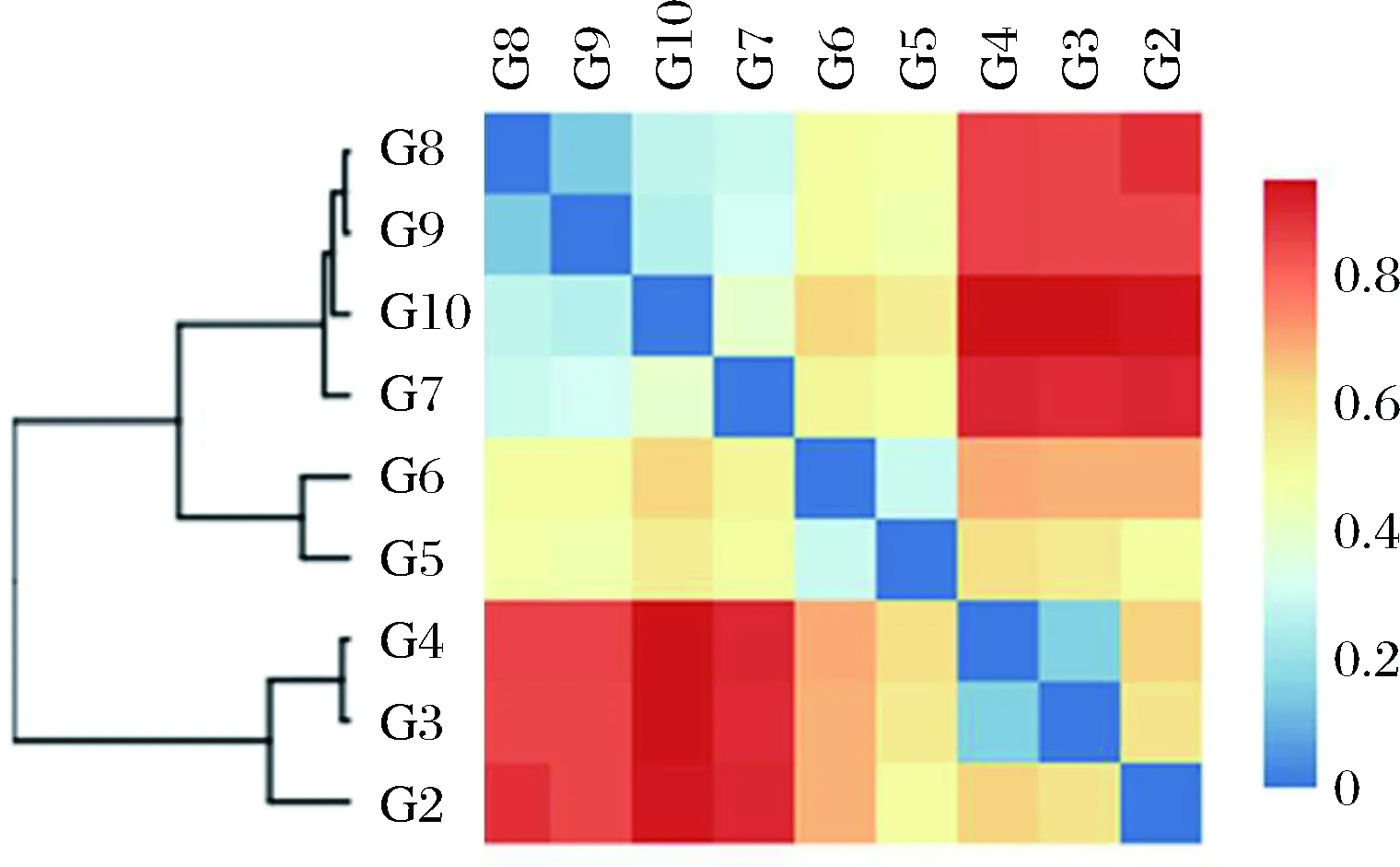
圖4 樣品Beta多樣性熱圖Fig.4 Beta diversity heatmap of samples
3 討論
通過傳統分離培養方法,從勐海普洱茶發酵不同節點的9個樣品中共分離得到18個屬,30個種,其中優勢菌屬有微桿菌屬(Microbacteriumsp.)、葡萄球菌屬(Staphylococcussp.)、小短桿菌屬(Brachybacteriumsp.)、考克氏菌屬(Kocuriasp.)、泛菌屬(Pantoeasp.)和芽胞桿菌屬(Bacillussp.)等。16S rDNA序列分析發現這些優勢屬中分布有一定數量的新種,這在以往的普洱茶研究中尚未見報道。深入研究和挖掘這些新種在微生物分類學和發酵普洱茶微生物資源的保護方面具有積極意義。
通過高通量測序方法,9個樣品共解析到細菌61個屬,212個OTU,包含了培養方法分離到的菌種對應的屬級分類單元,可見與傳統方法相比,高通量測序更全面地揭示了發酵普洱茶樣品的細菌群落構成。高通量測序數據分析顯示:曬青毛茶原料的菌落構成較為豐富,包括乳桿菌屬(Lactobacillussp.)、葡萄球菌屬(Staphylococcussp.)、考克氏菌屬(Kocuriasp.)等;而發酵前期以革蘭氏陰性的歐文氏菌屬(Erwiniasp.)、泛菌屬(Pantoeasp.)和假單胞菌屬(Pseudomonassp.)為主;而發酵中后期芽胞桿菌屬(Bacillussp.)、葡萄球菌屬(Staphylococcussp.)、短桿菌屬(Brevibacteriumsp.)、考克氏菌屬(Kocuriasp.)及小短桿菌屬(Brachybacteriumsp.)為優勢菌群穩定存在,約占樣品群落組成的75%。
本研究對勐海百中堂茶廠普洱微生物的研究與其他學者的研究結論具有一定的一致性同時又有獨特性。歐文氏菌、假單胞菌、芽胞桿菌、微桿菌等均為常見的植物內生菌,隨著渥堆發酵的進行,溫濕度、含氧量、原料基質理化特征發生變化,優勢菌群也隨之改變。王輝[12]等人對云南南澗鳳凰沱茶廠發酵普洱茶的研究中發現:除了葡萄球菌屬(Staphylococcussp.)、芽胞桿菌屬(Bacillussp.)、短桿菌屬(Brevibacteriumsp.)等優勢菌外,歐文氏菌屬(Erwiniasp.)在整個發酵不同階段不同茶樣層間均表現優勢。而本研究僅在發酵前期發現歐文氏菌屬(Erwiniasp.)占絕對優勢(38%~58%)。姚靜[11]等人通過分離培養法,發現芽胞桿菌屬(Bacillussp.)在普洱茶發酵中所占比例遠大于其他細菌,處絕對優勢地位。葛慈斌[27]等人的研究發現多種芽胞桿菌是普洱茶發酵后期的優勢菌群。芽胞桿菌能夠適應不同的環境條件,可兼性厭氧生長,在高溫缺氧條件下以芽胞的形式存活,因此在整個普洱茶發酵加工過程中優勢存在。研究表明芽胞桿菌又是產生多種生物酶類的重要來源,其分泌的多酚氧化酶能夠將黃烷醇類及其糖苷類底物轉化為如雙黃烷醇、茶黃素、茶紅素等,在黑茶風味和成色的形成中起著重要作用[28]。葡萄球菌是發酵中后期的優勢菌種,具有有氧呼吸和無氧發酵的能力,能提高過氧化氫酶活力,促進耗氧,抑制酸敗微生物。據報道,S.carnosus、S.sciuri、S.xylosus、S.kloosii等葡萄球菌具有產大量支鏈醛、甲基酮和脂肪酸乙酯等芳香成分、硝酸鹽還原和蛋白酶降解等能力[29-35]。據國際乳品聯合會發布的歐美各國傳統發酵食品中的微生物名單(IDF 455-2012),其中有多種葡萄球菌(S.carnosus、S.cohnii、S.condimenti、S.equorum、S.fleurettii、S.piscifermentans、S.saprophyticus、S.sciuri、S.succinus、S.vitulinus、S.warneri和S.xylosus)作為肉類、乳制品和豆類的發酵菌種,并有悠久的安全食用歷史。本研究在發酵普洱茶中也分離到其中的S.sciuri和S.xylosus這2種葡萄球菌,其中S.xylosus也已于2016年被列入我國《可用于食品的菌種名單》。研究發現這些發酵食品中的葡萄球菌具有產芳香風味、硝酸鹽還原和蛋白酶降解等能力[29-32]。本研究分離到的S.kloosii最早由SCHLEIFER等人于1984年發現并命名[36],在許多發酵食品,如豆豉[37]、豆醬[38]、Inyu(黑豆醬)[29]、Miso[39]發酵過程中均有分離到該菌種。陳廷濤發現在傳統發酵豆豉中也有S.gallinarum[37]。本研究分離到的其他優勢菌屬在一些傳統發酵食品中也有報道,如Kocuriakoreensis在韓國傳統發酵海產品(comb pen shell)中被發現[40],Microbacteriumgubbeenense存在于斑點成熟奶酪的表層[41]。此外,Brachybacteriumzhongshanense報道具有纖維素分解能力[42]。其他優勢菌種短桿菌屬、微桿菌屬、考克氏菌屬菌種多以新種的形式存在,其在發酵過程中的作用有待進一步研究。鑒于安全性考慮,發酵普洱茶中的這些優勢菌種的功能、酶學特性及安全性評價是下一步研究的重點。

