表面蛋白EpCAM檢測循環腫瘤細胞缺陷的研究進展
謝瑞芝,黎必非,練殊,李書慧,賈力
福州大學腫瘤轉移預警和預防研究所,福州 350116
腫瘤患者的病死率與疾病診斷的時期有關,90%以上的腫瘤患者死亡是由于發生了腫瘤轉移[1-4]。早在十多年前,就有學者提出了腫瘤細胞可以在早期生長過程中脫離原發腫瘤,具有較弱的侵襲能力[5];但是目前腫瘤分期程序和高分辨率影像技術對腫瘤轉移的探測均不夠敏感,不能探測到腫瘤進程中的關鍵步驟:腫瘤微小轉移或者早期腫瘤侵襲[6]。多年來,很多用于探測外周血循環腫瘤細胞(circulating tumor cell,CTC)的程序被開發,但其敏感度和特異度均不高[7-11]。直到20世紀70年代中期,一個檢測CTC的重大發現:上皮細胞黏附分子(epithelial cell adhesion molecule,EpCAM)以不同水平在上皮細胞和上皮腫瘤細胞中表達,Ep-CAM也存在于血液細胞中[12],后續研究也證實了這個發現[13-14]。之后Riethmüller團隊開創首個Ep-CAM富集方法,并聯合逆轉錄聚合酶鏈反應用于腫瘤患者的CTC檢測[15]。后來CellSearch自動化系統獲得了廣泛關注,該系統已經被美國食品藥品監督管理局(Food and Drug Administration,FDA)批準用于轉移性乳腺癌、結腸癌、前列腺癌中CTC的檢測[16]。目前,以EpCAM為基礎的CTC檢測方法是應用最普遍的CTC檢測方法之一。值得注意的是,很多證據表明,CTC由上皮腫瘤細胞、上皮-間充質轉化(epithelial-mesenchymal transition,EMT)細胞、混合(上皮和EMT陽性)腫瘤細胞、不可逆EMT陽性腫瘤細胞、循環腫瘤干細胞(circulating tumor stem cell,CTSC)組成,具有多相性[8,17-20],并不是所有的腫瘤細胞都有EpCAM表達。在EpCAM表達水平較低、非上皮表型CTSC和經歷EMT的情況下,以EpCAM為基礎的檢測方法無法檢測到CTC。這個檢測方法的靈敏度和特異度均較低,可能會低估CTC,尤其是CTSC和EMT陽性腫瘤細胞在腫瘤轉移中的重要性。
1 CTC
CTC是多種類型的細胞,包括單細胞或者細胞群落。腫瘤細胞逃逸到循環系統以線狀或者塊狀出現,1天內1 g腫瘤組織中有100萬個細胞進入血液[10,21],但是只有極少數具有高度活性、轉移潛能的腫瘤細胞在循環系統中可以存活,相互聚集形成微小癌栓,并在一定的條件下發展為轉移病灶[21-23]。來源于原發腫瘤細胞(圖1)或者轉移器官并散布在外周血管的CTC具有高度異質性,有強大的形成轉移病灶的能力[24-26]。CTC的分子特性被認為是一個實時“液體活檢切片”,可能有利于腫瘤患者治療的動態監測及個體治療,這些足以見證CTC在腫瘤發生和轉移中所扮演的重要角色[21,24,27]。假設在造血運輸期間靶向CTC,在轉移高峰期和末期有效地抑制CTC,可以降低腫瘤患者的發病率和病死率。
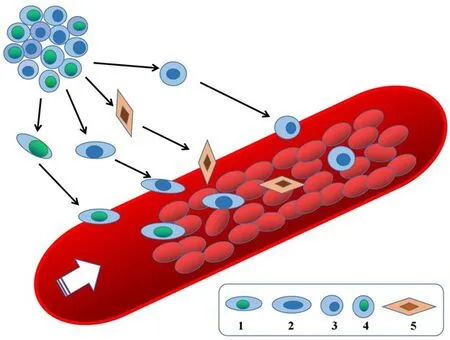
圖1 外周血循環中的原發腫瘤細胞亞群
利用CTC的物理性質和生物學特性從大量的血液細胞中分離CTC,生物學特性主要應用于抗體免疫學,識別腫瘤相關抗原(正向選擇)或者普通的白細胞分化群(cluster of differentiation,CD)抗原中的CD45(負向選擇)[10]。正向選擇是EpCAM抗體只分離表達EpCAM抗原的細胞[28],這種方法的缺點是無法檢測表達水平較低的EpCAM、EpCAM-和非上皮表型CTC如CTSC和EMT陽性細胞,并且它們與抗體的分離需要外界破壞CTC表面EpCAM受體與EpCAM抗體之間的離子鍵,所以正向選擇分離的CTC的生存能力下降。通過物理方法或者負向選擇的上皮、非上皮顯性的CTC、CTSC、EMT陽性腫瘤細胞可以生存,但是所有通過物理方法和負向選擇分離的循環細胞不一定來源于腫瘤,它們可能來源于正常的血管、基質細胞、間充質細胞、干細胞及其他在循環系統中很少存在的宿主細胞[7,11]。因此,通過物理方法和負向選擇分離CTC是混合的,需要進一步純化才能使用,而正向選擇可以分離出高純度的、來源于腫瘤的CTC。
由于多重內在和外在因素作用,導致CTC數量少,可塑,基因型和表型可變,CTC的探測仍然存在技術挑戰。CTC數量非常少并且多相,鑒定CTC及分析其特性需要富集和探測相結合,并且應用敏感度和特異度強的分析方式。對大量的細胞用不恰當的分離技術,不僅阻礙了對CTC的生物性質的理解,也阻礙了對CTC的精細分析和功能研究。
2 EpCAM用于檢測CTC的缺陷
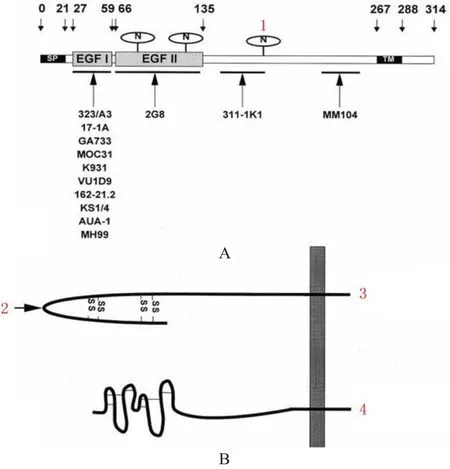
圖2 EpCAM的結構與構象模型

表1 不同腫瘤細胞中的EpCAM表達情況
EpCAM是一種由314個氨基酸組成的I型跨膜糖蛋白,相對分子質量為39~42,是同種抗原的上皮細胞間的黏附分子。這種糖蛋白可以被識別,如相對分子質量為40的糖蛋白可以被單克隆抗體17-1A識別(圖2),該抗體也稱為ESA、Ber-EP4、MH99、 AUA1.MOC31、323/A3、KS1/4、GA733、HEA125等[29],EpCAM 由 Litvinov 團隊命名[30]。在一些健康成年人的正常組織和器官中,EpCAM高表達,并且大多數腫瘤有EpCAM表達,上皮組織的腫瘤通常呈EpCAM強陽性,非上皮組織的腫瘤呈EpCAM陰性,間充質腫瘤僅顯示弱陽性或者偶有弱陽性[8,31]。在不同腫瘤組織中EpCAM表達情況不同(表1)[32],并且不同腫瘤組織中EpCAM表達情況差異顯著[30,32]。
為了從血樣中一次性分離CTC,EpCAM抗體受到了重點關注。CellSearch系統的缺陷是靈敏度相對較低:在每毫升只有一個CTC且純度低的情況下,只有少部分的轉移癌患者檢測CTC呈陽性[19,28,33]。依據Seldinger導絲穿刺法[34],一個新的、以EpCAM為基礎的、從未經處理的血樣中分離CTC的單步富集方法被報道[35]。這個裝置可以成功地分離腫瘤各時期的CTC,包括未確診的腫瘤早期遠處轉移,這種應用于生物體內的方法的優點是可以以較大的血液樣本去捕獲CTC,特別是對于CTC較少的早期腫瘤患者,每次需要獲取大量的腫瘤患者的血液,才可以做到實時、動態、準確地監測腫瘤發展情況[18,36]。盡管以EpCAM為基礎的富集方法具有很大的潛力,但是靈敏度和特異度較低,因此基于EpCAM檢測CTC的方法還存在缺陷。
2.1 CTC存在多相性
CTC是由混合型細胞組成,包括上皮腫瘤細胞、EMT細胞、混合(上皮和EMT陽性)腫瘤細胞、不可逆EMT陽性腫瘤細胞和CTSC。因此,以Ep-CAM為基礎的檢測方法無法檢測到EpCAM低表達的CTC、CTSC、EMT陽性和EpCAM-細胞。CSC是具有干細胞特性的腫瘤細胞的罕見亞型,不同的亞型有不同的功能屬性,并且在腫瘤進展中具有多樣性,因此表面標志物并不能明確地富集所有的CSC。到目前為止,研究人員已經確定了一些表面標志物,可以從大多數腫瘤類型的原發性腫瘤組織中富集各種CSC[17,26,37]。由于CSC的高度異質性及大多數常規抗腫瘤療法根除患者體內CSC的能力有限,所以復發初始階段的CSC必須被捕獲和表征[17,33]。
數據顯示,即使通過CellSearch系統,仍有三分之一的轉移性乳腺癌患者使用傳統的EpCAM方法無法檢測到CTC[38-39],并且在轉移性乳腺癌患者中僅三分之一的患者CTC中EpCAM+的事實也驗證了這一點[40-41],另外大部分患有神經內分泌腫瘤、結直腸癌、非小細胞肺癌等的患者無法檢測到CTC[42]。CSC 可以表達轉錄因子,如 TWIST、SNAIL、SLUG轉錄因子均可以引起EMT[43],EMT過程可能引起EpCAM的動態表達[17,32,37]。與其他EMT陽性細胞一樣,CTSC可能也會下調包括Ep-CAM在內的標志物的表達水平和上調多種間質細胞標志物的表達水平。CTC具有多相性,包括上皮腫瘤細胞、EMT陽性腫瘤細胞和CTSC,這些細胞共同存在于外周血中,不同腫瘤細胞的EpCAM表達水平不同,以EpCAM為基礎的檢測方法無法檢測到表達水平低的EpCAM和非上皮表型CTC,如CTSC、EMT陽性細胞和EpCAM-細胞。
2.2 EpCAM的動態表達
EpCAM被發現后的很長一段時間內,在整個腫瘤研究進展中EpCAM的穩定表達是不容置疑的事實,直到一個關于EpCAM動態表達的文章[31,44]發表后,才發現如果僅依據單獨的EpCAM作為CTC的捕獲抗原,會錯過對相關CTC的捕獲。數據表明,在腫瘤細胞轉移進入血液的過程中EpCAM表達下調,與原發性腫瘤或者轉移腫瘤相比,每個細胞的EpCAM分子表達量明顯降低(400 000vs49 700),腫瘤細胞EpCAM的下調阻礙了CTC的捕獲[28,31-32]。此外,處理小鼠時心臟注射和靜脈注射高表達的EpCAM腫瘤細胞后僅30 min EpCAM表達開始下調,注射4 h已經檢測不到EpCAM的表達[18]。這個結果揭示了CTC中EpCAM表達變化迅速,似乎依賴于與體內器官或者內皮表面的聯系。實驗證明,在EpCAM高表達的結腸癌細胞轉移進入血液后,EpCAM表達水平明顯降低,并且通過CD44+和CD47+可以成功分離CTC[18,45-46]。相關研究顯示,盡管在原發性腫瘤中EpCAM高表達,但是在食管癌患者的骨髓中檢測到的彌散性腫瘤細胞的數量減少,并且三分之二的食管癌患者有攜帶EpCAM-的散播腫瘤細胞(disseminated tumor cell,DTC)[44,47]。
2.3 存在不可逆的EMT陽性腫瘤細胞
當發現EMT過程使腫瘤細胞出現紡錘形,具有流動性、去極化、抗失巢凋亡、免疫逃逸、轉移特性時,依賴上皮標志物的檢測方法的缺點就更加明顯。EMT是CTC和DTC表面EpCAM表達下調的重要觸發因素,可以下調上皮標志物(EpCAM、細胞角蛋白)的表達水平以及上調多種間充質細胞標志物的表達水平[17,48-49]。另外,基于體內外研究驗證,CTC作為上皮腫瘤細胞進入脈管系統后,血小板衍生生長因子促使其轉變為EMT陽性腫瘤細胞,可見腫瘤細胞進入血液后也可能發生EMT[43,46],而進一步分化的CSC EMT表型的亞群在腫瘤惡化中的作用仍然不確定[50]。CTC具有多相性,其中CTSC的亞群經歷了EMT過程并固定在間充質細胞中,不會轉變為上皮細胞表型[17-18]。因此,在腫瘤研究以及其他檢測CTC中EMT陽性細胞存活率的研究中,區分這兩類EMT陽性細胞對確認正確的表型十分重要。
最新研究發現,CTC中腫瘤細胞和CSC的EMT轉變發生在侵襲前和轉移擴散前[48,51-52]。轉移性非小細胞肺癌、轉移性乳腺癌、前列腺癌晚期患者與早期乳腺癌患者相比,轉移性CTC表達EMT相關蛋白的概率較高,如波形蛋白、纖連蛋白、鈣黏附蛋白-N和鈣黏附蛋白-O[52-54]。臨床認為,相比于乳腺癌早期,CTC的EMT標志物在腫瘤轉移中出現的頻率更高,而且相比于單獨使用上皮標志物,EMT標志物可以更好地預測惡性轉化[55]。因此對于接受同源造血干細胞移植和大劑量的化學治療的轉移性乳腺癌患者,與EMT相關的標志物同樣可以作為檢測CTC的標志物[48]。最近出現一個新的標志物——細胞表面波形蛋白,用于乳腺癌患者和結直腸癌患者EMT陽性的CTC檢測[56]。在對58例轉移性乳腺癌患者的試驗研究中,發現相比于EpCAM,細胞表面波形蛋白抗體顯示出更加優異的靈敏度和特異度[17]。
3 小結
僅依靠基于細胞表面EpCAM表達水平的免疫親和富集方法,CTC中的EpCAM-、EMT陽性細胞和CTSC細胞會被遺失。使用EpCAM抗體的研究方法可能會低估CTC、EMT陽性和CTSC的重要性,尤其是EpCAM在腫瘤轉移中的重要性。有必要對CTC的分離技術作進一步的研究,更重要的是自動CellSearch系統不能作為所有新的CTC檢測技術的參考標準。一種類型的CTC通常同時表達多個表面生物標志物并且一個生物標志物有多種類型,單一CTC生物標志物的技術不足以高效、特異地捕獲CTC,而多種多樣的抗體綴合物可以同時識別并結合具有更強親和力的細胞表型的生物標志物,雙抗體綴合物可以靈敏、特異地捕獲目標CTC,無論是體外靜態還是體內動態條件[57-59]。EpCAM-乳腺癌細胞系高頻表達CD146(與不良預后有關的原發乳腺癌的子標志物),為了檢測Ep-CAM+的CTC,提倡聯合使用CD146抗體和Ep-CAM抗體[60]。同樣,聯合使用EpCAM抗體和細胞角蛋白抗體可以檢測EpCAM-或低表達角蛋白的CTC。最近,黏附分子CD49f(整合素α6亞單位)抗體與細胞角蛋白抗體聯用已被證實可以增強與EMT關聯的CTC檢測的效果[61]。充足的證據顯示,其他上皮CTC的標志物包括CD176、表皮生長因子受體(epidermal growth factor receptor,EGFR)、人類表皮生長因子受體2(human epidermal growth factor receptor 2,HER2)和黏蛋白1(mucin 1,Muc1),CTSC 表面標志物有 CD26、CD44、CD133和CXC趨化因子受體4(CXC chemokine receptor 4,CXCR4),循環EMT陽性腫瘤細胞表面標志物有波形蛋白、纖連蛋白、鈣黏附蛋白-N和鈣黏附蛋白-O[18]。因此,未來的研究應該是將EpCAM抗體與上皮CTC、CTSC、EMT陽性腫瘤細胞表面標志物的抗體結合,以達到最好的檢測效果。同時通過吐溫-20處理去除對EpCAM的掩蔽,可以有效地提高捕獲乳腺癌患者EpCAM低表達的CTC的能力[62]。CTC檢測的靈敏度取決于EpCAM抗體,所以建議同時使用不同的EpCAM抗體[18,63]。利用上皮腫瘤細胞、CTSC、EMT陽性和雜交細胞亞型表面的生物標志物,可以提高基于EpCAM富集CTC方法的靈敏度及特異度。

