重度宮腔粘連電切術后羊膜移植羊膜放置方式臨床研究*
吳本媛,王 佳(重慶醫科大學附屬大學城醫院婦產科,重慶401331)
宮腔粘連又稱為Asherman綜合征,是指因子宮內膜基底層損傷、宮腔內壁粘連、纖維瘢痕形成導致的一系列以經量減少、閉經、不孕為主要表現的臨床綜合征[1],嚴重影響女性生殖健康。針對輕度宮腔粘連患者,因其粘連部位局限,可采取期待治療、超聲引導擴宮、人工周期等保守治療方式[2],而針對中、重度宮腔粘連患者,其內膜嚴重損傷甚至完全缺失,宮腔內大量纖維粘連形成[3?4],單純保守治療無法恢復正常宮腔形態從而未達到促進子宮內膜修復、恢復生殖功能的目的。宮腔鏡憑借其直視性、微創性已成為診斷宮腔病變的“金標準”[5],同時可于直視下盡量保護正常子宮內膜、分離粘連、切斷纖維瘢痕,恢復正常宮腔形態。宮內節育器(IUD)、宮腔球囊(Foley′s catheter)、醫用粘連沖洗液、防粘連膜等均被應用于術后再粘連預防中[6?7],術后因創面滲出、內膜新生、局部感染等因素常導致術后再粘連形成,且術后再粘連率高達62.5%[2]。因此,如何預防宮腔粘連電切術后再粘連形成成為目前治療宮腔粘連主要研究內容之一。
自DAVIS 1910年首次將羊膜移植應用于眼科中以來,其作為一種生物膜羊膜逐漸在皮膚科、消化外科、神經外科等領域廣為應用[8]。這一方法也逐漸應用于宮腔粘連術后預防再粘連治療中,王欣等[9]、何全中[10]、張玲等[11]證實,較其他方法羊膜移植對預防中重度宮腔粘連電切術后再粘連具有顯著優勢。電鏡下羊膜可分為5層,由內到外依次分為上皮層、基底層、致密層、成纖維細胞層和海綿層,后三者在組織切片上統稱為基質層[12]。因其組織形態學差異,作者推測,在羊膜移植中,將羊膜不同層面貼向宮腔其作用效果也將有所差異。本研究以接受宮腔鏡下宮腔粘連電切術的重度宮腔粘連患者作為研究對象,采取隨機對照研究,對比分析術后行羊膜移植時將羊膜不同層面貼向宮腔對于預防再粘連形成的影響。
1 資料與方法
1.1 資料
1.1.1 一般資料 選取2015年6月至2017年1月就診于本院并于宮腔鏡下診斷為重度宮腔粘連[美國生育協會(AFS)評分大于或等于9分]患者共76例。
1.1.2診斷標準 采用AFS評分,包括粘連累及范圍(<1∕3 為 1 分,1∕3~2∕3 為 2 分,>2∕3 為 4 分)、粘連程度(菲薄為1分,菲薄和致密粘連均存在為2分,致密為4分)、月經模式改變(正常為0分,月經量減少為2分,閉經為4分)。計算各項總分診斷:1~4分為輕度粘連,5~8分為中度粘連,9~12分為重度粘連。
1.1.3 納入及排除標準 (1)納入標準:①年齡20~≤40歲;②有經量減少、閉經等臨床表現;③有生育要求。(2)排除標準:①年齡大于40歲或小于20歲;②合并其他內生殖器疾病,如子宮腺肌癥、多囊卵巢綜合征,生殖器畸形等;③合并嚴重內外科疾病,如血栓性疾病、自身免疫性疾病等;④有激素使用禁忌;⑤結核、射線化學藥劑所致宮腔粘連;⑥無生育計劃。
本研究經過重慶醫科大學倫理學會倫理審查同意,同時于 Clinical Trials.gov(NCT02496052)完成倫理注冊;所有患者及至少1名直系親屬術前均詳細知曉手術內容及風險,同時簽署知情同意書。
1.2 方法
1.2.1 實驗設計 術前詳細記錄所有符合標準的46例患者年齡、月經史、婚育史、術前子宮內膜厚度、女性激素水平、宮腔粘連程度,AFS評分等。將46例患者隨機分為上皮層組(接受宮腔粘連電切術后將羊膜上皮面貼向宮腔)25例和基質層組(術后將羊膜基底層貼向宮腔)21例。2組患者術后均于宮內同時放置Foley球囊使羊膜充分貼附于子宮腔內。所有患者術后均臥床休息,同時予以靜脈預防抗感染治療3 d,術后第5天拔出宮內球囊。所有患者術后第2天均予以戊酸雌二醇9 mg口服,共計28 d。術后1、3個月,2組患者分別至本院門診復查婦科超聲、宮腔鏡檢查,同時記錄患者月經情況、子宮內膜厚度、宮腔粘連程度、AFS評分、妊娠情況等。
1.2.2 手術設備與手術操作
1.2.2.1 手術器械 奧利巴斯公司a4674a被動式連續灌流宮腔鏡,a22001a生理鹽水電切鏡電切鏡,ues?40高頻電刀,wa22302d電極,膨宮液:生理鹽水;超聲:西門子公司X300超聲儀;Foley球囊:選用16Fr雙腔氣囊導尿管。
1.2.2.2 術前處理 術前12 h宮頸內放置一次性宮頸擴張棒[魯食藥監械(準)字2014第2660587號(更)],濟南晨生醫用硅橡膠制品有限公司生產]以軟化宮頸。
1.2.2.3 羊膜的制備 羊膜母體選擇術前乙型肝炎、丙型肝炎、艾滋病、梅毒均陰性的擇期剖宮產孕婦,且孕婦無高血壓疾病、妊娠合并肝內膽汁淤積癥等產科并發癥及合并癥,術中羊水清亮。胎盤一經娩出即置于無菌條件下制備新鮮羊膜(fresh amniotic membrane)。將洗凈羊膜剪成約25 mm×30 mm大小,7號絲線于羊膜邊緣打結區分上皮層與基底層,打結面為上皮面。將羊膜置于含有抗生素(150 mg∕L頭孢呋辛酯)的無菌生理鹽水中,24 h內使用。
1.2.2.4 手術操作 由同一宮腔鏡醫生于超聲引導下行宮腔粘連電切術,術中記錄患者宮腔形態、粘連部位及程度。2組患者術后宮腔內行羊膜移植:上皮層組將上皮層貼附向術后宮腔,基底層組將基底層貼附向術后宮腔;術后宮腔內均放置Foley球囊使羊膜充分貼附于宮腔。
1.2.2.5 術后治療 所有患者術后第2天均開始給予雌激素治療,口服戊酸雌二醇3 mg每8小時1次,共28 d,術后靜脈抗生素預防抗感染治療3 d。球囊于術后第5天取出。
1.3 統計學處理 采用SPSS22.0統計軟件進行數據分析,計量資料以表示,2組比較用獨立樣本t檢驗;計數資料以率表示,2組采用χ2檢驗,檢驗水準α=0.05。P<0.05為差異有統計學意義。
2 結 果
2015年6月至2017年1月本院共收治宮腔粘連患者76例,其中符合試驗納入標準患者共60例,28例納入上皮層組,32例納入基質層組。隨訪過程中,共14例退出試驗,其中上皮層組3例,基質層組11例。
2.1 2組患者術前一般資料比較 2組患者術前年齡、經期、周期、孕次、產次、人工流產次數、術前子宮內膜厚度比較,差異均無統計學意義(P>0.05),見表1。
表1 2組患者術前一般資料比較(±s)
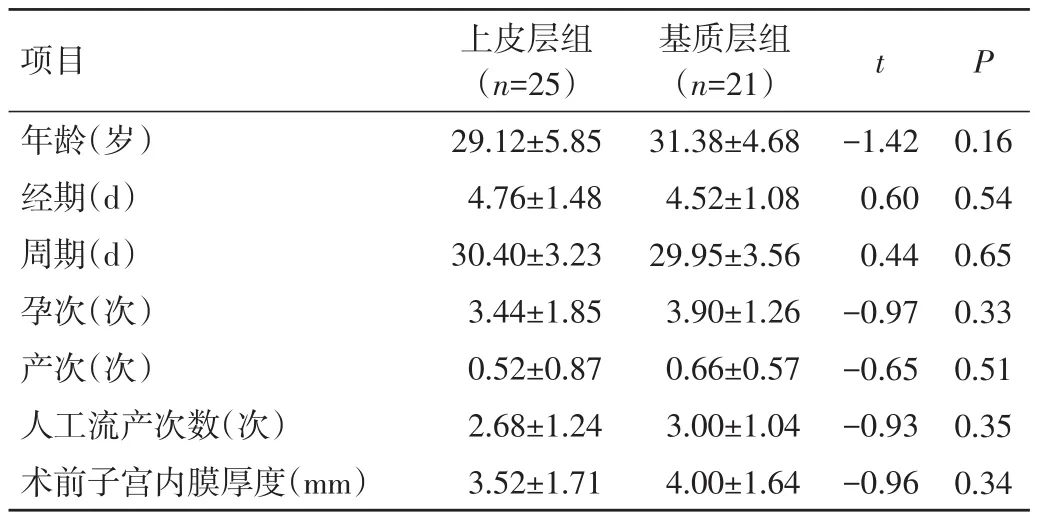
表1 2組患者術前一般資料比較(±s)
項目年齡(歲)經期(d)周期(d)孕次(次)產次(次)人工流產次數(次)術前子宮內膜厚度(mm)上皮層組(n=25)29.12±5.85 4.76±1.48 30.40±3.23 3.44±1.85 0.52±0.87 2.68±1.24 3.52±1.71基質層組(n=21)31.38±4.68 4.52±1.08 29.95±3.56 3.90±1.26 0.66±0.57 3.00±1.04 4.00±1.64 t P-1.42 0.60 0.44-0.97-0.65-0.93-0.96 0.16 0.54 0.65 0.33 0.51 0.35 0.34
2.2 2組患者手術前后宮頸粘連程度比較 2組患者術后月經均得到改善,宮腔粘連程度較術前減輕,術后1、3個月AFS評分均較術前降低,且上皮層組AFS評分低于基質層組,差異均有統計學意義(P<0.05),見表2。
表2 2組患者手術前后AFS評分比較(±s,分)

表2 2組患者手術前后AFS評分比較(±s,分)
注:與同組術前比較,aP<0.05
時間術前術后1個月術后3個月t P 0.39 0.01 0.01上皮層組(n=25)9.90±0.68 2.00±1.47a 0.48±1.12a基質層組(n=21)9.68±0.48 3.62±1.74a 1.85±1.50a 0.85-3.41-3.58
2.3 2組患者手術前后子宮內膜厚度比較 2組患者術后1、3個月子宮內膜厚度均較術前增加,差異均有統計學意義(P<0.05),但組間術后比較,差異無統計學意義(P>0.05),見表 3。
表3 2組患者手術前后子宮內膜厚度比較(±s,mm)

表3 2組患者手術前后子宮內膜厚度比較(±s,mm)
注:與同組術前比較,aP<0.05
時間術前術后1個月術后3個月上皮層組(n=25)3.52±1.71 5.40±1.50a 6.56±1.38a基質層組(n=21)4.00±1.64 5.90±1.40a 6.38±1.24a t P-0.97-1.14 0.46 0.34 0.26 0.65
2.4 隨訪 隨訪期間,上皮層組25例患者中共4例成功妊娠,其中1例于孕24周不明原因胎死宮內,2例足月產活產,足月產中1例因胎盤植入發生產后出血,1例尚妊娠中,妊娠率為16.0%;基質層組21例患者中共3例成果妊娠,1例于停經56 d發生稽留流產,2例足月活產,妊娠率為14.2%,2組妊娠率比較,差異無統計學意義(P>0.05)。
3 討 論
子宮內膜由內到外分為功能層和基底層,在性激素作用下發生周期性增殖、剝脫[13];同時,在雌激素作用下,基底層腺體斷端處上皮細胞增生形成新的功能層,覆蓋子宮體腔達到修復創面的作用[14]。因此,即使每個月經周期都有子宮內膜的壞死剝脫,子宮前后壁互相緊貼也不會形成粘連[15]。而在重度宮腔粘連患者中,基底層損傷、腺體消失,導致上皮細胞、新生血管形成受阻;同時,在創面修復過程中,成纖維細胞生成增加,細胞外基質(ECM)堆積,導致局部纖維結締組織增殖,子宮前后壁相互貼附,導致粘連形成[16?17]。因此,抑制創面滲出,避免創面互相接觸、促進子宮內膜生長修復成為術后預防宮腔再粘連形成的主要手段。
臨床上宮內節育器、子宮球囊、醫用幾丁糖(chito?san)等均被用于預防再次粘連的發生。宮腔作為一潛在體腔,宮內節育器因其特殊的環狀結構并不能將其完全分隔;同時,其局部壓迫可能導致宮腔局部缺血、誘發炎性反應,加重粘連形成[2]。在前期研究中,作者發現,術后予以放置宮內節育器患者隨訪時行宮腔鏡檢查可見纖維包繞宮內節育器,甚至導致宮內節育器局部嵌頓[18]。而針對宮內球囊,特別是心型球囊的出現,能夠充分分隔子宮內壁,但宮腔粘連電切術后,創面炎性反應,局部纖維蛋白原釋放,由于球囊自身不具有抗炎作用,纖維蛋白原在球囊表面沉積,促進陰道上行細菌及其生物膜的增長,有潛在導致宮腔粘連形成危險[19]。
羊膜是到目前為止已知的最厚的生物膜,作為一種生物屏障廣泛應用于燒傷、外周神經修復等外科領域。特別是在眼科領域,羊膜移植已成為一種較為成熟的治療眼表損傷、預防術后粘連形成的常見術式。在一項納入120例的隨機對照研究中,較單獨使用宮內球囊,羊膜能夠改善月經情況、降低宮腔粘連患者再粘連發生率[20]。本項目前期對照宮腔粘連患者予以羊膜移植及放置醫用粘連沖洗液對比,發現羊膜移植對于改善宮腔粘連患者術后月經情況,降低術后粘連再發生率有較好效果。
臨床制備羊膜時,其中的成纖維細胞層和海綿層常常被剝離,因此,制備羊膜只含有上皮層、基底層、致密層,后2層統稱為基質層,2層具有不同組織結構及生物學功能。在急性眼表損傷中,術者通常將羊膜作為起到支架作用的生物基底膜而將其基質層貼附于創面,從而使臨近有功能的角膜或結膜能夠迅速上皮化,達到重建眼表結構、預防眼表粘連形成的目的[21]。與眼表角膜、結膜生成修復不同,子宮內膜自身具有周期生長、壞死、剝脫的過程,子宮內膜剝脫后,其底部基底層增生分化,形成新的子宮內膜層,一旦基底層廣泛損傷,在基底層可以進一步分化為功能層前,創面細胞外基質滲出堆積,轉化生長因子?β1(TGF?β1)、結締組織生長因子(CTGF),ECM降解相關的基質金屬蛋白酶9(MMP?9)和金屬蛋白酶組織抑制物?1(TIMP?1)[7,22]等細胞因子合成與降解失衡導致,從而導致子宮內膜纖維化形成。因此,從宮腔粘連形成及子宮內膜生長修復角度看,羊膜在宮腔粘連中發揮的作用并非完全如同在眼表損傷中一樣作為基底層,通過促進上皮細胞爬行生長以達到修復創面的作用。
如前所述,制備羊膜通常分為上皮層和基質層,在眼科應用中,針對病變類型,羊膜有不同放置方式[23],而羊膜移植在宮腔粘連臨床應用中,將哪一面貼附向術后宮腔創面目前尚缺乏相關研究。本研究中,較之基底層面,將羊膜上皮面貼附向術后宮腔能夠更好地改善術后月經情況,降低宮腔再粘連發生率。根據羊膜不同層面結構特點及宮腔粘連發生機制,作者推測產生差異的原因可能如下。
羊膜上皮層由來源于外胚層的單層柱狀上皮組成,具有活躍的分泌功能,同時具有重塑基底膜及細胞外基質的能力[24]。羊膜上皮細胞能夠產生MMP,促進細胞外基質降解、抑制纖維化形成[25],其上皮細胞分泌的表皮生長因子(EGF)有促進細胞分裂、增生的作用,作者推測其可能對子宮內膜基底層生長分化為功能層起到一定作用;同時,羊膜上皮細胞還可以表達α1?抗胰蛋白酶、α2?巨球蛋白酶[12]等,這些生物活性酶可以促進多核白細胞凋亡,有抑制炎性反應的作用。與此相對,羊膜基質層主要由膠原層、網狀纖維和基質組成,是維持羊膜形態與強度的重要組成部分,缺乏分泌功能,主要起到的是屏障支持作用。
本研究中,宮腔粘連電切術后行羊膜移植時,將羊膜上皮面貼附于宮腔較將羊膜基質層貼附于宮腔能夠更好地降低術后宮腔再粘連發生率,改善術后月經情況。但需要指出的是,本研究所納入研究對象均為重度宮腔粘連患者,其內膜嚴重損害,幾乎已無正常子宮內膜殘存,但對于輕、中度患者,仍有子宮內膜殘留,羊膜放置方式是否會產生同樣的差異,尚缺乏相關研究。同時,結核、輻射、化學損傷等也會導致宮腔粘連的發生,但因其相對少見,本研究中并未納入相關病例。本試驗初步發現在重度宮腔粘連患者中,將羊膜上皮面貼附于宮腔有利于術后月經情況改善,可減少宮腔再粘連發生,但上述問題的存在仍提示著更深入研究的必要性。

